促育生精颗粒对环磷酰胺致少弱精症模型大鼠的影响
孙向红,王麟,孙立波,朱莉 (青岛大学医学院附属医院,山东 青岛266555)
生育对人类物种延续起着核心的作用,是民族、国家、家庭稳定的重要基石。国际卫生组织统计,过去50年来,有15%~20%的夫妻不能生育,男性生育能力缺欠占到50%以上[1]。目前对男性不育的经验性治疗效果并不理想,现代医学对此没有既经济又有效的治疗方法,只有少部分的患者可以有效地治疗。辅助生殖技术给患者治疗来了曙光,但费用极其昂贵,普通收入家庭难以承受。祖国医学这个领域有非常丰富的经验,不育症的中医药治疗具有治疗费用低廉、不良反应小、保持自然受孕过程等特点,其中对患者精子质量的改善也能提高辅助生殖的成功率。
“促育生精颗粒”是我院配方颗粒协定处方,是由淫羊藿、巴戟天、仙茅、蛇床子、杜仲、枸杞子、山萸肉、沙苑子、黄精、土茯苓、黄柏、知母、牛膝、赤芍组成,具有温阳益肾、益气填精,除湿降火的作用。临床研究表明,该方对少弱精症疗效显著,可迅速提高患者精子的成活率和活动力,有效率达85%以上[2]。在临床上应用十多年,收到了满意的效果。
影响精子生成与精子质量的因素很多,本实验通过精子凋亡率、精子活动力等指标观察探究该药物治疗少弱精症不育可能的作用机制。
1 材料
1.1 实验动物 50只清洁级雄性 Wistar大鼠,12周龄,性成熟,体质量300~350 g,由青岛药检所提供。
1.2 药品与试剂 促育生精颗粒(华润三九医药股份有限公司配方颗粒组方,批号1104211S),免煎颗粒制剂,分包装,使用时制成水溶液,根据表面积比换算成大鼠药物用量。高剂量药液相当于生药含量3.37 g·mL-1,中剂量1.69 g·mL-1,低剂量0.84 g·mL-1;环磷酰胺(江苏恒瑞医药股份有限公司,批号11092421);细胞凋亡检测试剂盒 (Biouniquer life technologies,批号 BU-AP0102);胎牛血清(HYCLONE,批号NTM0133);其他试剂为分析纯。
1.3 仪器设备 流式细胞仪(美国COULTER公司),组织切片机(LEICA公司)烤片机(中威电子仪器有限公司 ),普通双目光学显微镜公司(Olympus Optical Co.,Ltd.型号:CHL),γ-多管放射免疫计数器(众成机电公司,型号:DFM-96),低速离心机(科大创新股份有限公司中佳分公司)
2 方法
2.1 动物分组与给药 将50只大鼠饲养1周后,随机分为对照组、模型组、低剂量药物治疗组、中剂量药物治疗组、高剂量药物治疗组,每组10只。除对照组、模型组和各药物组按30 mg·kg-1腹腔注射环磷酰胺(粉针剂,用0.9%氯化钠溶解,2 h内使用),连续5 d。第6天开始,药物组剂量分别按相当于生药含量:低剂量组0.84×104mg·kg-1·d-1、中剂量组1.69×104mg·kg-1·d-1、高剂量组3.37×104mg·kg-1·d-1促育生精颗粒药物灌胃,模型组大鼠给与相同剂量的生理盐水灌胃,持续35 d。处死动物、取材。
2.2 动物取材,标本制作
2.2.1 睾丸、附睾取材 大鼠处死后,四肢固定,在大鼠阴茎上方0.5 cm处,剪开表皮,打开腹腔。从大鼠阴囊下方,挤顶,把睾丸挤入打开的腹腔。分离睾丸与附睾,附睾37℃气浴保存备用。睾丸称重,记录。睾丸组织甲醛处理:睾丸注射10%甲醛预处理30 min,用10%甲醛浸泡7 d。
2.2.2 精子取材 配置精子孵育液:137 mmol·L-1氯化钠,2.8 mmol·L-1氯化钾,1.0mmol·L-1氯化镁,12 mmol·L-1碳酸氢钠,0.4 mmol·L-1磷酸氢钠,10 mmol·L-1HEPES缓冲液,5.5 mmol·L-1果糖,0.35%BSA(W/V),pH=7.4。
把完整单侧附睾用37℃生理盐水冲洗,浸泡15 min,把附睾浸入1 mL自配精子孵育液,剪碎,200目筛过滤,分开精子与组织残片,备用,待用时间在30 min内。
2.3 精子检测
2.3.1 精子计数 取10μL精子悬液,以精子孵育液稀释100倍,混匀,再吸取稀释后精子悬液,加在牛鲍板上,光镜下,用红细胞计数区域,高倍镜下计数精子总数。
光镜下观察生殖细胞层数:制片后生精小管因挤压,大多呈椭圆型。长轴短轴比值较大。为便于观察生殖细胞层数,数据皆取长轴侧值,光镜下取10组数值取平均值。
2.3.2 精子活动力检测 稀释100倍的混匀精子悬液,吸取10μL,加在血细胞计数板上,光镜高倍镜下观察200个精子的活动情况。注意整个操作和观察在室温20~22℃,10 min内完成。根据WHO标准,将精子活动力分为4级:a.快速向前运动;b.慢或呆滞的向前运动;c.非前向运动;d.不动。
2.3.3 精子凋亡率检测 流式细胞术检测步骤:精子悬液300 g,1 150 r·min-1离心5 min,弃上清,收集精子。用精子孵育液洗涤精子,再离心,取5~10万精子。加入500μL Annexin V Binding Buffer轻轻重悬,加入5μL Annexin V-FITC,轻轻混匀,加入5μL Propidium iodide,混匀。室温(20~25℃)避光孵育10 min。用流式细胞仪检测(EX=488 nm;Em=530 nm),Annexin V-FITC为绿色荧光,PI为红色荧光,经配套软件处理,获取标本数据。
2.3.4 统计学分析 应用统计软件SPSS(edition 17.0)进行统计学分析,数据以±s表示,计量资料用一元方差分析,组间差别用t检验,P<0.05为差异有显著性,P<0.01为差异有极显著性。
3 实验结果
3.1 促育生精颗粒对大鼠附睾精子数目和精子活力的影响
从表1可知,精子数目、a级精子比率和a+b级精子比率3个指标均显示模型组与正常对照组比较存在显著差异(P<0.05),造模成功。各剂量药物治疗组精子数目、a+b级精子比率与模型组比较存在显著差异(P<0.05),说明药物治疗有效。中、高剂量药物治疗组a级精子比率与模型组比较存在显著差异(P<0.05),说明通过中剂量以上的药物治疗能提高a级精子比率。
3.2 促育生精颗粒对大鼠附睾精子凋亡率的影响
模型组与正常对照组比较,精子凋亡率上升P<0.05。各剂量药物治疗组与模型组比较,精子凋亡率明显下降P<0.05。结果见表1、图1。
图1中1区为AnnexinV反应阳性 ,PI反应阴性区,是精子凋亡结果区。2区为AnnexinV反应阳性 ,PI反应阳性区,是精子凋亡、精子坏死双染区。3区为AnnexinV反应阴性 ,PI反应阴性区,是正常精子区。4区为AnnexinV反应阴性 ,PI反应阳性区,是精子坏死区。从图中可以看出,模型组1区内的精子凋亡数目明显多于正常对照组。统计数据反映模型组与正常对照组比较精子凋亡率上升(P<0.05)。各治疗组1区内的精子凋亡数目明显少于模型组。统计数据反应各剂量药物治疗组与模型组比较精子凋亡率下降差异有显著性(P<0.05)。
3.3 促育生精颗粒对大鼠生精小管上皮生精细胞层数的影响 见表1。由表可以看出,模型组与正常对照组比较生精细胞层数减少(P<0.05),各剂量药物治疗组与模型组比较生精细胞层数增多(P<0.05)。图2为各组生精小管HE染色观察结果。统计数据HE染色观察结果一致,说明药物有效。
表1 促育生精颗粒对大鼠精子数目、精子活力、附睾精子凋亡率及生精小管上皮生精细胞层数的影响(±s,n=8)Tab 1 Effects of Cuyu Shengjing granule on the number,vitality of sperm,apoptosis rate of sperm in rats and seminiferous tubule layer(±s,n=8)
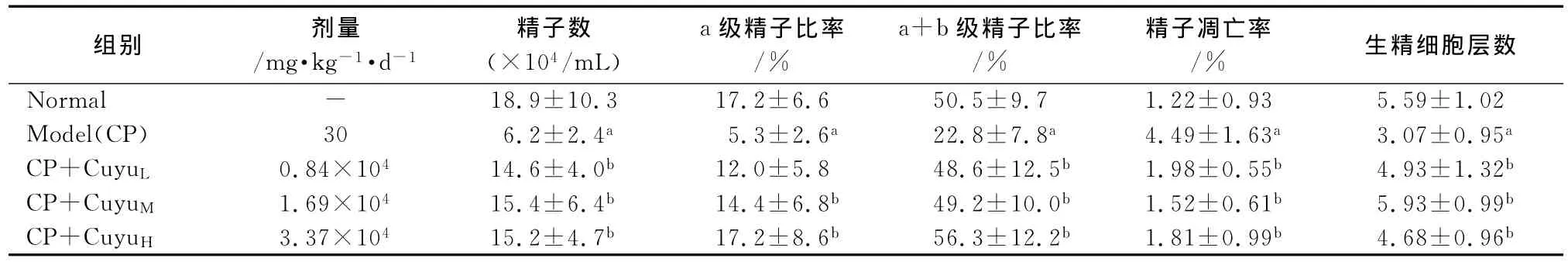
表1 促育生精颗粒对大鼠精子数目、精子活力、附睾精子凋亡率及生精小管上皮生精细胞层数的影响(±s,n=8)Tab 1 Effects of Cuyu Shengjing granule on the number,vitality of sperm,apoptosis rate of sperm in rats and seminiferous tubule layer(±s,n=8)
注:与正常对照组比较,aP<0.05;与模型组比较,b P<0.05
组别 剂量/mg·kg-1·d-1精子数(×104/mL)a级精子比率/%a+b级精子比率/%精子凋亡率/%生精细胞层数Normal - 18.9±10.3 17.2±6.6 50.5±9.7 1.22±0.93 5.59±1.02 Model(CP) 30 6.2±2.4a 5.3±2.6a 22.8±7.8a 4.49±1.63a 3.07±0.95a CP+CuyuL 0.84×104 14.6±4.0b 12.0±5.8 48.6±12.5b 1.98±0.55b 4.93±1.32b CP+CuyuM 1.69×104 15.4±6.4b 14.4±6.8b 49.2±10.0b 1.52±0.61b 5.93±0.99b CP+CuyuH 3.37×104 15.2±4.7b 17.2±8.6b 56.3±12.2b 1.81±0.99b 4.68±0.96b
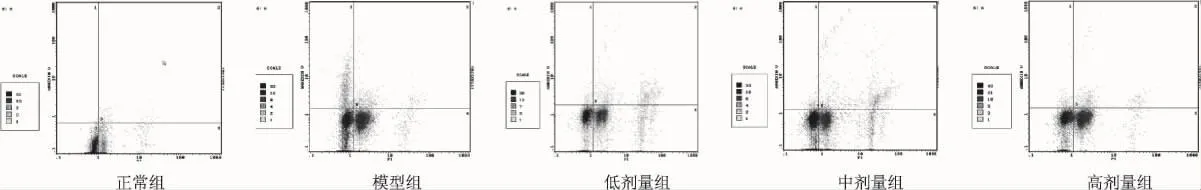
图1 精子凋亡流式细胞术检测结果Fig 1 Results of the detection on apoptosis rates of sperm by Flow cytometry
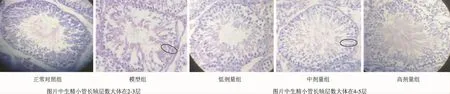
图2 促育生精颗粒对大鼠生精小管上皮生精细胞层数的影响Fig 2 Results of Cuyu Shengjing granule on the number of seminiferous cell layer of seminiferous tubule epithelial of rats
4 讨论
男性生殖力下降临床主要表现为精液质量下降,形成少精症,弱精症。少精症是指精液中的精子数目少于正常具有生育能力的数目,人类男性的精子每毫升不低于2 000万,如果低于2 000万就归为少精子症[3]。弱精子症是指精液参数中前向运动的精子(a和b级)小于50%或a级运动的精子小于25%的病症,弱精子症又称精子活力低下[4]。大鼠精子数目没有统一指标,研究中活动力分级使用人类分级方法。由试验结果可以看出,模型组精子数量由正常组189 062个降至62 142(P<0.05),其活力明显降低,而各剂量药物组可明显增加精子数量和精子活力。提示促育生精颗粒可提高少弱精症患者精子数量和活力。
精子凋亡是精子发生过程中一个重要特征,对维持正常精子数量起着重要作用,但过多精子凋亡则是一种病理现象[5-6]。精子过多凋亡可能是弱精子症不育的重要原因[7-8]。精子凋亡中DNA的损伤占据了重要位置,但是精子核DNA损伤的机制目前尚未明了,可有3种机制:(1)氧化应激反应(oxidative stress):生理性浓度的活性氧(reactine oxygen species,ROS)有助于精子获能和顶体反应,但高浓度的ROS则造成精子DNA的损伤,导致精子DNA产生单链或双链断裂。(2)精子染色质组装缺陷与分离异常:染色质的组装需要内源性核酶参与,以建立和连接DNA缺口,有助于鱼精蛋白替换组蛋白过程中开释扭力(torsional stress)和染色体重组。精子染色质组装异常会导致精子单链和双链DNA断裂,精核DNA损伤。(3)凋亡精子异常发生:正常情况下睾丸生精细胞分化之前需要经过多轮有丝分裂而克隆扩展,必须要经过凋亡等机制控制其数目,保持精子在数量、形态和功能上的平衡。生精细胞表面蛋白Fas能启动精子凋亡。
环磷酰胺(CP)是临床常用抗肿瘤药物,也常用作免疫抑制剂,临床观察其对男性生殖系统有损伤的副作用和对后代潜在致畸风险,常作为少精症和弱精症模型的诱导剂[9]。有学者认为,CP诱导作用机理主要通过:(1)阻碍精原细胞自我更新增殖及分化功能。精原细胞既要分化生成精子,同时还要保持精原细胞的数量而不断增值。精原细胞通过不对称有丝分裂完成两部分职能,即染色体平均分配而细胞质不平均分配。CP干扰了这一过程,影响了有丝分裂,同时减少了精原细胞数目和分化的精子数目[10]。(2)破坏精子发生的微环境。精子分化需要许多细胞的共同作用,生精小管为精子成熟提供了必要环境。生精小管由各种不同细胞组成,CP非特异的杀伤作用,可损伤包括间质细胞,支持细胞等与生精密切相关的细胞,损伤微环境,影响新细胞生成[11-12]。(3)引起精细胞凋亡,微环境破坏释放了许多凋亡信号,诱导已有细胞凋亡[6-7]。(4)损伤各种细胞遗传物质,直接杀死细胞。生殖细胞中,由于DNA合成复制活跃,细胞分裂周期S期的细胞数量大,减数分裂本身的高复杂性,使其更易被药物影响,效果较明显。
本实验中促育生精颗粒对大鼠附睾精子凋亡率的影响可以看出,模型组睾丸精子的调亡率由正常对照组的1.22%上升到4.49%,P<0.01,而经药物干预后则明显地逆转了这一结果。
睾丸是精子生成的场所。睾丸表面有一层坚硬的纤维膜,即白膜,白膜沿睾丸后缘增厚,深入睾丸内形成纵隔。在纵隔上发出结缔组织小隔,将睾丸分成许多睾丸小叶。睾丸小叶内即是盘曲的生精小管,精子生成主要在生精小管中完成。通过CP的作用,破坏这数层细胞,就可以降低生精能力[7]。通过HE染色,镜检睾丸切片可以观察到生精小管上皮层数和管腔精子数,便于了解造模剂、药物对生精小管的影响,了解细胞层面的变化,反映生精能力。观察结果表明:模型组中,诱导剂发挥了作用,与其他组相比,生殖细胞层数减少,细胞总数减少,管腔中精子减少生精小管间隙变大,排列变得疏松。提示精子发生微环境遭到破坏,生成精子的能力下降。药物治疗后,各剂量组与模型组相比,生殖细胞层数增加,管腔中精子增加,生精小管间隙变小,排列变得紧密,精子发生微环境得到一定恢复,细胞凋亡得到改善,精子数量和活力得以提高。
[1]World Health Organization.WHO manual for the standardised investigation and diagnosis of the infertile couple[M].Cambridge:Cambridge University press,2000:18.
[2]王鸿根,董加花.促育生精免煎颗粒治疗少弱精症不育症150例临床观察[J].中医杂志,2010,10(15):123-126.
[3]王国洪,许瑞吉,张仲书,等.少精子症患者血清、精浆中游离睾酮水平的测定及意义[J].中华男科学杂志,2004,10(9):684-685.
[4]吴励梅,李林.精子形态与活动力的相关性及其在男性不育症中的诊断意义[J].临床研究,2011,(19):3-4.
[5]Calogero A,Polosa R.Cigarette smoke extract immobilizes human spermatozoa and induces sperm apoptosis[J].Reprod Biomed Online,2009,19(4):564-571.
[6]Ji G,Gu A,Hu F.Polymorphisms in cell death pathway genes are associated with altered sperm apoptosis and poor semen quality[J].Hum Reprod,2009,24(10):2439-2446.
[7]刘媛,刘睿智,吴迪.少精子症、弱精子症和畸形精子症患者精子凋亡率比较[J].吉林大学学报医学版,2006,(5):869-871.
[8]景晓玮.弱精子症患者精子中CRISP2基因及其蛋白产物的初步研究[D].广州:南方医科大学,2011.
[9]Rezvanfar M,Sadrkhanlou R.Protection of cyclophosphamide-induced toxicity in reproductive tract histology,sperm characteristics,and DNA damage by an herbal source[J].Hum Exp Toxicol,2008,27(12):901-910.
[10]Fuentealba LC,Eivers E.Asymmetric mitosis:Unequal segregation of proteins destined for degradation[J].Proc Natl Acad Sci USA,2008,105(22):7732-7737.
[11]Brinkworth MH,Nieschlag E.Association of cyclophosphamide-induced male-mediated,foetal abnormalities with reduced paternal germ-cell apoptosis[J].Mutat Res,2000,447(2):149-154.
[12]Türk G,Ceribasi AO.Antiperoxidative and anti-apoptotic effects of lycopene and ellagic acid on cyclophosphamide-induced testicular lipid peroxidation and apoptosis[J].Reprod Fertil Dev,2010,22(4):587-596.
[13]Martínez-Maza O,Moody DJ.Increased spontaneous immunoglobulin secretion associated with cyclophosphamide-induced immune suppression[J].Clin Immunol,1987,7(2):107-113.
