罗甸县不同种源麻风树抗寒生理生态学研究
欧国腾 ,詹 鹏 ,江 赢 ,石 旺 ,陈介南
(1.罗甸县林业局,贵州 罗甸 550100;2. 国家林业局 生物乙醇研究中心,湖南 长沙 410004;3. 中南林业科技大学 生物环境科学与技术研究所,湖南 长沙 410004)
罗甸县不同种源麻风树抗寒生理生态学研究
欧国腾1,詹 鹏2,3,江 赢1,石 旺2,3,陈介南2,3
(1.罗甸县林业局,贵州 罗甸 550100;2. 国家林业局 生物乙醇研究中心,湖南 长沙 410004;3. 中南林业科技大学 生物环境科学与技术研究所,湖南 长沙 410004)
通过对贵州省罗甸县2011年初不同种源麻风树冻害情况的调查与分析,并通过植株内源保护酶活性及遗传基因图谱分析,研究麻风树抗寒生理生态学特性。结果表明:随着海拔的升高,麻风树冻害程度逐步加重;罗甸县高里村与红水河镇麻风树具有较强的亲缘关系;虽然罗甸林场麻风树与高里村、红水河镇麻风树的亲缘关系较远,但其抗寒基因表达较强。综合分析得出,不同种源麻风树抗寒能力为高里村>林场>红水河镇>纳翁村。
麻风树;抗寒;生理生态学;罗甸
麻风树Jatropha curcas是大戟科麻风树属Jatropha的植物,广泛分布于热带及亚热带地区,在我国的云南、四川、贵州、广东等都有分布,可在年降水量480~2 380 mm、年气温18.0~28.5℃、海拔1 000 m以下的环境下生存[1]。麻风树生长繁殖快,耐贫瘠干旱,是绿化荒山、水土保持的良好树种;其种仁含油率高达50%~60%,是世界范围内研制生物柴油的热门植物[2-3]。低温是阻碍麻风树生长和分布的重要环境因子,也是制约麻风树制取生物柴油产业发展的重要因素。研究麻风树的抗寒生态学性质,有助于了解麻风树的生长习性,对抗寒抗冻优质树种引种栽培、提高麻风树的种植规模、保障生物柴油原料资源的大规模供应具有重要意义。
目前国内对麻风树低温抗寒抗冻性研究已有少量报道。罗通等[4]从叶绿素含量、根系活力、生物膜通透性、膜脂不饱和脂肪酸含量等方面进行了低温对麻风树生理指标的影响研究。毛俊娟等[5]以攀枝花地区麻风树为材料,研究不同浓度酸铝胁迫对3月龄麻风树幼苗根系活力、叶片丙二醛含量、叶片脯氨酸含量、过氧化物酶活性等生理指标的影响。樊哲仁等[6]通过测定种子发芽率、发芽指数、活力指数、丙二醛含量和酶活性等指标,调查硅对盐胁迫下麻风树的生理影响。丁蕾等[7]对不同种源麻风树进行播种育苗试验,通过测试苗高、地径生长,对比分析得出不同种源的抗寒性有较大差异。已有报道中绝大多数仅进行低温与麻风树生理生化指标关系研究,未从麻风树种源的基因水平分析低温与麻风树抗寒特性的生态学关系,缺乏麻风树遗传基因水平上对抗寒性的认知。
2011年初我国南方遭遇特大冻雨、雪凝灾害,且范围广,降温幅度大,持续时间长,给麻风树带来了极其严重的冻害现象,大量麻风树冻伤或冻死。本文中通过对贵州省罗甸县不同种源麻风树冻害情况的调查与分析,并通过植株内源保护酶活性(超氧化物歧化酶、过氧化物酶、过氧化氢酶)及遗传基因图谱分析,获得麻风树抗寒生态学特性,以期为筛选出抗冻害优质麻风树资源及麻风树的引种栽培提供借鉴。
1 研究区域自然概况
罗甸县位于贵州南部边缘,地处106°23′~107°03′E、25°04′~ 25°45′N,总面积 3 013 km2,是云贵高原向桂西北山区与丘陵过渡的斜坡地带,地势北高南低,呈阶梯式下降。境内属于亚热带季风气候,具有春早、夏长、秋迟、冬短的特点,日照为1 350~1 520 h,年平均温度达20℃,极端最高气温40.5℃,极端最低气温零下3.5℃,年均降水量为1 335 mm,无霜期335 d左右,气候温和,雨量充沛,资源丰富,有“天然温室”之称。抽样调查地点设在罗甸县沫阳镇林勒村和那翁村及茂井乡的高里村,海拔高度500~900 m,土壤类型为黄壤、砂壤和风化石砾土3种。
2 材料与方法
2.1 试验材料
在罗甸县1年生麻风树人工林随机选取1 m×1 m的样地,并将植株全部挖起,逐株查看其冻害情况,调查其茎、根的冻害情况(见图1)。同时采取不同种源的麻风树叶,并放入液氮罐中固定,带回实验室用于分析测定。
2.2 实验方法
2.2.1 冻害程度调查
① 冻害植株百分率:表现有冻害的植株占调查植株总数的百分数;② 冻害指数:对调查的麻风树植株逐株确定其冻害程度,冻害程度分为:0级,植株正常,茎和根没受冻害;1级,茎尖冻伤,侧根及主根没受冻害;2级,枝条冻伤,根部轻微冻害,侧根受冻变色,主根没受冻害;3级,枝条大部受冻,根部中度冻害,主根根尖及侧根受冻变色;4级,全株受冻,根部重度冻害,主根冻死并脱皮变色,植株死亡。分株调查后,按公式(1)计算冻害指数(I)[8]:
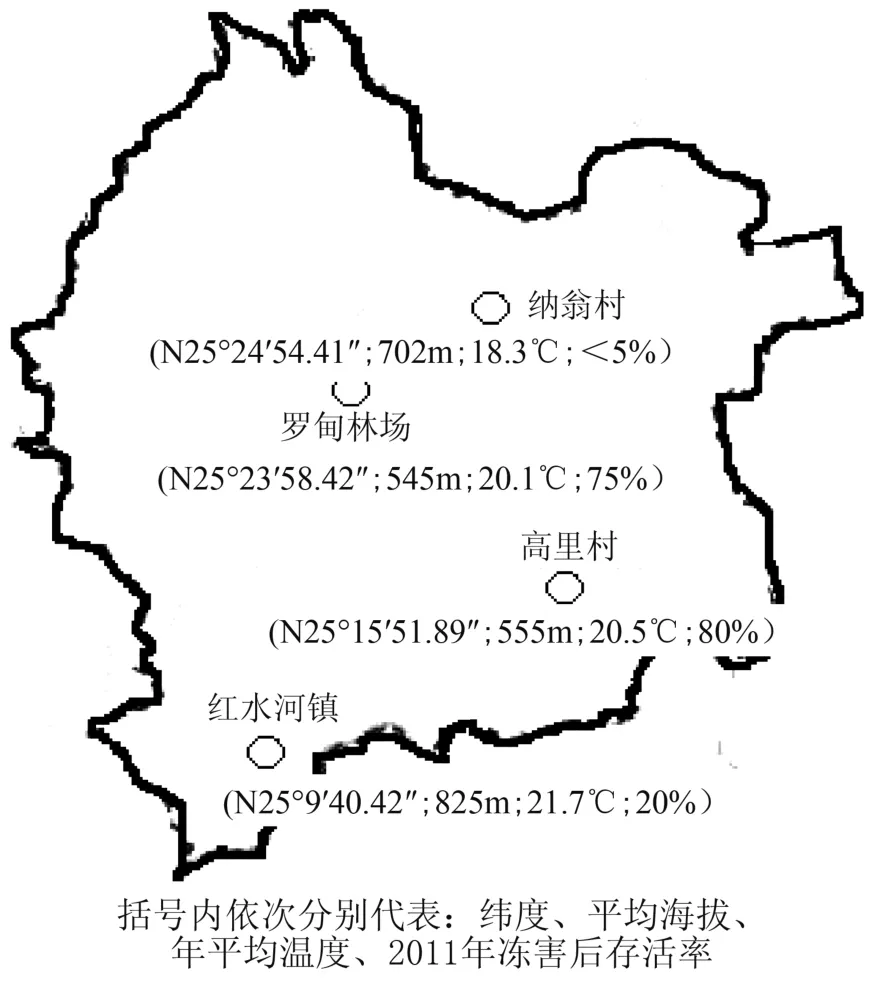
图1 罗甸县不同种源麻风树样地分布Fig. 1 Distribution of different provenances J. curcas sample plots in Luodian County
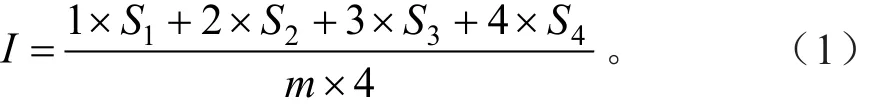
式(1)中:I为冻害指数;m为调查总株数;S1、S2、S3、S4为各样地中表现为1~4级冻害的麻风树株数。
2.2.2 抗氧化酶活力
酶液的提取采用改进的赵梅等[9]的方法:从液氮罐中取出待测样品2 g于预冷研钵中,加入酶提取(磷酸缓冲液,pH值为7.8),冰浴上研磨成匀浆,4℃下12 000 r/min离心20 min,取上清液用于抗氧化酶活力的测定。
超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光还原法[10],以每克植物鲜质量抑制NBT光化还原量为酶活单位;过氧化物酶(POD)活性采用愈创木酚法[11],以每克植物鲜质量每分钟氧化 1 μmol愈创木酚为一个酶活单位;过氧化氢酶(CAT)活性采用H2O2-碘量法[12],以每克植物鲜质量每分钟分解 1 μmol H2O2为1个酶活单位。
2.2.3 RAPD-PCR
麻风树DNA提取方法参考李静等[13]的CTAB法,RAPD-PCR方法采用Ganesh等[14]的方法,所用RAPD-PCR引物如表1所示。
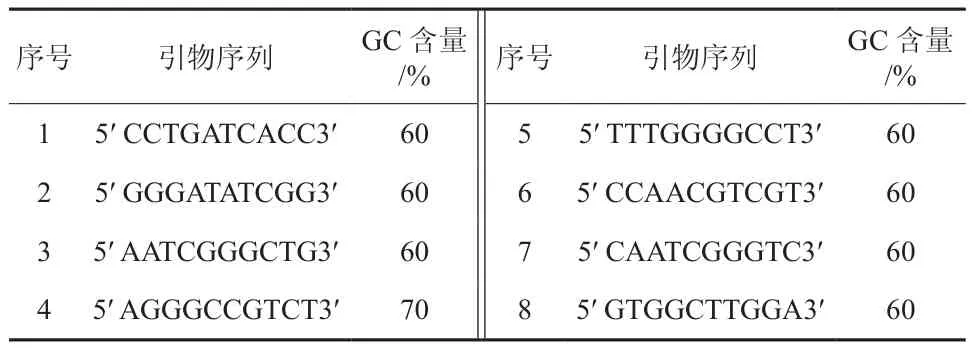
表1 引物序列Table 1 RAPD random primer sequences
3 结果与分析
3.1 调查结果
2010年12月25日至2011年2月22日,罗甸县经历了持续长时间的低温冰冻天气(见图2),尤其是1月日平均气温5.8 ℃,日平均最高温8.4℃,日平均最低温4.0 ℃,月最高温13.2 ℃,月最低温0.6 ℃。2010年12月25日至2011年2月22日,日均气温10 ℃以下天数41 d,低温持续时间长,为罗甸县麻风树带来毁灭性破坏。
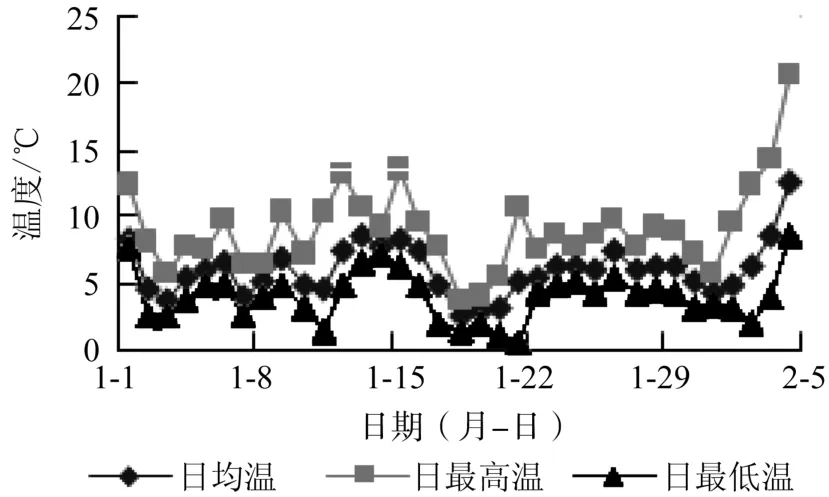
图2 2011年初罗甸县气温变化曲线Fig.2 Change curves of temperature in Luodian countyin early 2011
如表2所示,海拔500 m以上植株全部受冻,受冻率为100%,冻害指数25~100;海拔500~550 m的麻风树冻害多为1~3级,冻害指数25~71.6;在海拔550 m以上,1年生实生苗冻害多为2~3级,冻害指数为67。海拔500~555 m处麻风树受冻部位主要在地上部的枝条末端及地下部的侧根;海拔>555 m处麻风树表现为全株冻死。枝条末端冻伤症状为植物组织颜色变黑、失水干枯、表皮皱缩,部分粗枝和主干似被开水烫过呈不规则水渍状的冻斑。整株冻死麻风树的根表现为表皮开裂易脱落且大面积变黑或呈深褐色,深达木质部,并有很浓的酒糟味。通过表2综合比较,不同种源麻风树抗冻性由强至弱为高里村>林场>红水河镇>纳翁村。
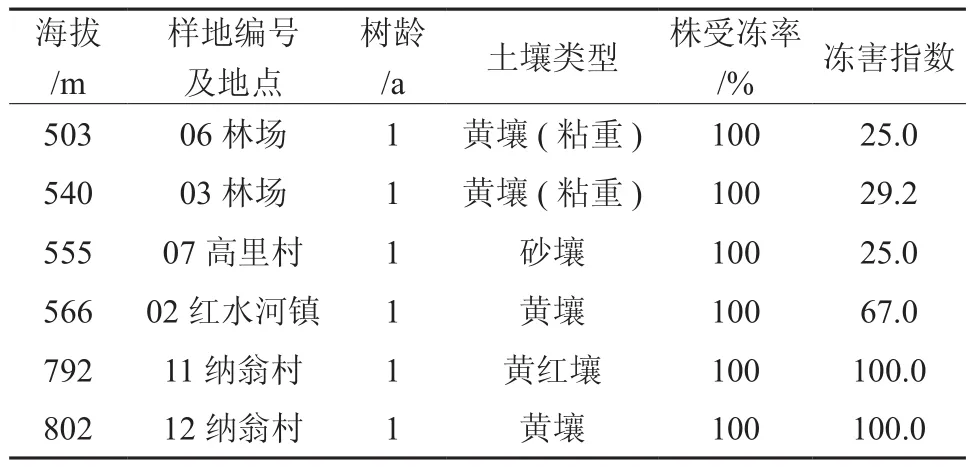
表2 不同海拔麻风树的冻害情况Table 2 Frozen injury of J. curcas at different altitudes
3.2 叶片抗氧化酶活力
植物的抗寒性与活性氧代谢关系密切,低温胁迫下植物体内会产生大量的H2O2、OH-等活性氧自由基,可导致膜脂过氧化,进而造成膜系统的氧化损伤。为了避免这种氧化损伤,植物体内也存在着一系列酶促的和非酶促的抗氧化剂、活性氧自由基,保护植物细胞免受活性氧的伤害,维持膜系统的稳定性,以增强植株的抗寒力。
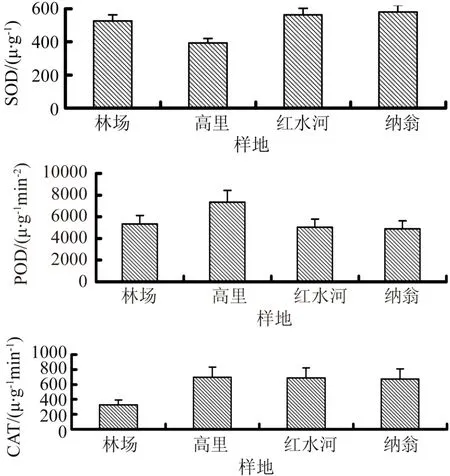
图3 不同种源麻风树的酶活性Fig.3 Enzyme activity of different provenances J. curcas
如图3所示,对SOD酶,纳翁村(581 μ·g-1)>红水河镇(563 μ·g-1)>林场(526 μ·g-1)>高里村(394 μ·g-1);对POD酶,高里村(7 348 μ·g-1min-2)>林场(5 319 μ·g-1min-2)>红水河镇(5 026 μ·g-1min-2)>纳翁村(4 897 μ·g-1min-2);对CAT酶,红水河镇(694 μ·g-1min-1)>高里村(687 μ·g-1min-1)>纳翁村(675 μ·g-1min-1)>林场(326 μ·g-1min-1)。不同种源地麻风树的抗氧化酶存在差异性。
SOD、POD、CAT是清除活性氧过程中最主要的抗氧化酶类。SOD能及时清除活性氧和自由基,其活性的大小与植物体的抗性是密切相关的。POD酶促降解植物体内积累的H2O2,避免因H2O2的过量积累导致毒性更大的OH-含量增加而对细胞膜产生伤害。CAT能消除细胞内过多的H2O2,维持其在一个低水平,从而保护膜的结构。李远发等[7]对麻风树抗寒性研究报道,发现POD酶活与抗寒性具有显著的正相关性,SOD酶活与抗寒性呈一定的负相关性,SOD、CAT酶活与抗寒性的关系不显著。通过分析3种酶活性可得,不同种源麻风树抗寒性强弱为:高里村>林场>红水河镇>纳翁村,与麻风树抗寒性调查结果一致。
3.3 不同种源麻风树亲缘关系研究
所提取麻风树DNA 样本的色泽为白色或近白色,采用核酸和蛋白质含量测定仪(Gene Quant Pro)检测 260、280 nm 波长处的光吸收比值 OD260/OD280为 1.875, 计算得 DNA 产率为 0.346 μg/L。如图4所示,各样地麻风树样本基因组 DNA 电泳得到的条带可进行后续RAPD-PCR分析。
图4 麻风树总DNA电泳图Fig.4 DNA electropherogram of different provenances J. curcas
由图5可知,各样本均扩增出3~4个条带。综合对比1~4号样本,各样本的特异性条带不明显;1、4号样有3个条带,2、3号样有4个条带。通过DPS软件进行WPGMA聚类分析(见图6)可得,高里村、红水河镇麻风树亲缘性较近;林场麻风树与高里村、红水河镇麻风树具有较远的亲缘性关系;纳翁村麻风树与高里村、红水河镇麻风树也具有较远的亲缘关系。在麻风树种源地缘上,林场种源来自于云南省红河州,高里村、红水河镇、纳翁村麻风树均为罗甸县本地种源。然而,对比抗寒性调查及抗氧化酶活实验结果,林场麻风树抗寒性仅次于高里村麻风树,可能的原因是虽然扩增出的DNA多态性不强,但麻风树抗寒基因的表达较强。各种源地麻风树抗寒基因的表达需要做进一步的研究。
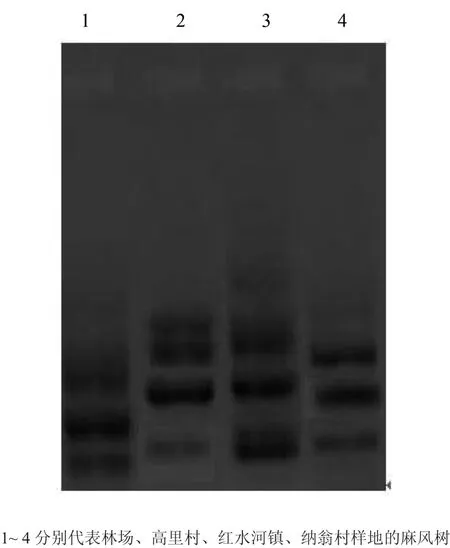
图5 不同种源麻风树RAPD电泳图Fig. 5 RAPD amplif i cation results of different provenances J. curcas

图6 WPGMA聚类图Fig.6 WPGMA cluster analysis
4 结 论
通过实地调查、分析测试罗甸县不同种源麻风树内源保护酶及遗传基因图谱,获得罗甸县境内麻风树造林宜在海拔550 m以下。高里村与红水河镇麻风树具有较强的亲缘关系。虽然林场麻风树与高里村、红水河镇麻风树的亲缘关系较远,但因其抗寒基因表达较强,抗寒能力较好,可以作为抗寒性优质种源。罗甸县不同种源麻风树抗寒能力强弱为高里村>林场>红水河镇>纳翁村,综合考虑可选高里村和林场麻风树为抗寒性优质种源。
[1] 贺余伟.中国麻风树生物能源产业化调研[J].生物产业技术,2008, 5:100-103.
[2] 莫丽芬,唐建维, 刀祥生,等.林分密度对小桐子生物量及其产量的影响[J].中南林业科技大学学报,2010,30(4):61-68.
[3] Sudhakar J T, Nalini E M S. Molecular approaches to improvement ofJatropha curcasLinn. as a sustainable energy crop[J]. Plant Cell Rep., 2011, 30(9):1573-1591.
[4] 罗 通, 马丹炜, 邓鹜远,等. 低温对麻风树生理指标的影响[J].中国油料作物学,2005,27(4):50-54.
[5] 毛俊娟, 王胜华, 陈 放. 不同温度和铝浓度对麻风树生理指标的影响及外源钙的作用[J].北京林业大学学报,2007, 29(6):201-205.
[6] 樊哲仁, 王晓东, 唐 琳. 硅对盐胁迫下麻风树种子萌发及幼苗生长的影响[J]. 中国油料作物学, 2010,32(2):217-221.
[7] 丁 蓄,韦小丽,周小东,等.不同种源麻疯树苗期生长特性比较分析[J].中南林业科技大学学报,2010,30(7):55-61.
[8] 张学昆,张春雷,廖 星,等. 2008年长江流域油菜低温冻害调查分析[J]. 中国油料作物学报,2008, 30(1): 122-126.
[9] 赵 梅,周瑞莲,刘建芳,等.冬季融冻过程中白三叶叶片抗氧化酶活力和渗透调节物含量变化与抗冻性的关系[J].生态学报,2011,31(2):306-315.
[10] Sundar D, Perianayaguy B, Reddy A R. Localization of antioxidant enzymes in the cellualar compartments of sorghum leaves[J].Plant Growth Regul.,2004,44(2):157-163.
[11] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003 : 123-276.
[12] 邹 琦. 植物生理学实验指导[M]. 北京: 中国农业出版社,2000.
[13] 李 静, 曾德贤, 吴子欢,等.麻风树(Jat ropha curcasL. )种子总DNA提取方法的建立和优化[J].西南农业学报,2011,24(2): 728-731.
[14] Ganesh R S, Parthiban K T, Senthil K R,et al. Genetic diversity amongJatrophaspecies as revealed by RAPD markers[J]. Genet Resour Crop Ev., 2008,55:803-809.
Physioecology study on cold resistance of different provenances Jatropha curcas in Luodian county
OU Guo-teng1, ZHAN Peng2,3, JIANG Ying1, SHI Wang2,3, CHEN Jie-nan2,3
(1. Luodian County Bureau of Forestry, Luodian 550100, Guizhou, China; 2. Bio-ethanol Research Center of Forestry Ministry,Changsha 410004, Hunan, China; 3. Institute of Biological and Environmental Science and Technology, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
Through investigating the frozen injury of different provenancesJatropha curcasduring early 2011 in Luodian, Guizhou, and analyzing endogenous protection enzyme activities and genetic spectrums, the physioecology of cold resistance of theJ. curcaswere studied. The results show that the frozen injury degree increased gradually with the increase of altitude; A strong genetic relationship ofJatropha curcasexisted between the ones in Gaoli Village and in Red water Town; Though, there was a distant genetic relationship ofJatropha curcasbetween the ones in Luodian Forest Farm and Gaoli Village, the cold resistance gene expressed strongly. The order of cold tolerance of differentJatropha curcaswas Gaoli Village> Luodian Forest Farm > Red water Town > Naweng Village.
Jatropha curcas; cold resistance; physioecology; Luodian county
S722.3+3
A
1673-923X(2013)01-0011-04
2012-10-15
国家林业公益性行业科研专项项目(200904038);国家林业局麻疯树种质资源保存库项目
欧国腾(1974-),男,贵州黎平人,高级工程师,主要从事林业监测、防治工作
陈介南(1961-),男,湖南益阳人,教授,博士,主要从事林业生物质能源研究;E-mai:chenjny@gmail.com
[本文编校:谢荣秀]
——林汉筠诗集《遇见红水河》阅读印象

