食品安全级固定化载体-壳聚糖微球制备的条件
吴巧丽张少凡孙 洋钱 方
(1.大连工业大学食品学院,辽宁 大连 116034;2.吉林省轻工业设计研究院,吉林 长春 130012;3.大连工业大学信息科学与工程学院,辽宁 大连 116034)
食品安全级固定化载体-壳聚糖微球制备的条件
吴巧丽1张少凡2孙 洋3钱 方1
(1.大连工业大学食品学院,辽宁 大连 116034;2.吉林省轻工业设计研究院,吉林 长春 130012;3.大连工业大学信息科学与工程学院,辽宁 大连 116034)
研究壳聚糖固定化微球载体制备的最佳条件,为进一步用食品安全级载体——壳聚糖固定化乳糖酶提供理论基础。用凝聚/沉淀法制备壳聚糖微球载体。结果表明,20 g/L壳聚糖(1%冰乙酸溶液),以距凝结液面20~30 cm滴入终浓度20%NaOH和30%甲醇的凝结液中,液滴刚滴入时不搅拌。该条件下制得直径为(4.00±0.06)mm,平均重量(30.80±0.02)mg/个,每个壳聚糖载体的比表面积为4.08×10-4m2/g,形状完整,大小均一,具有弹性。
壳聚糖;微球载体;固定化
壳聚糖是甲壳质脱乙酰化的衍生物。是目前发现的唯一的一种天然的碱性多糖,其在材料工业、化妆品、纺织、印染、造纸、生物医药、环保、农业等多方面具有广泛用途[1,2]。壳聚糖分子中存在氨基,不溶于水、碱和有机溶剂,但溶于稀有机酸及盐酸等部分无机酸。其来源丰富,成本低廉,机械性能好,化学性质稳定,且生物相容性好,易生物降解,对酶无毒,易于成型,使固定化酶的外型能满足生化反应器的结构要求,是一种具有良好开发利用前景的固定化酶载体[3]。国外利用壳聚糖作载体,固定化了碱性蛋白酶、过氧化氢酶、葡萄糖苷酶等[4-6]。中国相关固定化的有纤维素酶、脲酶、半纤维素酶、木瓜蛋白酶和胰蛋白酶等[7-11]。本试验以壳聚糖为研究对象,探寻制备壳聚糖微球载体的最佳条件,为进一步研究用食品安全级载体-壳聚糖固定化乳糖酶提供理论依据。
1 材料与设备
1.1 试剂
壳聚糖(脱乙酰度≥90%):食品级,大连鑫蝶甲壳素有限公司;
氢氧化钠、冰乙酸、甲醇、甲醛等:均为分析纯。
1.2 主要仪器与设备
精密p H计:PHS-3C型,上海雷磁仪器厂;
电热恒温鼓风干燥箱:DHG-9070A型,上海精宏实验设备有限公司;
电热恒温水浴锅:DK-S22型,上海精宏实验设备有限公司。
1.3 方法
1.3.1 壳聚糖载体评价 根据壳聚糖的溶解情况、溶液状态,滴入凝结液中的成膜状况,制得微球的形状、大小等诸方面进行评价。
1.3.2 凝结液组成的确定 20 g/L壳聚糖(1%冰乙酸),分别滴入终浓度20%NaOH和30%甲醇、20%NaOH和30%甲醛的凝结液中,观察微球载体性状以确定凝结液的组成。
(1)NaOH 浓度的确定:20 g/L壳聚糖(1%冰乙酸),分别滴入终浓度30%甲醇和5%,10%,15%,20%NaOH的凝结液中,观察微球载体性状以确定凝结液中NaOH的浓度。
(2)甲醇浓度的确定:20 g/L壳聚糖(1%冰乙酸),分别滴入终浓度20%NaOH和5%,10%,15%,20%甲醇的凝结液中,观察微球载体性状以确定凝结液中甲醇的浓度。
1.3.3 壳聚糖浓度的确定 0.10 g壳聚糖分别溶于2.5,5.0,10.0,20.0 m L 1% 冰 乙 酸 溶 液 中,制 得 5,10,20,40 g/L壳聚糖溶液,滴入终浓度20%NaOH和30%甲醇的凝结液中,观察微球载体性状以确定壳聚糖的浓度。
1.3.4 冰乙酸浓度的确定 0.10 g壳聚糖,分别溶于5 m L 1%,5%,10%,15%,20%冰乙酸溶液中,滴入终浓度20%NaOH和30%甲醇的凝结液中,观察微球载体性状以确定冰乙酸的浓度。
1.3.5 液滴滴入高度的确定 20 g/L壳聚糖(1%冰乙酸)溶液,分别在距离凝结液液面<10 cm,20~30 cm,>30 cm的高度滴入终浓度20%NaOH和30%甲醇的凝结液中,观察微球载体性状以确定滴液高度。
1.3.6 搅拌的影响 20 g/L壳聚糖(1%冰乙酸),滴入终浓度20%NaOH和30%甲醇的凝结液中,分别在滴入凝结液中时进行搅拌和不搅拌操作,观察微球载体性状,以确定有无搅拌对微球载体性状的影响。
2 结果与分析
2.1 凝结液的组成确定
壳聚糖是甲壳质脱乙酰化的产物,具有很多游离氨基。不溶于水、碱和有机溶剂,但溶于稀有机酸及盐酸等部分无机酸。为提高壳聚糖固定化乳糖酶的效果,本试验对壳聚糖微球载体的制备进行系统研究。
由于壳聚糖分子结构存在大量氨基,具酸溶、碱及有机溶剂沉淀的特性,本试验研究了不同凝结液对壳聚糖微球载体性状的影响,将壳聚糖(1%冰乙酸)溶液滴入不同组成的凝结液中,制得微球载体的性状见表1。

表1 凝结液组成对壳聚糖载体性状的影响Table 1 Affection of concretion liquid composition on character of chitosan support
由表1可知,凝结液20%NaOH与30%甲醇之组合,所制得的壳聚糖微球载体有弹性,不易破碎,可以长期使用。而20%NaOH与30%甲醇组合,其制得的壳聚糖微球载体则质软且易破碎。因此确定凝结液由NaOH和甲醇组成。
2.2 NaOH浓度的确定
为了研究凝结液中不同NaOH浓度对壳聚糖微球载体性状的影响,将壳聚糖(冰乙酸)溶液滴入由同一浓度的甲醇和不同浓度NaOH组成的凝结液中,制得微球载体的性状见表2。

表2 NaOH浓度对壳聚糖载体性状的影响Table 2 Affection of NaOH concentration on character of chitosan support
由表2可知,凝结液中NaOH浓度为0%时,壳聚糖液滴不能形成固化膜且不能在凝结液中形成微球,随着NaOH含量的增加,所形成微球的性状更加稳定,且具有一定的弹性。因此,确定凝结液中NaOH浓度为20%。
2.3 甲醇浓度的确定
为了研究凝结液中不同甲醇浓度对壳聚糖微球载体性状的影响,将壳聚糖(冰乙酸)溶液滴入由同一浓度NaOH和不同浓度甲醇组成的凝结液中,制得微球载体的性状见表3。

表3 甲醇浓度对壳聚糖载体性状的影响Table 3 Affection of methanol concentration on character of chitosan support
由表3可知,凝结液中甲醇浓度低于10%时,不能在液滴内外形成足够压力差使壳聚糖液滴收缩,制得的壳聚糖微球载体质软易碎;浓度高于20%时,能形成大量的壳聚糖微球;达到30%时,制得的微球载体形状完整,大小均一。综上可确定凝结液组成为终浓度的20%NaOH和30%甲醇。
2.4 壳聚糖浓度的确定
为了研究壳聚糖浓度对微球载体性状的影响,将不同浓度的壳聚糖(冰乙酸)溶液滴入凝结液中,制得微球载体的性状见表4。
由表4可知,壳聚糖浓度低于5 g/L时,瞬间沉淀的壳聚糖分子较少,不足以联成固化膜或交联网,故不能成球;而浓度高于40 g/L时,溶液黏度大,不易操作。因此确定壳聚糖浓度为20 g/L。
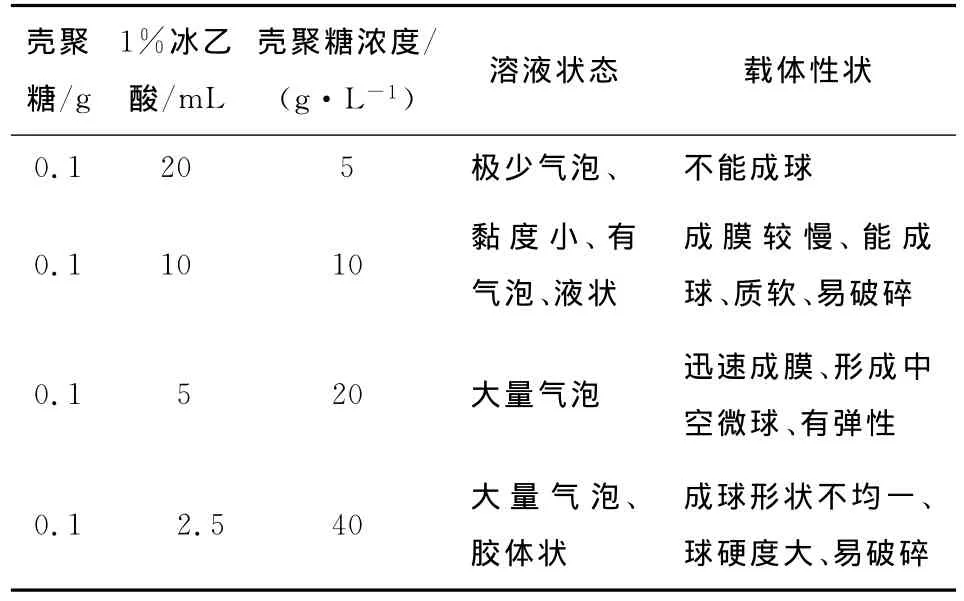
表4 壳聚糖浓度对壳聚糖微球载体性状的影响Table 4 Affection of chitosan concentration on character of chitosan support
2.5 冰乙酸浓度的确定
为了研究冰乙酸浓度对壳聚糖载体性状的影响,用不同浓度的冰乙酸配制壳聚糖溶液,滴入凝结液中制得微球载体的性状见表5。

表5 冰乙酸浓度对壳聚糖载体性状的影响Table 5 Affection of acetic acid concentration on character of chitosan support
由表5可知,随着冰乙酸浓度的增大,溶解现象逐渐增大,不能形成固化膜、制成中空微球。因此,确定用1%的冰乙酸溶液配制壳聚糖溶液。
2.6 滴入液滴高度的确定
为了研究壳聚糖溶液的滴入高度对微球载体性状的影响,以距离凝结液面不同的高度将壳聚糖溶液滴入凝结液中,制得微球载体的性状见表6。

表6 滴液高度对壳聚糖载体性状的影响Table 6 Affection of drip height on character of chitosan support
将20 g/L壳聚糖(1%冰乙酸)溶液滴入凝结液中,滴液的高度直接影响球形壳聚糖微球载体的大小。当距液面高度低于10 cm或高于30 cm时,微球所受液面的压力过大,制得微球载体呈现扁圆形。因此,以距离液面高度20~30 cm为宜。
2.7 搅拌的影响
为了研究搅拌情况对壳聚糖载体性状的影响,将壳聚糖溶液滴入凝结液时有搅拌时,所形成的固化膜变形,产品形状不完整;而没有搅拌时,能形成状态良好的球形固化膜,产品形状完整。
壳聚糖微球载体在制备过程中,若有搅拌,可能导致部分液滴表面固化膜的破裂,引起液滴破碎、合并、粘连,液滴表面固化膜厚度不均匀,形状不完整、大小不均一;若无搅拌,得到的球形产品形状完整、大小均一。因此,滴入液滴的初始阶段可采取不搅拌操作。
2.8 壳聚糖微球载体制备
壳聚糖微球载体制备的最佳条件:将20 g/L壳聚糖(1%冰乙酸)溶液,以距离凝结液面20~30 cm的高度滴入终浓度20%NaOH和30%甲醇的凝结液中,不搅拌。制得的壳聚糖微球载体形状完整,大小均一,具有弹性。
用游标卡尺测量壳聚糖微球载体平均直径为(4.00±0.06)mm,平均重量为(30.80±0.02)mg/个,每个壳聚糖微球载体的比表面积为4.08×10-4m2/g。
1 Majeti N V,Ravi Kumar.A review of chitin and chitosan applications[J].Reactive and factional polymers,2000,46(1):1~27.
2 张彦军,田丰,陈世谦.壳聚糖固定化酶的制备及应用[J],军事医学科学院院刊,2002,26(3):225~227.
3 刘思聪.β-D-半乳糖苷酶壳聚糖固定方法、特性及应用研究[D].陕西:西北农林科技大学,2006.
4 Abdel-Naby M A,Ismail A M S,Ahmed S A,et al.Production and immobilization of alkaline protease from Bacillusmycoides[J].Bioresour Tech.,1998,64(3):205~210.
5 Pifferi PG,Bonora V,Spagna G,et al.Immobilization of catalase on macromolecular supports activated with acid dyes[J].Process Biochem,1993,28(1):29~38.
6 Martino A,Durante M,Pifferi P G,et al.Immobilization of bete-glucosidase from a commercial preparation.Part 1.A comparative study of natural supports[J].Process Biochem,1996,31(3):281~285.
7 陈盛,林曦,余桂春.壳聚糖固定化纤维素酶在填充床式反应器中反应条件的研究[J].福建师范大学学报,1998,14(1):75~79.
8 陈盛,李柱来.壳聚糖固定化脲酶研究[J].中国生物工程杂志,1992,12(5):40~43.
9 朱启忠.壳聚糖固定化半纤维素酶地的研究[J].生物化学与生物物理进展,2000,27(3):274~277.
10 李红,王炜军,徐凤彩.壳聚糖微球固定化木瓜蛋白酶的特性研究[J].华南农业大学学报(自然科学版),2001,22(2):56~58.
11 陈天.壳聚糖固定化胰蛋白酶的研究[J].离子交换与吸附,2002,18(2):125~131.
Study of preparation conditions of food-grade immobilization support-chitosan microsphere
WU Qiao-li1ZHANG Shao-fan3SUN Yang2QIAN Fang1
(1.College of Food Science and Technology,Dalian Polytechnic University,Dalian,Liaoning116034,China;2.Ji Lin Province Light Industry Design and Research Institude,Jilin,Changchun,130012,China;3.College of Information Science and Engineering,Dalian Polytechnic University,Dalian,Liaoning116034,China)
The research studied the optimum preparation condition of chitosan immobilization microspheres support,and provided theoretical foundation for the further its immobilization on lactase.The chitosan microsphere was prepared by condensation/precipitation.The results showed that 2g/m L chitosan(1%ice acid solution)was dropped into concretion solution,which was composed of 20%NaOH and 30%methanol in final concentration,and not stirred when the reaction began.The diameter,the average weight and the specific surface area of every support was 4.00±0.06 mm,30.80±0.02 mg,and 4.08×10-4m2/g under the conditions.Thus the chitosan support is produced,which is uniform in size,integrated in shape,fine in flexibility.
chitosan;microsphere support;immobilization
10.3969/j.issn.1003-5788.2012.01.005
国家农业科技成果转化项目(编号:2011B0002004);辽宁省教育厅项目(编号:L2010053);辽宁省科学技术基金项目(编号:201102110)
吴巧丽(1985-),女,大连工业大学在读硕士研究生。E-mail:qf09@163.com
钱方
2011-10-30

