荔枝核提取物及其阳离子树脂分离物体外降血糖作用
徐 婷吴 青高骏伟
(1.华南农业大学食品学院,广东 广州 510640;2.广东省食品质量安全重点实验室,广东 广州 510640)
荔枝核提取物及其阳离子树脂分离物体外降血糖作用
徐 婷1,2吴 青1,2高骏伟1,2
(1.华南农业大学食品学院,广东 广州 510640;2.广东省食品质量安全重点实验室,广东 广州 510640)
研究荔枝核乙醇提取物(LSE)和其阳离子树脂分离物(FCE)体外降血糖作用。采用高糖和高胰岛素所致的两种HepG2细胞模型,在模型培养中添加不同浓度的LSE与FCE,以葡萄糖试剂盒测定,MTT法等进行对HepG2细胞葡萄糖消耗作用的研究。结果表明:在高糖环境下,LSE和FCE均能促进HepG2细胞的葡萄糖消耗,而FCE的促进作用显著高于相近浓度的LSE,提示离子交换树脂分离物贡献了荔枝核提取物的降糖作用;此外,FCE还可与低剂量胰岛素协同增加细胞的葡萄糖消耗。在胰岛素抵抗模型中,FCE能显著降低胰岛素抵抗,增加细胞的葡萄糖消耗。荔枝核提取物和其阳离子树脂分离物具有体外降血糖作用。
荔枝核;树脂分离;降血糖;HepG2细胞模型;胰岛素抵抗模型
荔枝核是《中国药典》收载的传统中药材,具有行气散结,祛寒止痛之功能,用于寒病腹痛,睾丸肿痛[1]。而现代药理研究[2,3]表明,荔枝核有多种功效,除有抗氧化、抗病毒、抗肿瘤、调血脂等作用外,还具有明显的降血糖功效,报道的降血糖的功效成分有皂苷[4,5]、多 糖[3]、氨基酸[6]等。 但至目前,研究荔枝核降糖作用均采用的是动物模型,采用细胞模型研究还未见报道。本试验用70%乙醇提取荔枝核,获得乙醇提取物,再用732阳离子交换树脂分离获得分离物,探讨它们对高糖和高胰岛素所致两种HepG2细胞模型中葡萄糖消耗作用的影响,以进一步为降糖药物的开发提供依据。
1 材料与方法
1.1 材料与试剂
荔枝核:在市场上购买品种为黑叶的新鲜荔枝,取核,清洗沥干,50℃干燥后粉碎过40目筛,置于4℃保存备用。
HepG2细胞株:中山大学实验动物中心细胞库。
DMEM高糖培养基:美国Gibco公司;
胎牛血清:浙江天杭生物科技有限公司;
4-羟乙基哌嗪乙磺酸(HEPES):广州威佳科技有限公司;
青霉素-链霉素双抗:杭州吉诺生物医药技术有限公司;
四甲基偶氮唑盐(MTT)、胰岛素(Ins)、罗格列酮:美国Sigma公司;
二甲基亚砜、732阳离子交换树脂:上海凌峰化学试剂有限公司;
葡萄糖测定试剂盒:北京普利莱基因技术有限公司。
1.2 仪器
电子天平:EL204-IC,瑞士 Mettler Toledo公司;
超净工作台:SW-CJ-2FD,苏州净化设备有限公司;
CO2培养箱:MDF-192,美国Shellab公司;
倒置显微镜:CFM-500,上海长方光学仪器有限公司;
酶标仪:Versa Max,美国 Molecular Devices公司。
1.3 试验方法
1.3.1 荔枝核乙醇提取物的制备 称取一定量荔枝核粉于三角瓶中,按料液比1∶15(m∶V)加入70%乙醇,室温提取2d。提取液减压抽滤后,真空浓缩至小体积,而后加入3倍体积去离子水溶解,离心,上清液真空浓缩至干,得到荔枝乙醇提取物(litchi seed extract,LSE)。
1.3.2 阳离子交换树脂分离物的制备 用去离子水溶解LSE,上样于装有经活化的732阳离子交换树脂的玻璃柱上(2.55cm×25.6cm),用水洗脱至流出基本无色后,用0.5%氨水洗脱,流速控制在2d/s,用0.2%茚三酮溶液检测洗脱液是否含氨基酸,自反应呈阳性起开始收集洗脱液,至反应呈阴性为止,合并阳性洗脱液,浓缩,真空干燥得荔枝核阳离子树脂分离物(fraction by cation exchange resin,FCE)。
1.3.3 细胞培养 将HepG2细胞接种于75cm2培养瓶中,加入含10%热灭活胎牛血清、100U/mL青霉素-链霉素双抗的DMEM高糖培养液,置于37℃、5%CO2、饱和湿度的CO2培养箱中培养。每隔2d更换1次培养液,3d后传代,传代数1∶4。取对数生长期的细胞进行试验。
1.3.4 LSE和FCE对 HepG2细胞葡萄糖消耗作用及MTT毒性试验 将LSE与FCE配制成高浓度水溶液,微滤膜过滤后,用无血清DMEM培养液稀释至所需浓度待用。
将处于良好生长状态的HepG2细胞,用0.25%胰蛋白酶液消化后,用含10%血清的培养液吹打成单个细胞悬液,并稀释到需要浓度,以1×105个/mL细胞接种于96孔培养板中,置于CO2培养箱中培养,待细胞贴壁后,弃去原培养液,换无血清培养液饥饿12h后,加入含样或不含样的高糖DMEM培养液。将96孔培养板中细胞分为空白对照组、样品组,每个组重复6孔,孵育24h后,用葡萄糖试剂盒(氧化酶法)测定各孔培养液中葡萄糖的浓度,采用式(1)计算葡萄糖的消耗量。

式中:
GC—— 葡萄糖的消耗量,mmol/L;
G0——0h培养液中葡萄糖浓度,mmol/L;
G24——24h培养液中葡萄糖浓度,mmol/L。
同时进行MTT毒性试验,在葡萄糖消耗试验孵育结束将待测培养液移出后,每孔加入150μL无血清培养液,避光加入2mg/mL MTT溶液50μL作用4h,吸弃上清液,每孔加入150μL DMSO,置于平板振荡器上震荡10min,使蓝紫色结晶甲瓒溶解完全后,立即在酶标仪波长490nm处测定吸光值,以此反映细胞存活性与数量。
1.3.5 FCE对 HepG2细胞葡萄糖消耗的作用 按1.3.4处理细胞后,加入无血清含样或不含样的培养液,将细胞分为空白对照组(加和不加胰岛素Ins),样品组(加和不加Ins),罗格列酮阳性对照组(加和不加Ins),其中Ins浓度为10nmol/mL,每个处理重复6孔,于培养箱孵育24h。吸取上清培养液,用葡萄糖试剂盒测定各培养液中葡萄糖的浓度,计算葡萄糖的消耗量。
同时进行MTT毒理试验,方法同1.3.4。
1.3.6 FCE对胰岛素抵抗模型下HepG2细胞的葡萄糖消耗作用 将处于对数生长期的细胞消化后,用含10%血清的DMEM调整细胞密度为1×105,接种于96孔培养板中。待细胞贴壁后,参考Zhang等的方法[7],加入新配制含5×10-7mol/L Ins的培养液,于CO2培养箱中培养24h,并设不含Ins的阴性空白孔。产生抵抗抑制后,培养液换为无血清的含样或不含样的高糖DMEM培养液。将细胞分为模型对照组、样品组、罗格列酮阳性对照组,每个处理重复6孔,于培养箱培养24h后,吸取上清培养液,用葡萄糖试剂盒测定各培养液中葡萄糖的浓度,计算葡萄糖的消耗量。
1.4 统计学分析
数据用SPSS软件进行统计分析,试验结果以±s表示,各组间差异采用Duncan分析。
2 结果与分析
2.1 LSE和FCE对HepG2细胞增殖的影响
MTT毒性试验表明,LSE在所试验的浓度(0.14~2.44mg/mL)范围内,对HepG2细胞的增殖没有显著的影响,仅在0.56mg/mL和1.22mg/mL浓度下,对 HepG2细胞的增殖产生了一定的抑制作用,细胞存活率分别为93.5%和94.3%(见图1)。
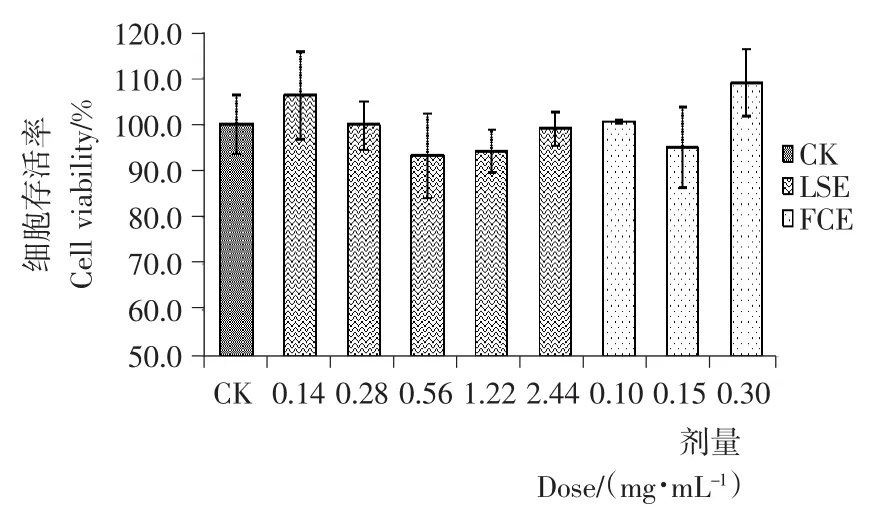
图1 LSE和FCE对HepG2细胞存活率的影响Figure 1 The effect of different concentrates of LSE and FCE on HepG2cell viability
FCE在所试验的3个浓度下,同样对细胞的存活没有明显的影响,仅在0.15mg/mL浓度下,对细胞的增殖产生一定的抑制作用,细胞存活率为95.2%。
2.2 LSE和FCE对HepG2细胞葡萄糖消耗的作用
由表1可知,LSE除在最低浓度0.14mg/mL下没有增加细胞对葡萄糖的消耗作用外,其他4个浓度均表现出促进了细胞对葡萄糖的消耗,与空白对照组相比,处理组的葡萄糖消耗量显著增加(P<0.05),且在剂量为0.28~1.22mg/mL随浓度的增加,呈现葡萄糖消耗量增加的趋势;前面毒性试验显示,在0.56,1.22mg/mL浓度下,LSE对细胞有一定的抑制,扣除细胞增殖抑制对培养液中葡萄糖消耗的影响,用MTT校正后,LSE仍可显著增加单位细胞的葡萄糖消耗量。
而经过732阳离子交换树脂分离得到的氨基酸分离组分FCE则表现出更强的降糖作用,其在0.15mg/mL浓度下的活性远远高于0.14mg/mL LSE的活性,且随浓度的增加,葡萄糖的消耗量增加,这提示氨基酸可能贡献了荔枝核提取物的降糖活性。

表1 LSE和FCE对HepG2细胞葡萄糖消耗的作用ńTable 1 The effect of LSE and FCE on the glucose consumption of HepG2cell
2.3 FCE与胰岛素的协同降糖作用
由表2可知,在所试验的浓度(0.1~0.8mg/mL)范围内,FCE可显著增加 HepG2细胞的葡萄糖消耗量(P<0.05),如在0.4mg/mL时,葡萄糖的摄取率可达126.4%。培养液中加入胰岛素后,FCE能协同胰岛素使HepG2细胞的葡萄糖消耗量增加,同样在0.4mg/mL时,葡萄糖的摄取率达到132.9%。
从表2还可看出,与常用的降糖药物罗格列酮相比较,在含和不含有胰岛素的情况下,0.4mg/mL的FCE使细胞葡萄糖的消耗量比值分别为4.170,4.093nmol/mL,而5μg/mL罗格列酮使细胞葡萄糖的消耗量比值分别为4.052,3.947nmol/mL,说明0.4mg/mL的FCE促使细胞消耗葡萄糖的作用效果高于5μg/mL罗格列酮。
2.4 FCE对胰岛素抵抗模型的HepG2细胞葡萄糖消耗的作用
HepG2细胞中有胰岛素受体,在高浓度胰岛素作用下会产生抵抗[8]。由图2可知,模型对照组的葡萄糖消耗量显著低于阴性对照组(P<0.05),说明经过高胰岛素作用后,细胞对胰岛素敏感性降低,抵抗模型建立成功。
抵抗模型建立后,将FCE加入细胞中孵育,由图2可知,各剂量下的FCE均能促进胰岛素抵抗模型HepG2细胞的葡萄糖消耗,浓度为0.8mg/mL的处理组,细胞葡萄糖的消耗量为模型对照组的143.3%,这提示FCE的降糖活性可能与改善胰岛素抵抗状态有关。
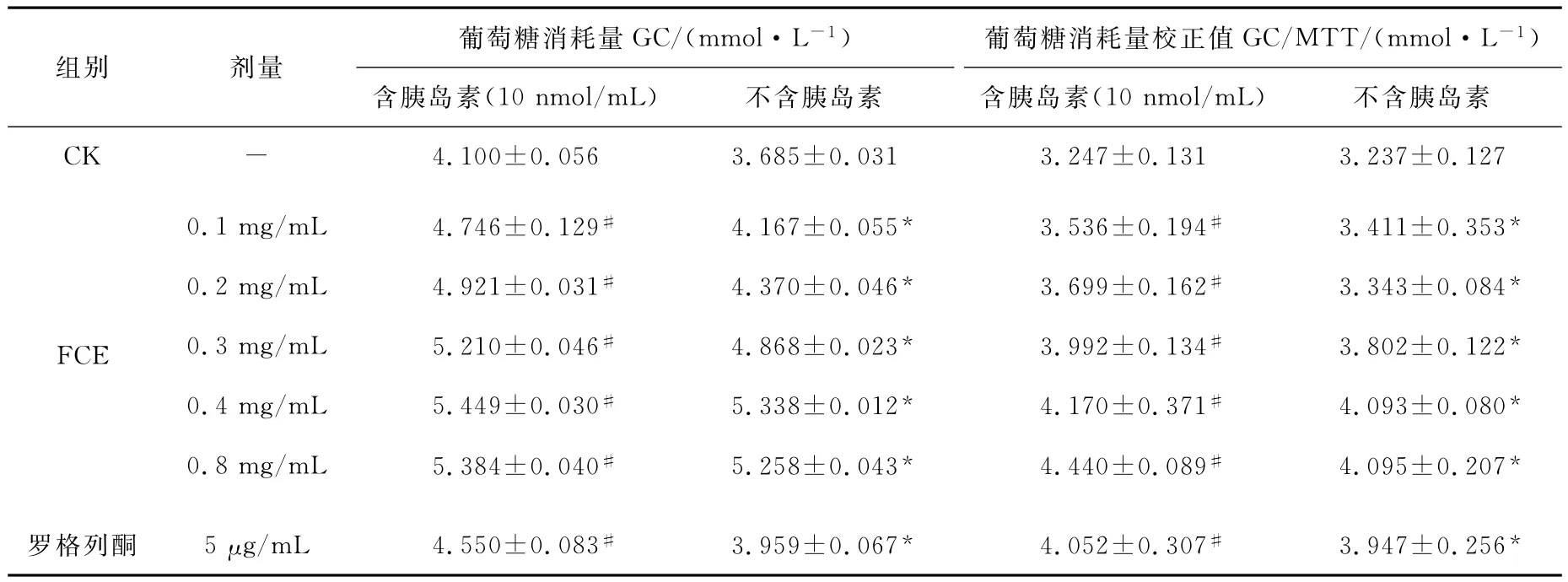
表2 FCE和胰岛素对HepG2细胞葡萄糖消耗的协同作用ńTable 2 The synergy effect of FCE with Insulin on the glucose consumption HepG2cells
3 结论与讨论
II型糖尿病的主要特征包括胰岛素抵抗,肝脏细胞、骨骼肌细胞、脂肪细胞等靶细胞对葡萄糖的摄取减少[9],从而造成血液中葡萄糖水平升高,形成高血糖并常伴有高胰岛素血症。
肝细胞是糖代谢的主要靶细胞之一,HepG2细胞系是人肝癌细胞,具有人类肝细胞的特征,满足典型胰岛素受体所有要求,包括葡萄糖摄取、糖原合成酶的活性、脂类、蛋白质的代谢[10]。因而HepG2是研究高葡萄糖消耗模型和研究胰岛素抵抗的理想模型。
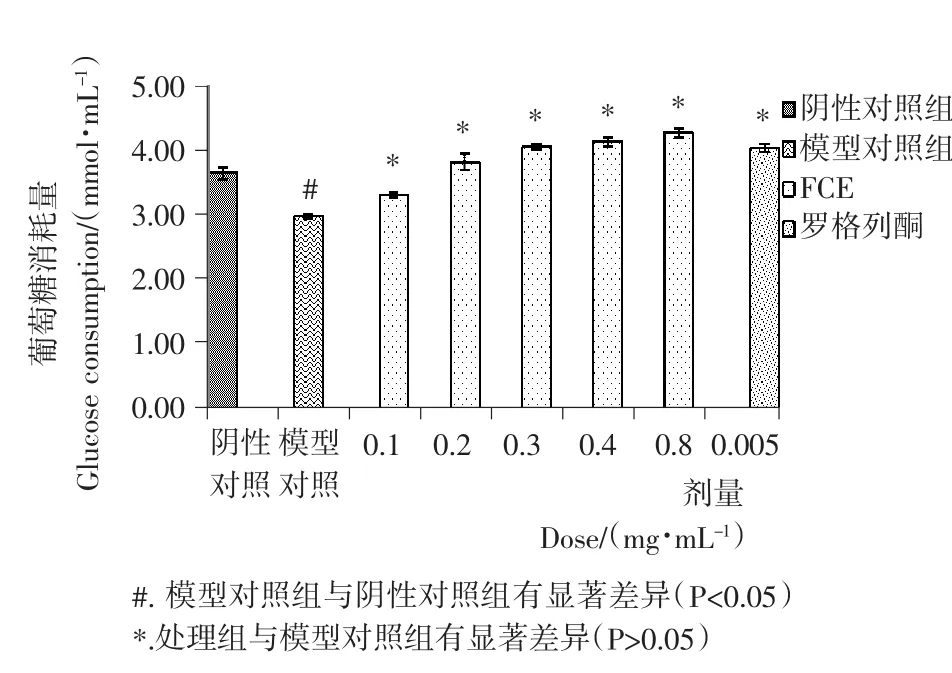
图2 FCE对高胰岛素诱导抵抗模型的HepG2葡萄糖消耗作用Figure 2 The effect of FCE on the glucose consumption of insulin-resistant HepG2cell
本试验表明,荔枝核乙醇提取物LSE能显著促进HepG2细胞对葡萄糖的消耗,具有明显的降糖功效。而经过732阳离子交换树脂分离得到的分离物FCE表现出更强的降糖作用。在高糖模型中,0.4mg/mL用量下的FCE对细胞葡萄糖消耗量比对照组增加了126.4%,同时与低浓度胰岛素有协同降糖作用;且随浓度的增加,葡萄糖的消耗越多,这提示阳离子交换树脂分离物包括氨基酸可能贡献了荔枝核提取物的降糖活性,与文献[6]报道荔枝核具有降血糖的作用源于所含的一种名为α-亚甲基环丙基甘氨酸的结果相符。
在进一步的胰岛素抵抗模型试验中,FCE能显著降低抵抗作用,促进高胰岛素诱发的胰岛素抵抗细胞对葡萄糖的消耗,0.8mg/mL用量下的FCE对葡萄糖的消耗量为模型对照组的143.3%,说明FCE能显著改善HepG2细胞的胰岛素抵抗状态,增加细胞对葡萄糖的摄取与利用。
本试验应用体外细胞模型,揭示了在高糖与高胰岛素环境下,荔枝核提取物和其阳离子树脂分离物能促进肝细胞对葡萄糖的摄取,同时也具有降低细胞对胰岛素的抵抗作用,进一步表明了荔枝核在糖尿病药物开发中具有的开发价值,今后有必要深入开展其降糖活性成分的分离、纯化、鉴定和降糖机理研究。
1 国家药典委员会.中国药典[S].北京:化学工业出版社,2005:169.
2 邓志军,郭洁文,潘竞锵.荔枝和荔枝核及其有效部位的药理及药效学作用[J].药学进展,2009,19(5):7~9,44.
3 袁红.荔枝核多糖提取物对四氧嘧啶致糖尿病小鼠降糖作用[J].健康研究,2010(4):252~255.
4 姜振国,任林,徐多多,等.荔枝核降血糖有效部位的研究(一)[J].长春中医药大学学报,2011,27(1):14~16.
5 郭洁文,廖惠芳,潘竞锵,等.荔枝核皂苷对高脂血症-脂肪肝大鼠的降血糖调血脂作用[J].中国临床药理学与治疗学,2004(12):1 405~1 407.
6 Gray D O,Fowden L.α-(Methylenecyclopropyl)glycine from litchi seeds[J].Biochem.J.,1962(82):385~389.
7 Zhang H J,Ji B P,Chen G,et al.A combination of grape seedderived procyanidins and gypenosides alleviates insulin resistance in mice and hepG2Cells[J].Journal of Food Science,2009,74(1):H1~H7.
8 李长贵,宁光,陈家伦.胰岛素抵抗HepG2细胞模型的建立及鉴定[J].中国糖尿病杂志,1999,7(4):198~200.
9 Sharma A,Kharb S,Chugh S N,et al.Evaluation of oxidative stress before and after control of glycemia and after vitamin E supplementation in diabetic patients[J].Metabolism Clinical and Experimental,2000,49(2):160~162.
10 张召锋,李勇.糖尿病细胞模型的研究进展[C]//北京市营养学会第四届会员代表大会暨膳食与健康研讨会论文集.北京:中国环境诱变剂学会,2010:174~179.
Hypoglycemic effectinvitroof litchi seed extract and its fraction by cation exchange resin
XU Ting1,2WU Qing1,2GAO Jun-wei1,2
(1.College of Food Science of South China Agricultural University,Guangdong,Guangzhou510640,China;2.The Key Laboratory of Food Quality and Safety of Guangdong Province,Guangdong,Guangzhou510640,China)
The hypoglycemic effects of the litchi seed extract(LSE)and fraction by cation exchange resin(FCE)were investigated.LSE or FCE with different concentration was cultured with high glucose HepG2cell model and insulin-resistant HepG2cell modelin vitro,using the method of MTT and glucose assay kit to investigate the hypoglycemic effects.The results showed that on high glucose HepG2 cell model,LSE and FCE increased the glucose consumption of HepG2cells,and FCE had higher effect compared with LSE at similar content.This revealed that fraction by cation exchange resin of litchi seed extract were attributed to the hypoglycemic effect.FCE also enhanced the glucose consumption in synergism with insulin.On insulin-resistant HepG2cell model,FCE significantly reduced the insulin resistance,increasing the glucose consumption of HepG2cells.These results suggested that LSE and FCE exhibited the hypoglycemic effectin vitro.
litchi seed;resin separation;hypoglycemic;HepG2cell model;insulin-resistant cell model
10.3969 /j.issn.1003-5788.2012.04.031
徐婷(1988-),女,华南农业大学在读硕士研究生。E-mail:angelinetsui@yahoo.cn
吴青
2012-02-20

