萘对海洋三角褐指藻生长的毒性效应及生化指标研究
李艳梅,曾文炉,余 强,周启星 (南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071)
萘对海洋三角褐指藻生长的毒性效应及生化指标研究
李艳梅,曾文炉,余 强,周启星*(南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071)
选择在海洋中分布广泛的浮游植物海洋硅藻门的三角褐指藻(Phaeodactylum tricomutum) 作为目标生物,研究了不同萘浓度水平对海洋微藻的生态毒性效应,并同步监测了萘的真实浓度.结果表明,在0~168h内,与对照相比,低浓度萘(初始浓度为0.048~2mg/L)处理组藻的吸光度以及叶黄素、胡萝卜素含量无明显差异.但当萘处理初始浓度达到8mg/L甚至更大时,吸光度、叶黄素和胡萝卜素含量随萘浓度增加而迅速下降,呈现一定的浓度-效应关系.随萘浓度的升高,各处理组中藻类体内超氧化物歧化酶(SOD)活性呈现先升高后下降的“钟形曲线”趋势,而藻类脂质过氧化产物丙二醛(MDA)的含量则呈现先略降低而后急剧上升的趋势.
水体污染;海洋三角褐指藻;萘;毒性效应
近年来,世界范围内的海上溢油事故频发,给海洋生态系统造成了严重的破坏.萘是石油多环芳烃最主要的成分之一[1].在原油中,相对于其他高分子量的多环芳烃(含 3~6个环),萘的浓度更高.因此,萘成为溢油对海洋生态风险评估的特征污染物之一[2].
作为海洋生态系统中的最主要初级生产者,海洋微藻是许多海洋生物活性物质的最初来源,是海洋生物资源的重要组成部分.它们的盛衰直接或间接地影响着整个海洋生态系统的生产力[3].研究表明[4],海洋微藻对溢油的生态毒害反应灵敏,且呈现种类差异性.低浓度溢油的长期作用,将导致包括微藻在内的浮游生物种群结构发生变化[5].
海洋硅藻是近海海洋浮游植物的主要类群,其数量和种类均可占 90%以上,是近海初级生产力的主要贡献者[6].海洋三角褐指藻属硅藻门,对盐度和温度都具有极强的适应性,易于培养.因此,选取海洋三角褐指藻作为目标生物,研究萘对三角褐指藻的毒性效应,探讨萘对其叶绿素含量、超氧化物歧化酶(SOD)和丙二醛(MDA)含量等生化指标的影响,并同步测定了外源萘在海水中的浓度变化趋势,旨在探索检测海洋生态系统溢油污染的生态指标,并为揭示该类化合物对海洋三角褐指藻的毒性机制提供科学依据.
1 材料和方法
1.1 藻种培养条件
实验所用海洋三角褐指藻(Phaeodactylum tricornutum)购自于青岛中国海洋大学.实验前,接种3~4次使细胞达到同步培养.
藻种于 SPX-300I-C型人工气候箱中培养,培养温度为(24±1)℃,光照强度为 4000lx,光暗比为12h:12h.培养液选用f/2营养盐配方[7],实验海水取自渤海口(盐度为32.0±0.1,pH值为7.6±0.2),经 0.45µm 滤膜抽滤煮沸消毒,冷却后配制培养液,每天定时人工摇动3次.
1.2 试剂与仪器
萘(纯度≥99.8%)购自北京百灵威化学技术有限公司.配制40g/L的萘的二甲基亚砜(DMSO) (色谱纯)储备液,封口膜密封,每一个月重新配制一次.试验工作溶液均是当天配制.
Waters高效液相色谱仪(HPLC):(Waters 1525 Binary HPLC Pump,Waters 717 plus Auto sampler,Waters 2487 UV Detector)、SPX-300I-C型人工气候箱(上海博迅实业有限公司医疗设备厂)、TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)、Universal 32R高速冷冻离心机(德国)、SHB-IIIS循环水式多用真空泵(郑州长城科工贸有限公司).
1.3 试验设计和方法
以DMSO作为助溶剂,试验处理组分别为含0.048,0.096,2,8,16,32,64mg/L萘浓度的 f/2培养液, 以不添加萘的 f/2培养液作为对照 (预实验结果表明,DMSO对藻类的生长影响不大,无显著性差异(P<0.01),结果与以往研究结果[8]类似).同时,预实验结果表明完全封闭的环境不利于藻类的呼吸作用,本试验中综合考虑到藻类呼吸作用和萘的挥发,采用硅胶塞塞住三角瓶口,并用封口膜封住,外层再覆一层保鲜膜[9].
培养液体积均为150mL,置于光照培养箱中进行一次性培养,按1:4的比例接种.每个萘浓度组设置 3个平行,分别在 0,24,48,72,96,120,144, 168h进行取样测定相关生理生化指标.
1.3.1 海洋三角褐指藻光密度测定 采用TU-1901双光束紫外可见分光光度计,在683nm处测定光密度 OD683nm,建立海洋三角褐指藻细胞密度Y和光密度X之间的线性关系(Y=-43.5+ 1058.6X,r2=0.9932).以式(1)[10]藻细胞生长抑制率计算萘对海洋三角褐指藻的毒性效应.
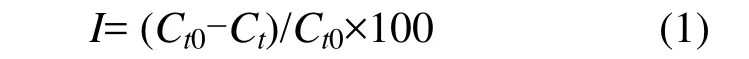
式中: Ct0表示 t时刻空白培养液藻细胞光密度; Ct表示t时刻含萘培养液中藻细胞的光密度.
1.3.2 叶绿素的提取与含量的测定 用分光光度法测定藻色素含量[11].每隔24h取20mL藻液,使用孔径为 0.45µm的醋酸纤维滤膜(Ø50cm)抽滤,将滤膜放入10mL具塞离心管中,加入分析纯95%乙醇 10mL,盖上塞子,于 78℃水浴中加热5min并摇动数次,冷却后室温置于黑暗条件下静置24h,取出后以4000 r/min离心15min,上清液倒入 1cm玻璃比色皿,以 95%乙醇作参比,在470nm、649nm和664nm波长下测定吸光度,根据式(2)~式(4)[12]计算出叶黄素和胡萝卜素含量.

1.3.3 酶活测定 提取粗酶液:取50mL藻液放入离心管(50mL)中,4000r/min离心20min,弃上清液,用预冷的 0.05mol/L(pH7.0)磷酸缓冲液淋洗藻沉淀并转入预冷的研钵中,加入少量石英砂冰浴研磨.接着用 0.05mol/L(pH7.0)磷酸缓冲液,将匀浆液冲洗入 10mL离心管中,并定容至 5mL. 8000r/min离心 20min,上清液即为所需粗酶液,置于-80℃冰箱中保存待测.
超氧化物岐化酶(SOD)[13]测定:采用氮蓝四唑(NBT)光化学还原反应法,反应总体积为 5mL,其中 5×10-3mol/L 磷酸缓冲溶液(pH 7.8), 75×10-6mol/L氮蓝四唑,13×10-3mol/L蛋氨酸, 2×10-6mol/L核黄素,1×10-6mol/L Na2EDTA;藻细胞酶提取液0.2ml,4000lx日光下反应20min后于560nm测定其吸光度.SOD计算如式(5).
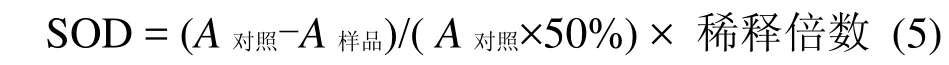
丙二醛(MDA)[14]含量的测定:1.5mL酶液中加入0.5%硫代巴比妥酸(TBA)溶液3mL,振荡混合后于 100℃沸水浴上反应 30min,迅速冷却后4000r/min离心 10min,上清液分别于 450,532, 600nm 波长下测定 OD 值.对照以 1.5mL 0.05mol/L pH 7.8的磷酸缓冲液代替酶液.MDA数量以umol/细胞数量表示.
MDA(μmol/L)=6.45×(OD532-OD600)-0.56×OD450
1.4 萘浓度的测定
取5mL藻液,过0.45µm孔径的醋酸纤维滤膜,滤液用 Waters高效液相色谱仪.色谱柱为Inertsil ODS-3 5µm×2.1mm×250mm,进样量为20µL,柱温 40℃,流速为 0.4mL/min,流动相为乙腈:水=65:35(V:V),检测波长 254nm,保留时间为6.856min.空白海水进样测定萘浓度,结果表明采取的海水中萘浓度低于检测限0.01×10-6.
1.5 数据处理与统计
利用 SPSS 18.0进行数据统计分析,包括平均值、标准差以及单因素方差分析(LSD比较),统计性显著性假设为P<0.05.
2 结果与讨论
2.1 萘对海洋三角褐指藻生长的影响及EC50
由图1可见,与对照组相比,各萘浓度试验组中藻细胞的生长均受到不同程度的抑制.在低浓度萘(初始浓度为 0.048,0.096,2mg/L)暴露下,海洋三角褐指藻的吸光度变化趋势与对照组相近,受抑制作用不明显.但当萘浓度达到8mg/L时,藻细胞受抑制程度随着萘浓度的升高而增大.
由图1数据计算得到不同浓度萘对海洋三角褐指藻的生长抑制率.结果表明,随着萘浓度的增大,萘对海洋三角褐指藻的抑制率也不断增大,抑制作用达90%以上的初始萘浓度为64mg/L.低浓度(初始浓度为0.048,0.096,2mg/L)萘暴露下,其最大抑制率仅为 17.19%,当萘初始浓度分别为8,16,32mg/L时,其最大抑制率达到 37.66%、55.40%和70.35%.同时,基本上所有浓度组抑制作用都在 48h时达到最大,然而随着时间的继续延长,抑制作用逐渐变小.这一方面可能与萘本身的强挥发性有关,另一方面也与藻类自身的恢复作用有关[9].萘的急性毒性效应在 48h时最为明显.初始萘浓度64mg/L组除外,其抑制作用并没有随着时间的延长而减弱,可能是因为高浓度萘已经对海洋三角褐指藻造成了不可恢复的损伤作用.
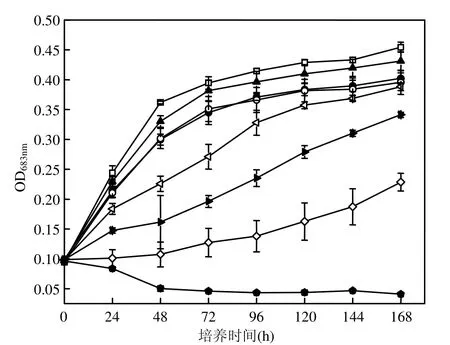
图1 不同浓度萘对海洋海洋三角褐指藻吸光度的影响Fig.1 Effects of various concentration of Naphthalene on the absorbance of Phaeodactylum tricomutum
经概率单位-浓度对数法计算各时间点萘对海洋三角褐指藻的半数有效量即EC50,如图2所示,在24h时萘的EC50值最大,达到19.1849mg/L.原因可能是萘此时还没有与海洋三角褐指藻充分接触,毒性作用还不显著.而在 48h时,萘的EC50值仅为0.9463mg/L,主要是因为萘自身的强挥发性以及萘对海洋三角褐指藻的急性毒性作用已经得到体现.这说明虽然萘自身的强挥发性会导致处理组中萘浓度不断减少,但是监测短期(约48h)内高强度萘暴露下对海洋三角褐指藻在168h时的中长期毒性影响是非常有现实意义的.同时在 48h以后的各个时间点监测值总体呈减小趋势,但值略有波动,说明在1周的慢性毒性作用过程中,虽然萘浓度由于强挥发性而不断降低,但萘对海洋三角褐指藻的慢性毒性效应却越来越显著,并且在 168h EC50值最低,仅为0.2669mg/L,波动的原因可能是随着时间的延长海洋三角褐指藻对萘渐渐产生了弱耐药性.
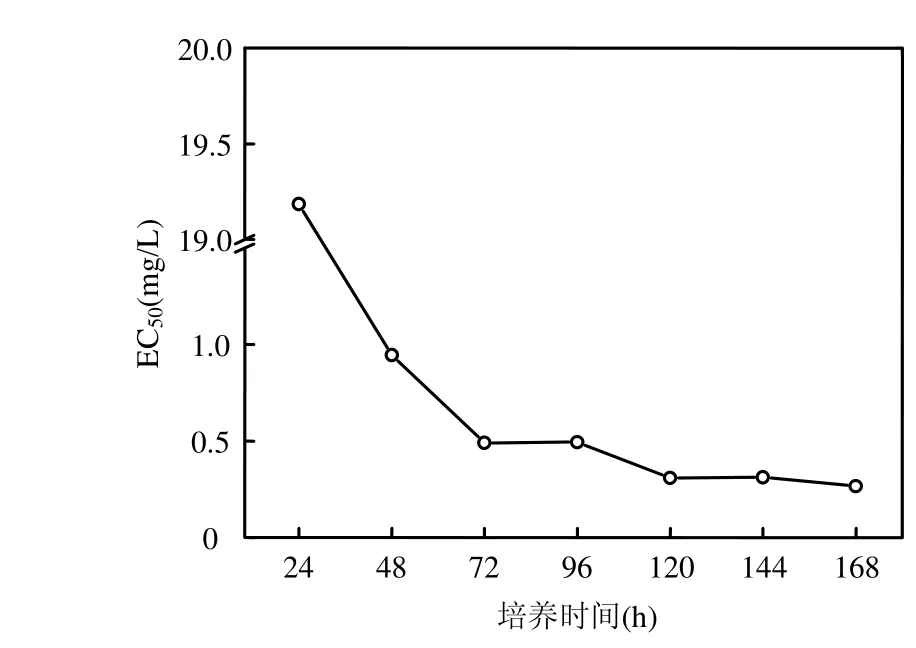
图2 萘的EC50变化趋势Fig.2 The variation trend of EC50 of Naphthalene
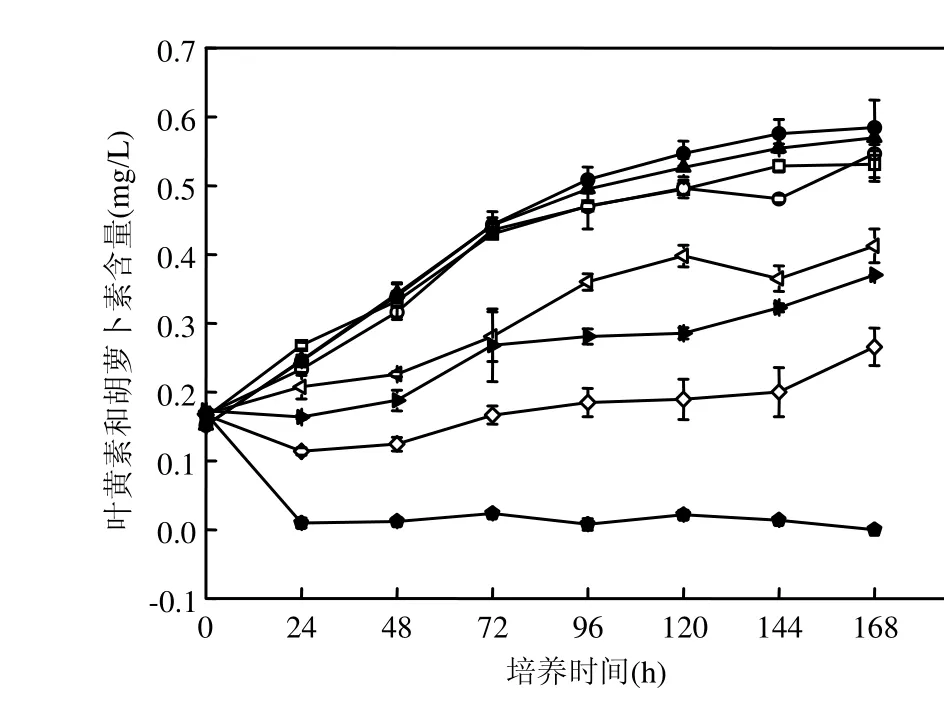
图3 萘对海洋三角褐指藻叶黄素和胡萝卜素含量的影响Fig.3 Effects of Naphthalene on xanthophyll and carotene content of Phaeodactylum tricomutum
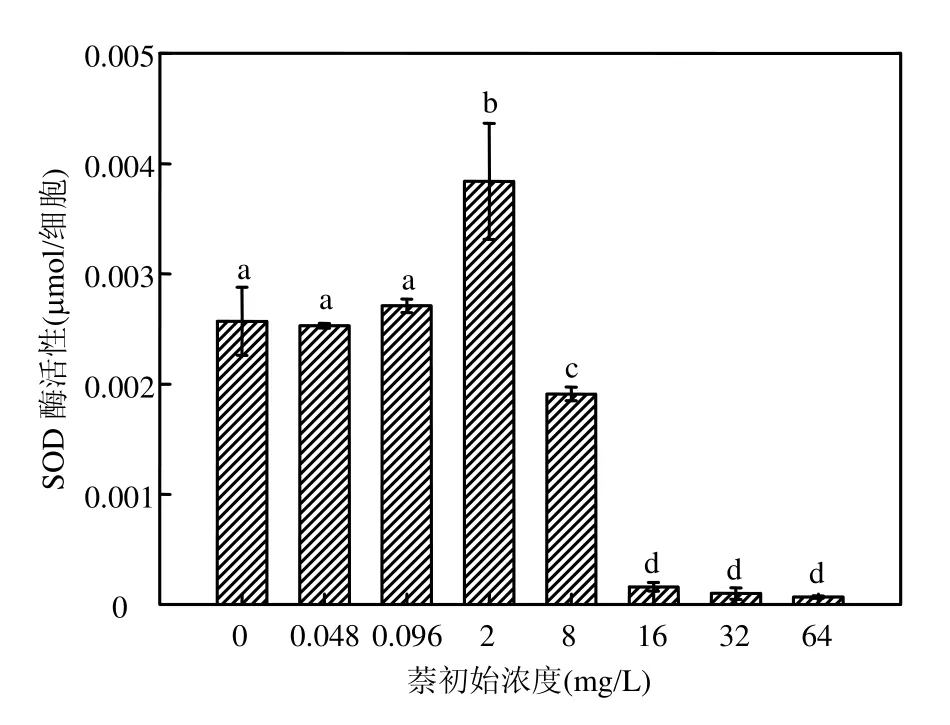
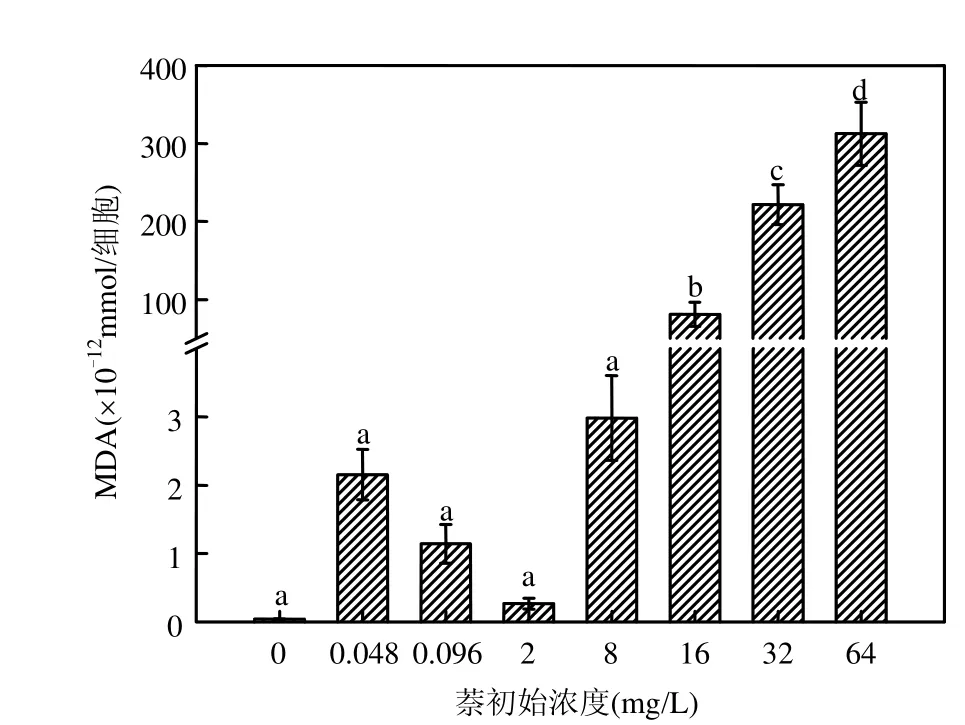
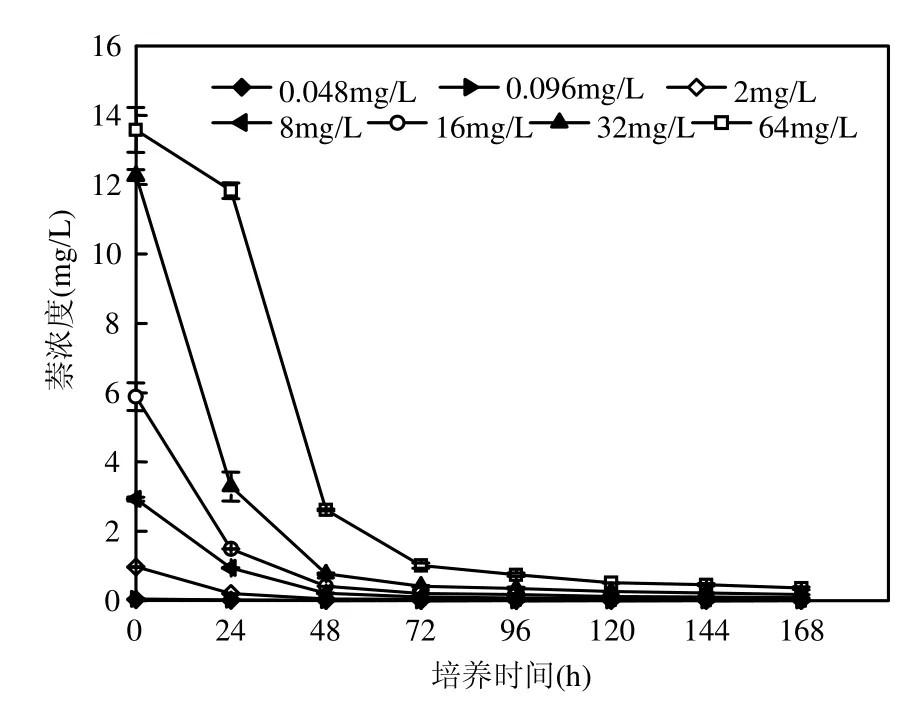
本实验中,在萘暴露下,海洋微藻海洋三角褐指藻表现出较为明显的浓度-效应相关性.当毒物浓度较低时( 由图3可见, 萘浓度小于2mg/L时,叶黄素和胡萝卜素含量与对照组相比无显著性差异,尤其是萘初始浓度为0.048, 0.096mg/L时,虽然这2个浓度组对海洋三角褐指藻生物量有抑制效应,是对叶黄素和胡萝卜素产生轻度的刺激作用.当萘初始浓度达到8mg/L甚至更高时,海洋三角褐指藻的叶黄素和胡萝卜素含量随着萘浓度的增大而下降,当萘初始浓度为 64mg/L时,其含量在与萘接触的 24h后即为0,海洋三角褐指藻的光合作用色素此时已遭到彻底破坏. 由图 4可知,在 168h时,初始萘浓度分别为0,0.048,0.096mg/L时,海洋三角褐指藻SOD活性并没有显著差异(P<0.05);萘初始浓度为2mg/L时,海洋三角褐指藻168h的SOD活性最强,并与其他处理组差异明显(P<0.05),萘浓度为8mg/L时,SOD活性急剧下降,而当萘初始浓度达到 16, 32,64mg/L时, 168h-SOD活性降至接近0,且浓度间没有显著差异(P<0.05).可见,168h的SOD活性呈现出低萘初始浓度上升,高萘初始浓度时下降的趋势. 图4 168h时在萘暴露下海洋三角褐指藻SOD的活性Fig. 4 Effects of Naphthalene on SOD activity of Phaeodactylum tricomutum at 168h 丙二醛(MDA)含量的高低可以反映细胞膜脂过氧化的程度.如图 5所示,在萘胁迫下,在0~8mg/L浓度范围时,MDA含量变化不明显,且各处理组海洋三角褐指藻 MDA含量并没有显著差异(P<0.05);而当萘初始浓度达到 16,32, 64mg/L时,海洋三角褐指藻的168h的MDA含量急剧增加,且各处理组间差异显著(P<0.05),说明随着萘初始浓度的不断增加,其对海洋三角褐指藻的膜脂过氧化造成了不同程度的加剧,并导致细胞受到不同程度的损害. 图5 168h时在萘暴露下海洋三角褐指藻MDA的含量Fig.5 Effects of Naphthalene on MDA content of Phaeodactylum tricomutum at 168h不同字母表示差异显著 近几年来,植物体内有效清除活性氧的保护机制得到了广泛深入的研究,而其中 SOD、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH)等作为植物体内清除活性氧、保护植物细胞免受伤害的保护性酶更是研究的重点[16-19].研究结果表明,植物体内在受到轻度的环境胁迫时,SOD活性会有所升高,以增强其对活性氧的清除能力;但是这些酶的含量和活性都在一定的毒物范围内升高,当细胞受到重度逆境胁迫时它们的含量活性又会急剧下降,造成活性氧的积累和细胞的伤害[20].在本实验中,对于SOD的研究也有类似的实验结果.在萘的低浓度组(0.048~2mg/L)中, SOD活性受到明显诱导,并随着毒物浓度增大而升高,此时MDA作为膜脂过氧化物相应地有所降低;随着毒物浓度的继续增加,SOD受胁迫导致其合成或结构受破坏而引起活力下降,藻清除活性氧的能力亦下降,膜脂过氧化进一步加剧,超过了细胞的耐受极限时,膜脂过氧化带来的损伤大于细胞自身的修复能力,SOD活性显著下降并渐渐失活,自由基产生和消除之间的平衡被破坏,细胞开始受到毒害,海洋三角褐指藻生长也明显受到抑制.SOD呈现低浓度诱导,高浓度抑制现象,即表现为“钟形曲线”.这种现象在其他毒物的藻类实验中也有类似的结果[21-23]. 暴露在毒物下的生物体,一旦受到毒物胁迫,便自发的开始对这些毒物展开解毒过程[24].其细胞内外均会发生一系列的生理生化反应,原有的平衡被打破,新的平衡开始逐渐建立.这其中细胞内自由基含量以及MDA、SOD等含量的变化各有其特点和趋势,在研究中找出其中的联系对于揭示该类化合物对藻的毒性机制有重要作用. 图6 萘浓度随时间的变化Fig.6 The changes of concentration of naphthalene with time with initial concentration of naphthalene at 0.048, 0.096, 2, 8,16,32,64mg/L, respectively 由图6可见,萘的损失主要是由于自身的强挥发性,在 168h后,所有浓度组中萘的浓度均低于 0.5mg/L,即使是最大的萘浓度组,其浓度也只有0.3568mg/L.同时,在120h后0.048,0.096mg/L这 2个浓度组中的萘均已挥发至 0.并且,以DMSO作为助溶剂的萘在海水培养基中的溶解度依然很低,这7个浓度组的萘初始真实浓度由低到高分别仅有 0.0292,0.0431,0.9680,2.9281, 5.8809,12.2743,13.5793mg/L. 3.1 随着萘浓度的增大,其对海洋三角褐指藻生长的抑制较为明显,该效应表现出一定的浓度和时间相关性.在0~168h内,低浓度组萘(初始浓度为 0~2mg/L)中叶黄素和胡萝卜素含量与对照组相比无明显差异.但当污染物初始浓度达到8mg/L甚至更大时,叶黄素和胡萝卜素含量随毒物浓度增加而迅速下降,呈现一定的浓度-效应关系.SOD活性变化随毒物浓度升高,呈现先升高后下降的“钟形曲线”.MDA的含量随毒物浓度先略下降而后急剧上升. 3.2 在 0~168h内,萘浓度的损失主要是由于自身极强的挥发性.120h时,初始浓度为0.048mg/L和0.096mg/L 2个浓度组中萘浓度均挥发至0,且在 168h后,所有浓度组中萘的浓度均低于0.5mg/L.同时,以DMSO作为助溶剂的萘在海水培养基中的溶解度依然很低,最高浓度组萘的监测值也仅有13.5793mg/L. [1] Karacik B, Okay O S, Henkelmann B, et al. Polycyclic aromatic hydrocarbons and effects on marine organisms in the Istanbul Strait [J]. Environment International, 2009,35:599-6064. [2] Muddassir N, Faisal K, Paul A, et al. Subsea release of oil from a riser: an ecological risk assessment [J]. Risk Analysis, 2008, 28:1173-1196. [3] 高亚辉.海洋微藻分类生态及生物活性物质研究 [J]. 厦门大学学报(自然科学版), 2001,40(2):566-573. [4] Bate G C, Crafford S D. Inhibition of phytoplankton photosynthesis by the WSF of used lubricating oil [J]. Marine Pollution Bulletin, 1985,16(10):401-404. [5] 李卓娜,孟范平,赵顺顺,等. BDE-47 对2种海洋微藻光合特性的影响 [J]. 中国环境科学, 2010,30(2):233-238. [6] 李 燕,高亚辉,李雪松,等.海洋硅藻附着研究进展 [J]. 生命科学, 2008,5(20):768-772. [7] Guillard R, Ryther J H. Studies of marine planktonic diatoms. I. Cyclotellanana Hustedt and Detonuaconfervacea(Cleve) Gran [J]. Canadian Journal of Microbiology, 1962,8:229-239. [8] Djomo J E, Dauta A, Ferrier V, et al. Toxic effects of some major polyaromatic hydrocarbons found in crude oil and aquatic sediments on Scenedesmus subspicatus [J]. Water Reasearch, 2004,38:1817-1821. [9] Kong Q, Zhu L, Shen X. The toxicity of naphthalene to marine Chlorella vulgaris under different nutrient conditions [J]. Journal of Hazardous Materials, 2010,178:282–286. [10] Debenest T, Pinelli E, Coste M, et al. Sensitivity of freshwater periphytic diatoms to agricultural herbicides [J]. Aquatic Toxicology, 2009,93:11-17. [11] Sartory D P, Grobbelaar J U. Extraction of chlororphyll a from freshwater phytoplankton for spectrophtometric analysis [J]. Hydrobiologia, 1984,114:177-187. [12] Wiley J Sons. Chlorophylls and carotenoids: measurement and characterization by UV-VIS specroscopy [J]. Current Protocols in Food Analytical Chemistry, 2001: F4.3.1-F4.3.8. [13] 叶宝兴,朱新产.生物科学基础实验 [M]. 北京:高等教育出版社, 2007:439-442. [14] 郝再彬,苍 晶,徐 仲.植物生理实验 [M]. 哈尔滨: 哈尔滨工业大学出版社, 2004. [15] Wang Y, Tang X, Li Y, et al. Stimulation effect of anthrancene on marine microalage growth [J]. Chinese Journal of Applied Ecology, 2002, 13(3):343-346. [16] Gupta M, Sinha S, Chandra P. Copper-induced toxicity in aquatic macrophyte, Hydrilla verticillata: effect of Ph [J]. Ecotoxicology, 1996,5,23-33. [17] Menone M L, Pesce S F. Endosulfan induces oxidative stress and changes on detoxication enzymes in the aquatic macrophyte Myriophyllum quitense [J]. Phytochemistry, 2008,69: 1150-1157. [18] Sinha S, Gupta M. Oxidative stress induced by iron in Hydrilla verticillata(i.f.) role: response of antioxidants [J]. Ecotoxicology and Environmental Safety, 1997,38:286-291. [19] Gupta M, Tripathi R D. Role of glutathione and phytochemlatin in Hydrilla verticillata (i.f.) royle and vallisneria spiralis L under mercury stress [J]. Chemosphere, 1998,37:785-800. [20] 唐学玺,李永祺.久效磷对海洋微藻毒性机理的初步研究 [J].环境科学学报, 1998,18(2):204-207. [21] 聂湘平,鹿金雁,李 潇,等. 蛋白核小球藻对叔丁基对羟基茴香醚的毒性响应 [J]. 暨南大学学报, 2007,28(5):513-517. [22] 殷培杰,李培军,刘 宛.氯苯甲酸植物毒性实验中抗氧化酶变化的量化研究 [J]. 环境科学研究, 2005,15(5):21-25. [23] 吴石金,俞 翔,吴尔苗,等.二氯甲烷和二氯乙烷对蛋白核小球藻的毒性影响研究 [J]. 环境科学, 2010,31(6):1655-1661. [24] 周启星,孔繁祥,朱 琳.生态毒理学 [M]. 北京:科学出版社, 2004. Toxic effects of naphthalene on the growth of Phaeodactylum tricomutum and relevant biochemical indexes. LI Yan-mei, ZENG Wen-lu, YU Qiang, ZHOU Qi-xing*(Key Laboratory of Pollution Processes and Environmental Criteria, Ministry of Education, Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China). China Environmental Science, 2012,32(1):150~155 Phaeodactylum tricomutum was selected as target organism to study the toxicity of naphthalene under various concentration. From 0h to 168h, the optical absorbance, xanthophyll and carotene content had no obvious difference with blank control in low-concentration groups of naphthalene (0.048~2mg/L). However, when the concentration of naphthalene reached 8mg/L or more, dramatically decreases of the optical absorbance, xanthophyll and carotene content were gained. Activities of superoxide dismutase(SOD) increased at first and then decreased remarkably with the increasing concentration of naphthalene, showed as “Bell Shaped Curve”. And the content of malondialdehyde(MDA) decreased slightly and then flared up and lipid peroxidant aggregated with the increasing concentration of naphthalene. water pollution;marine Phaeodactylum tricomutum;naphthalene;toxic effect 2011-03-23 国家自然科学基金资助项目(21077059,40930739);国家海洋局海洋溢油鉴别与损害评估技术重点实验室2010年度开放基金项目(201008) * 责任作者, 教授, zhouqx523@yahoo.com X171.5 A 1000-6923(2012)01-0150-06 李艳梅(1987-)女,南开大学环境科学与工程学院硕士研究生,主要研究方向为生态毒理.发表论文4篇.2.2 萘对海洋三角褐指藻光合作用色素的影响
2.3 对SOD活性的影响和MDA含量的变化
2.4 萘浓度的同步变化
3 结论

