近红外光谱技术在激光热疗荷瘤大鼠中的实时监测研究
王猛,游洋,杨天明,钱志余,包美芳
(1.东南大学附属中大医院神经外科,江苏南京 210009;2.南京航空航天大学生物医学工程系,江苏南京 210016)
胶质瘤是神经系统最常见的恶性肿瘤,广义胶质瘤是指所有神经上皮来源的肿瘤,而组织病理学上则狭义地指来源于各类胶质细胞的肿瘤。虽然临床上胶质瘤的治疗有手术、化疗、放疗、基因、免疫、光动力、热疗、中医药等多种手段[1],但其总体预后仍不容乐观。肿瘤激光间质热疗(laser interstitial thermotherapy,LITT)是将激光通过光纤导入到肿瘤组织内部并从加入头表面发出,肿瘤组织吸收激光能量而被加热,由于过热和凝结效应而坏死[2]。世界范围内有少数医疗中心已经将LITT作为脑肿瘤治疗方法之一应用于临床[3-6]。本研究将近红外光谱(NIRS)技术应用于LITT大鼠胶质瘤并行术中实时监测,通过分析NIRS光学参数,尤其是优化散射系数(μ's)的变化情况,对胶质瘤的LITT治疗进行评估。
1 材料与方法
1.1 实验仪器
德国LIMO公司半导体激光器电源及CA系列高功率半导体激光器、fNIRS监测系统[7]、7.0 T小动物MRI、自动步进系统、计算机及相关软件。
1.2 细胞和动物
SD健康大鼠100只,体重180~220 g,雌雄不限(购自南京青龙山实验动物中心)。大鼠C6胶质瘤细胞株。
1.3 实验方法
1.3.1 细胞培养 将C6细胞分装于底面积为50 cm2的培养瓶中,加入含有体积分数为10%胎牛血清DMEM/F12培养液,置于温度为37℃、CO2体积分数为5%的恒温恒湿培养箱中,单层培养法传代培养生长至所需的细胞数。在细胞对数生长期大约满90%时,以0.25%胰酶消化,收集消化液,离心后去除上清液,DMEM/F12培养液洗2次后制成细胞悬液,调节细胞浓度[1×107(10μl)-1~1×108(10μl)-1],置于34℃恒温摇床待接种。苔盼蓝排斥实验检测细胞活力>95%。
1.3.2 肿瘤接种 SD大鼠腹腔注射2%戊巴比妥(45 mg·kg-1)进行麻醉。麻醉后将大鼠固定于小动物实验台上,0.5%碘伏左前腋下局部消毒,25μl微量进样针将20μl细胞悬液穿刺成功后缓慢注入血供丰富的左前腋区皮下间隙,注射完毕后无菌敷料覆盖。
1.3.3 MRI成像 术后1~2周行7.0 T磁场强度MRI扫描,观察肿瘤生长情况。
1.3.4 近红外光学参数μ's的测定 将建模成功后的胶质瘤大鼠随机分为非 LITT 30、60、90、120 s,0.77 W(8.3 A)30、60、90、120 s,1.23 W(8.8 A)30、60、90、120 s,1.88 W(9.5 A)30、60、90、120 s,2.35 W(10 A)30、60、90、120 s组,共20 组,每组 5 只。荷瘤大鼠腹腔注射2%戊巴比妥钠(45 mg·kg-1)麻醉,常规消毒后切开皮肤约1.0 cm,剥离皮下组织,分离出胶质瘤并切开0.5 cm,将固定于步定进机的激光光纤探头与近红外探头一同缓慢步进入肿瘤,开启近红外光源,根据分组情况予以808 nm LITT(非LITT组不予只记录相应时间内的μ's值),记录肿瘤在LITT前及过程中μ's的变化,测量结束后缓慢退出激光光纤探头与近红外探头,常规消毒缝合伤口,整个过程在超净工作台内进行,术后予以抗生素防治感染,次日对手术大鼠再次行7.0 T磁场强度的小动物专用MRI扫描。MRI扫描后断头处死大鼠,取肿瘤固定于4%多聚甲醛溶液3 d,石蜡包埋,HE常规染色。
1.4 统计学处理
实验数据用±s表示,所得数据采用SPSS17.0及Excel软件进行分析,行单因素或两因素多样本均数比较的方差分析,当P<0.05时认为差异有统计学意义。
2 结 果
2.1 建模后大鼠临床表现
大鼠左上肢皮下可见一逐渐增大类圆形肿物,质硬,活动度好;大鼠左上肢活动轻微受限,进水进食无明显异常,二便无明显异常,体重未见明显减轻,行为无明显异常。
2.2 术前MRI及病理检查结果
经7.0 T磁场强度的小动物专用MRI扫描,T2像可见大鼠左上腋皮下一直径约1.5 cm类圆形高信号影(图1a)。取胶质瘤组织进行HE染色,可见胶质瘤细胞轻度蓝染,细胞核清晰,细胞排列紊乱(图1b)。
2.3 LITT过程中μ's的测定结果
2.3.1 非LITT组μ's的变化 该组内荷瘤大鼠的μ's在操作过程中保持平稳,无明显波动变化。
2.3.2 0.77、1.23、1.88、2.35 W μ's组 μ's的变化LITT前μ's保持平稳,为记录其平稳值,LITT开始后μ's首先出现瞬间小幅下降,预置程序剔除808 nm激光干扰,然后平缓地上升,热疗结束时μ's达峰值,随后μ's保持平稳或缓慢下降。
2.3.3 各组荷瘤大鼠LITT前后μ's的变化值比较荷瘤大鼠μ's会因肿瘤物质的组成不同即病理分级不同而有所差别[11],所以采用μ's的变化值来进行分析,定义变化值为:每只荷瘤大鼠热疗过程中μ's的峰值与该大鼠LITT手术前初始状态的均值的差值,采用5只大鼠变化值的平均值±标准偏差来表示不同组别的光学参数变化情况。由于非热疗组无峰值出现,故不纳入统计分析,用“—”表示(表1)。

图1 大鼠建模成功后影像学及病理学表现Fig 1 Tumor imaging and pathological manifestations

表1 荷瘤大鼠LITT前后μ's的变化cm-1Tab 1 The changes ofμ's before and after LITT for rats with glioma cm-1
结果进行统计学分析:同一功率下不同时间组间两两比较,差异具有统计学意义(P<0.05);同一时间下不同功率组间两两比较,差异亦具有统计学意义(P<0.05)。
2.4 LITT后荷瘤大鼠的影像学及病理学图像
术后第2天使用小动物专用7.0 T MRI扫描,各组可见明显片状类圆形坏死灶,T2WI表现为肿瘤中心低信号影,低信号灶周围信号略有升高,水肿带形成(图2a)。行MRI后取胶质瘤组织进行HE染色,可见肿瘤中心形成明显坏死灶,表现为胶质瘤细胞完全变性坏死,胞核消失,胞质空泡化;其外为反应区,胞膜较完整,肿瘤结构依稀可见,周围有水肿形成(图2b)。
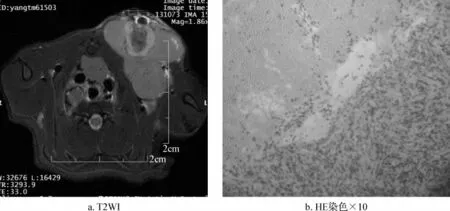
图2 荷瘤大鼠LITT后影像学及病理学表现Fig 2 Imaging and pathological manifestations of tumor after LITT
2.5 LITT后荷瘤大鼠坏死灶体积
经病理学验证,可以将连续扫描影像学的最大坏死灶直径测量值作为坏死灶的直径D(D=2R),同时测量得坏死灶的高H。利用公式V=4πR2H/3=πD2H/6计算获得坏死灶体积,体积的数据见表2。
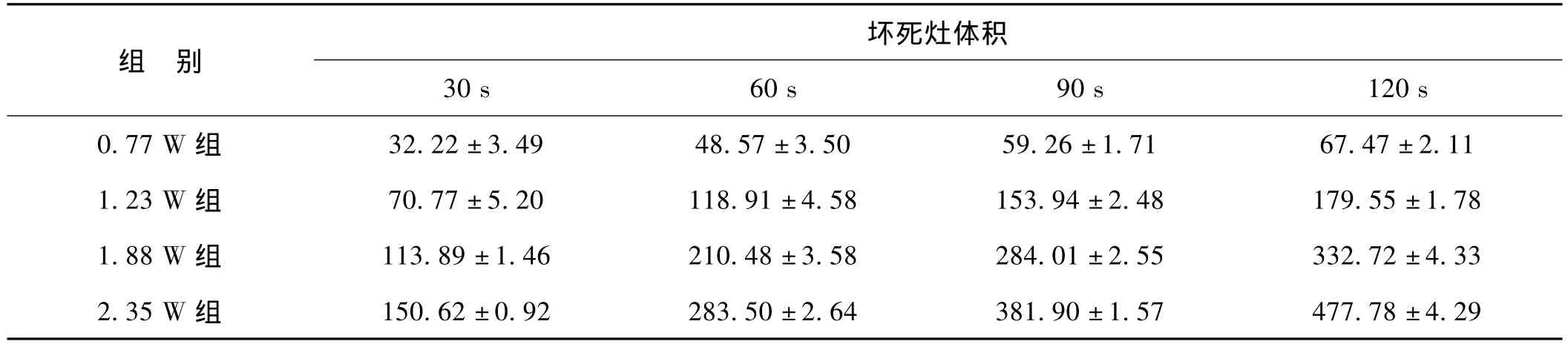
表2 荷瘤大鼠LITT坏死灶体积mm3Tab 2 The volume of necrosis after LITT for rats with glioma mm3
统计结果分析:相同热疗功率下,不同时间组间两两比较,热疗坏死灶体积差异有统计学意义(P<0.05),相同热疗时间下,不同功率组间两两比较,热疗坏死灶体积差异亦有统计学意义(P<0.05)。
3 讨 论
LITT已经用于神经胶质瘤的临床治疗,LITT的功率、时间直接影响治疗效果及预后[8-10],对LITT的术中实时监测是十分必要的,因此我们将NIRS技术应用于LITT大鼠胶质瘤,研究NIRS对胶质瘤LITT进行实时监测的可行性。生物组织对于近红外区域的光(700~1 200 nm)具有相对的透明性,利用近红外波段光对组织的良好通透性及在不同组织的光学差异性,有望达到对组织结构精确定性、精准测量、精细定位的目的[11-12]。光子进人体组织后主要与组织发生以下相互作用:(1)吸收,从而导致能量在组织中的丧失,表征这一作用的光学参数称为吸收系数(absorbtion coefficient,μα);(2)散射,发生在介质的边界,如与神经活动相关的神经元的膜表面,是由于在显微水平上组织中各组成成分的折射率不连续所致,表征这一作用的光学参数称为 μ's,它表示散射事件发生的频率,或者单位路径内光子因散射而损失的光能量的比率。由于吸收和散射的作用,光在通过组织后其强度会减小,削减的程度与所通过组织的吸收系数和 μ's的大小有关,因此可以说漫反射或透射光中携带着大量的生物组织结构和成分的信息[13],从漫反射或透射光的光谱信息中了解光在组织中被吸收和散射的情况,从而解算出组织的 μα和 μ's等光学参数,这正是NIRS技术的理论基础[14]。运用NIRS技术监测各功率、时间下 LITT过程中肿瘤组织μ's的变化规律,并对其加以分析。相同时间、不同功率下,μ's的变化值随功率变化较明显,提示组织受损程度不同,术后通过病理学及影像学检查测得坏死灶的体积及程度确实存在差异,即μ's变化值的大小对应不同的组织损伤程度。相同功率、不同时间下,μ's的变化值随时间延长而增大,坏死灶的体积也随之增大,提示热疗时间越长肿瘤组织坏死程度越严重。对各组μ's数据、坏死灶体积数据进行统计学处理,功率不变时,各时间组之间存在明显的统计学差异(P<0.05),时间不变时,各功率组之间亦存在明显的统计学差异(P<0.05)。
MRI、B超等设备虽可用于LITT术中实时监测,但灵活性及准确性差,故较少用于术中实时监测。刘华亭等[15]证实NIRS参数(μ's)变化与大鼠胶质瘤射频毁损的温度、时间具有相关性,本实验提示升高功率和延长时间μ's发生了明显的变化,相对应的探头周围肿瘤组织的坏死体积也发生了明显的变化,μ's很好地反映了LITT坏死体积的变化情况,故能作为LITT实时监测的一个良好指标。
[1]刘伟国.胶质瘤综合治疗进展[J].实用肿瘤杂志,2004,19(6):462-465.
[2]MENOVSKY T,BEEK J F,van GEMERT M J C,et al.Interstitial laser thermotherapy in neurosurgery:A review[J].Acta Neurochirurgica,138,(9):1019-1026.
[3]ROUX F X.Laser Interstitial thermotherapy in stereotactical neurosurgery[J].Lasers in Medical Science,1992,7:121-126.
[4]SCHWABE B,KAHN T,HARTH T,et al.Laser-induced thermal lesion in the human brain:short and long-term appearance on MRI[J].Comput Assist Tomogr,1997,21:818-882.
[5]LEONARDI M A,LUMENTA CB,GUMPRECHT H K,et al,Stereotaetic guided laser—induced interstitial thermotherapy(SLITT)in gliomas with intraoperative morphologic monitoring in an open MR:clinical experience[J].Minim Invasive Neurosurg,2002,45:201-207.
[6]JOACHIM-SCHWARZMAIERA H,EICKMEYERB F.MR-guided laser-induced interstitial thermotherapy of recurrent glioblastoma multiforme preliminary results in 16 patients[J].European Journal of Radiology,2006,59(2):208-215.
[7]李荣,钱志余,戴丽娟.生物组织近红外光谱自动测试系统[J].计算机测量与控制,2007,15(2):154-156.
[8]刘斌,雷霆,李龄,等.激光间质热治疗对大鼠脑胶质瘤细胞凋亡的影响[J].中华实验外科杂志,2001,18:491-492.
[9]刘守勋,刘昊.胶质瘤激光间质热疗的实验研究[J].中华神经外科疾病研究杂志,2002,1(3):209-212.
[10]江世臣,张学学.激光诱导间质肿瘤热疗的数值模拟和实验研究[J].工程热物理学报,2005,(S1):187-190.
[11]郭丽娜,钱志余,李宽正,等.近红外光谱(NIRS)技术的大鼠胶质瘤活体在位检测研究[J].量子电子学报,2008,25(4):483-488.
[12]张正雄,游洋.近红外光谱技术在胶质瘤大鼠射频热疗中的应用研究[J].东南大学学报:医学版,2009,28(3):202-206.
[13]HUANGL,TIANF H,DINGH S,et al.The study of methods for measurement tissue oxygenation by using NIRS[J].J Infrared Milim Waves,2003,22(5):379-383.
[14]赵友全,范世福,曹文新.生物组织光学特性参数及其描述[J].国外医学:生物医学工程分册,2000,23:76-79.
[15]刘华亭,杨天明,钱志余,等.应用近红外光谱技术对胶质瘤大鼠射频热疗的实时在位监测研究[J].东南大学学报:医学版,2011,30(3):436-440.

