中东部湖区营养物基准推荐值的生态毒理学评价
郭佳林,胡翔*,欧阳洋,霍守亮
1.北京化工大学化学工程学院,北京 100029
2.中国环境科学研究院,北京 100012
随着我国经济持续快速的发展,以及工业化、城市化、农业现代化不断地加快,大量氮磷等营养物进入湖泊江河流域,导致湖泊水体环境不断恶化、水华频繁发生、生物多样性下降,湖泊水生态安全受到严重威胁。为保障湖泊水生态系统健康,防止发生蓝藻暴发等不良水体生态效应,湖泊水体富营养化预防与控制逐渐成为我国重点研究和亟须解决的重大环境问题[1]。国家环境管理的创新跨越和环境战略目标的实现,亟需适合中国区域特点的水环境基准作为科学依据,而湖泊水环境基准方面的系统研究刚开始起步。我国中东部湖区属于湖泊营养物一级生态分区,研究中东部湖区营养物基准体系十分必要。
营养物是湖泊水生生物和健康生态系统所必需的,但是营养物过量会导致湖泊富营养化[2]。营养物基准是指“以保护人类健康和生态平衡为目的,用可信的科学数据表示水中营养物质的允许浓度或能间接表示水中营养物浓度的相关理化和生物指标的数值”[3]。在制定营养物基准方面,美国的水质基准被认为是目前最为完善和最具有科学性的[4],其初步形成了分区分级的营养物基准体系,其一级分区营养物基准采取了四个指标:总磷(TP)浓度、总氮(TN)浓度、叶绿素 a(Chl-a)浓度和透明度(SD)[5-6]。
美国国家环境保护局(US EPA)主要利用参照状态法确定湖泊营养物基准值[5],Kenney 等[7]在参照状态法基础上提出通过建立结构方程模型和专家判断确定华盛顿湖等湖泊营养物基准值。国内一些学者通过借鉴参考美国的方法,确定出我国中东部湖区的营养物参照状态值[8],在其基础上通过结构方程模型(SEM)得出营养物候选基准值;霍守亮等[9]研究分析了我国湖泊营养物基准指标候选变量,并归纳了选择营养物基准指标时应遵循的一些原则。笔者在其基础上分析中东部湖区湖泊特点,根据结构方程模型(SEM)得出的营养物候选基准值,选取TP浓度、TN浓度、Chl-a浓度和SD作为中东部湖区营养物基准值的候选指标,由于SD指标的模拟较为困难,因此在实验室中只选取TP浓度、TN浓度和Chl-a浓度来模拟我国中东部湖区的水质状况。
枝角类是水体浮游动物的重要类群,能摄食微囊藻,研究其与微囊藻的生态关系非常必要,对枝角类毒性方面的研究工作已有较多报道[10],其中大型溞是国际通用的毒理学试验标准模式动物,其生长繁殖速度快且易于培养,对环境条件变化敏感性高。在水生生物生态毒理试验研究方面,国内外不少学者应用大型溞进行慢性毒性试验[11-13]。因此,笔者以大型溞(Daphnia magna)为试验对象,通过观察其生长、繁殖情况对我国中东部平原湖区进行生态毒理学评价。
1 材料和方法
1.1 材料
有毒铜绿微囊藻和斜生栅藻由中国环境科学研究院提供,均为单细胞培养物。用M11培养基进行扩大培养,温度为27℃,表面光照强度为2000 lx,光暗比为16∶8。大型溞由中国环境科学研究院提供,在实验室进行纯化培养,温度为23℃,表面光照强度为2000 lx,光暗比为16∶8,试验所用的大型溞为第三代成熟期大型溞。
1.2 方法
1.2.1 单因素试验
TP浓度、TN浓度、Chl-a浓度、SD和pH是湖泊营养物基准体系的重要指标,由于实验室中SD指标的模拟较困难,因此,选取 TP浓度、TN浓度、Chl-a浓度和pH四项指标研究各变量对大型溞存活繁殖状况的影响,并确定各变量指标的最优值。
1.2.2 模拟中东部湖区试验
根据单因素试验结果,共设3个试验组和1个对照组,3个试验组的水质条件分别对应所选3个基准候选值(E1、E2和E3),其水质条件如表1所示。在3个试验组中加入有毒铜绿微囊藻;对照组中加入斜生栅藻(无毒)取代有毒的铜绿微囊藻,对照组水质条件与试验组1相同。将配好的溶液分别装入4个1 L的烧杯中。随机选取30只已培养的第三代成熟期大型溞分别放入上述4个烧杯中。试验开始时,每天早晚给各组加入20 mL密度为4×106个/mL的斜生栅藻,以补充充足的饵料,统计大型溞的个数和新生幼溞个数,并及时将各烧杯中新生的幼溞移出。每组试验设5个重复,每组结果取5个重复试验结果的平均值。
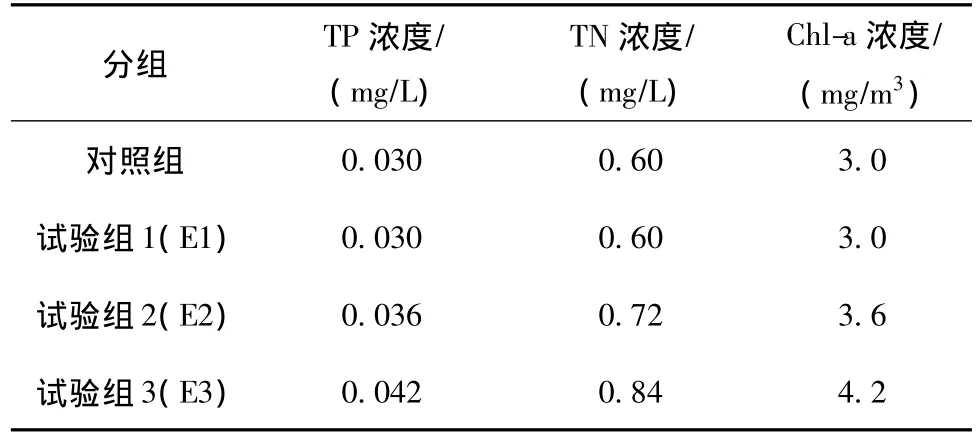
表1 试验水质Table 1 The water quality of the experiments
2 结果
2.1 TP浓度的影响
保持TN浓度(0.72 mg/L)和Chl-a浓度(3.6 mg/m3)不变,TP浓度分别为0.030,0.036和0.042 mg/L,试验结果如图1所示。TP浓度为0.036 mg/L的大型溞存活率〔图1(a)〕明显高于其他2个浓度>u0.05),TP浓度为0.030和0.042 mg/L的大型溞间没有明显的差异性(<u0.05)。同样,TP浓度为0.036 mg/L的大型溞出生率〔图1(b)〕明显高于其他2个浓度(>u0.05),而TP浓度为0.030和0.042 mg/L的大型溞出生率间差异性不明显(<u0.05)。从图1(a)可以看出,虽然这3个浓度的大型溞存活率都是从第3天开始出现较大幅度的降低,但从最终结果来看,与其他2个浓度的大型溞相比,TP浓度为0.036 mg/L的大型溞存活率相对较高,为40%。从图1(b)可以看出,TP浓度为0.036 mg/L的大型溞第一次繁殖的时间为第8天,出生率为50%;而 TP浓度为0.030和0.042 mg/L的大型溞第一次繁殖时间分别为第10天和第11天,大型溞出生率也明显低于TP浓度为0.036 mg/L。由此可见,TP浓度的最优值为0.036 mg/L。

图1 TP浓度对大型溞存活率和出生率的影响Fig.1 The effect on the survival proportion and natality of Daphnia magna by total phosphorous
2.2 TN浓度的影响
控制TP浓度(0.036 mg/L)和Chl-a浓度(3.6 mg/m3)不变,TN浓度分别为0.60,0.72和 0.84 mg/L,试验结果如图2所示。
3个浓度的大型溞存活率〔图2(a)〕从一开始就没有明显的差异性(<u0.05),但从大型溞出生率〔图2(b)〕看,TN浓度为0.72 mg/L与其他2个浓度有明显的差异性(>u0.05),而其他2个浓度间没有明显的差异性(<u0.05)。从图2(a)可以看出,TN浓度为0.72 mg/L的大型溞存活率从第3天开始高于其他2个浓度,最后趋于稳定,为40%。从图2(b)可以看出,TN浓度为0.72 mg/L的大型溞第一次繁殖时间为第8天,早于其他2个浓度;而出生率也明显高于其他2个浓度,为40%。由此可以得出,TN浓度最优值为0.72 mg/L。
2.3 Chl-a浓度的影响
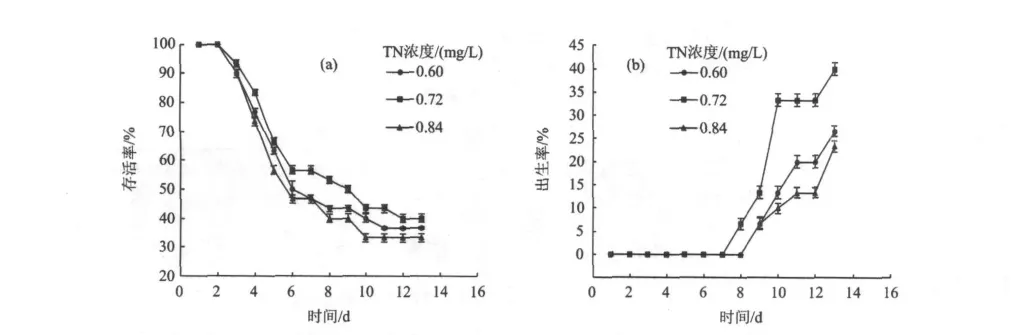
图2 TN浓度对大型溞存活率和出生率的影响Fig.2 The effect on the survival proportion and natality of Daphnia magna by total nitrogen
保持TP浓度(0.036 mg/L)和TN浓度(0.72 mg/L)不变,Chl-a浓度分别为 3.0,3.6和 4.2 mg/m3,试验结果如图3所示。从大型溞的存活率〔图3(a)〕来看,3个浓度间没有显著差异性(<u0.05),但从大型溞的出生率〔图3(b)〕可以看出,Chl-a浓度为3.6 mg/m3与其他2个浓度间有明显的差异性(u0.05),同时Chl-a浓度为3.0和4.2 mg/m3间也有明显的差异性(>u0.05)。从图3可以看出,虽然3个浓度的大型溞存活率差别不大,但Chl-a浓度为3.6 mg/m3的大型溞出生率要明显好于其他2个浓度,由此得出,Chl-a浓度的最优值为3.6 mg/m3。

图3 Chl-a浓度对大型溞存活率和出生率的影响Fig.3 The effect on the survival proportion and natality of Daphnia magna by chlorophyll-a
2.4 pH的影响
控制 TP浓度(0.036 mg/L)、TN浓度(0.72 mg/L)和Chl-a浓度(3.6 mg/m3)不变,以中东部平原湖区实际pH偏碱性为依据,选取pH分别为7.0,7.5和8.0,试验结果如图4所示。

图4 pH对大型溞存活率和出生率的影响Fig.4 The effect on the survival proportion and natality of Daphnia magna by pH
2.5 大型溞的存活繁殖情况
根据单因素试验结果,通过模拟中东部湖区试验,得出大型溞的存活率和出生率如图5所示。在不同的基准候选值水质条件下喂养大型溞,对比试验组和对照组发现,各试验组与对照组间的存活率差异性显著(u0.05),E2组的存活率与E1和E3组的差异性明显(u0.05),但是E1和E3组间的差异性不明显(<u0.05)。同样,大型溞出生率的差异显著性与存活率一致。从图5(a)可以看出,在14 d内对照组中大型溞的存活率明显趋于稳定,大型溞没有大幅死亡现象;而试验组有所不同,E1、E2和E3组大型溞在第4天后其存活率开始急剧降低,其中E3组的存活率降低最为明显。在经过9 d后,由于大型溞对毒性环境的适应,其存活率基本趋于稳定,最终E2组大型溞的存活率相对较高,约为26%。通过对比对照组和试验组的大型溞繁殖状况〔图5(b)〕可以看出,对照组的繁殖能力明显优于试验组,对照组的出生率达到了70%,并且第一次繁殖时间仅为3 d。而试验组第一次繁殖时间在8 d后才开始,并且出生率也非常低,最高的是E2组,为33%,最低的是E3组,仅为10%。
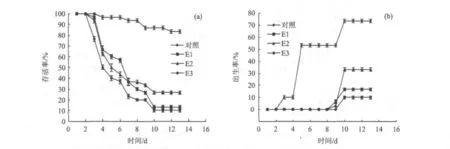
图5 大型溞的存活率和出生率Fig.5 Survival proportion and natality of Daphnia magna
3 讨论
在模拟中东部湖区试验中,通过对比可以看出,大型溞在对照组中基本保持较高的存活率,而在其他3个试验组中的存活率明显较低,这主要是由于有毒铜绿微囊藻的抑制作用,这种抑制可能是铜绿微囊藻产生的藻毒素对大型溞生理代谢活动产生的负面作用引起的。一般认为,藻毒素对真核生物的毒性机制在于藻毒素可特异性地抑制丝氨酸和苏氨酸蛋白磷脂酸合成酶1和2A(PP1和 PP2A)[14]。而PP1和PP2A参与许多重要的胞内过程,如细胞生长、分化、蛋白质合成、细胞信号转导等[15],并且由于对PP1和PP2A活性的抑制,相应地增加了蛋白激活酶的活性,导致细胞内多种蛋白质的过磷酸化,造成细胞骨架系统架构破坏,致使细胞畸形[16]。此外Lürling等[17]认为,在非常低浓度的范围内藻毒素对大型溞产生的影响不是随着浓度的升高而增大,同时铜绿微囊藻不但能够产生藻毒素,而且还会分泌出其他生物活性物,这样在较低的浓度下,该生物活性物可能会对大型溞产生较为有利的影响。除此之外,由于低浓度磷氮的存在,也会对大型溞产生影响。比较3个试验组的试验结果发现,E2组大型溞的存活率和出生率是最好的(图5)。另外试验还发现,在有毒铜绿微囊中大型溞产第一胎时间比对照组晚很多,这也是由于试验组中铜绿微囊藻的毒性作用所致。Guo等[18]在试验研究中也认为,微囊藻毒素的浓度越高对大型溞的出生繁殖影响也就越大。
由于营养物基准值是在非常低的浓度范围内,大型溞在该范围内所受到的不利影响与浓度的高低不成正相关,此外还受到铜绿微囊藻分泌物的影响,从单因素变量影响的试验结果发现,其TP浓度、TN浓度、Chl-a浓度和pH的最佳指标值分别为0.036 mg/L,0.72 mg/L,3.6 mg/m3和 7.5。与此同时,在模拟中东部湖区营养物基准值的试验中,E2组大型溞的存活和繁殖状况在各试验中均为最佳,试验得到的营养物基准最优值与单因素变量试验结果最优值相一致,因此,初步确定了中东部湖区的营养物基准值:TP浓度为0.036 mg/L;TN浓度为0.72 mg/L;Chl-a浓度为3.6 mg/m3。
4 结论
(1)在单因素试验中,通过比较大型溞的出生率和存活率,在其他因素不变时,确定了各单因素的最优值:TP浓度为0.036 mg/L,TN浓度为0.72 mg/L,Chl-a浓度为3.6 mg/m3和pH为7.5。
(2)通过中东部湖区营养物推荐值水质条件模拟试验,分析各试验组大型溞的出生率和存活率得出,E2组大型溞的存活发育状况优于E1和E3组,初步确定了中东部湖区的营养物基准值:TP浓度为0.036 mg/L;TN浓度为0.72 mg/L;Chl-a浓度为3.6 mg/m3。
[1]吴丰昌,孟伟,宋永会,等.中国湖泊水环境基准的研究进展[J].环境科学学报,2008,28(12):2385-2393.
[2]US EPA.National strategy for the development of regional nutrient criteria(EPA-822-R-98-002)[R].Washington DC:United States Environment Protection Agency,1998.
[3]郑丙辉,许秋瑾,周保华,等.水体营养物及其响应指标基准制定过程中建立参照状态的方法:以典型浅水湖泊太湖为例[J].湖泊科学,2009,21(1):21-26.
[4]霍守亮,陈奇,席北斗,等.湖泊营养物基准的制定方法研究进展[J].生态环境学报,2009,18(2):743-748.
[5]US EPA.Nutrient criteria technical guidance manual:lakes and reservoirs(EPA-822-B-00-001)[R].Washington DC:United States Environment Protection Agency,2000.
[6]US EPA.Ambient water quality criteria recommendations:lakes and reservoirs in nutrient ecoregion II(EPA-822-B-00-007)[R].Washington DC:United States Environment Protection Agency,2000:20-21.
[7]KENNEY M A,ARHONDITSIS G B,REITERC L C,et al.Using structural equation modeling and expert elicitation to select nutrient criteria variables for south-central Florida lakes[J].Lake Reservoir Manag,2009,25(2):119-130.
[8]霍守亮,陈奇,席北斗,等.湖泊营养物参照状态建立方法研究[J].生态环境学报,2010,19(3):544-549.
[9]霍守亮,陈奇,席北斗,等.湖泊营养物基准的候选变量和指标[J].生态环境学报,2010,19(6):1445-1451.
[10]de FIGUEIREDO D R,AZEITEIRO U M,ESTEVES S M,et al.Microcystin-producing blooms:a serious global public health issue[J].Ecotoxicol Environ Saf,2004,59(2):151-163.
[11]GORBI G,CORRADI M G.Chromium toxicity on two linked tropic levels:I.effects of contaminated algae on Daphnia magna[J].Ecotoxicology Environ Saf,1993,25(1):64-71.
[12]DAVE G.Effects of fluoride on growth reproduction and survival in Daphnia magna[J].Comparative Biochemistry Physiology,1984,78C(2):425-431.
[13]DAO T S,DO-HONG L C,WIEGAND C.Chronic effects of cyanobacterial toxins on Daphnia magna and their offspring[J].Toxicon,2010,55(7):1244-1254.
[14] MACKNINTOSH C,BEATTIO K A,KLUMPPS,etal.Cyanobacterial microcystin-LR is a potent and specific inhibitor of protein phosphatases 1 and 2A from both mammals and higher plants[J].FEBS Lett,1990,264(2):187-192.
[15]MUMBY M C, WALTER G. Protein serine/threonine phosphatases:structure,regulation and function in cell growth[J].Physiol Rev,1993,73(4):673-699.
[16]李效宇,宋丽荣,刘永定.微囊藻毒素的产生、检测和毒理学研究[J].水生生物学报,1999,23(5):517-522.
[17]LÜRLING M,van der GRINTEN E.Life-history characteristics of Daphnia exposed to dissolved micrycystin-LR and to the cyanobacterium Microcystis aeruginosa with and without microcystins[J].Environ Toxicology Chemistry,2003,22(6):1281-1287.
[18]GUO N C,XIE P.Development of tolerance against toxic Microcystis aeruginosa in three cladocerans and the ecological implications[J].Environ Pollut,2006,143(3):513-518. ○

