柑橘内生放线菌CR20的鉴定与拮抗活性
胡秀荣,黄振东,蒲占湑,杜丹超,陈国庆,鹿连明
(浙江省柑橘研究所,浙江台州 318020)
柑橘青、绿霉病是柑橘类果品贮运期间发生最普遍、危害最严重的侵染性病害[1],其病原菌为青霉亚属的2种不同真菌。这2种病原菌通常可同时侵染危害柑橘果实,且具有较强的侵染性和扩散能力。受病菌感染的果实通常可在1~2周时间内全果腐烂,同时病果上产生大量的分生孢子向四周扩散侵染危害其他果实。因此,柑橘青、绿霉病对储运期柑橘造成了极大的危害。据统计,仅由于这2种病的感染,柑橘采后损失率即可高达30% ~50%[2]。
目前主要通过化学杀菌剂如咪鲜胺、抑霉唑和百可得等来防治柑橘青、绿霉病。但这些化学药剂的长期大量使用,不仅使环境污染和果品中农药残留等问题日渐突出,而且易诱导病菌产生抗药性,使其对病害的实际防治效果大为下降。随着人们生活质量的提高,对农药残留等食品安全问题愈来愈重视。于是,寻求安全、无毒、高效的控制柑橘类果品采后腐烂的新方法成为当务之急,而利用拮抗微生物防治采后病害有望成为代替化学药剂的一种安全、无毒及有效的新方法[3]。
黄岩被作为世界宽皮橘的始祖地,有着2 300多年的栽培历史,拥有180多个柑橘品种,在栽培时间较长的橘园土壤中势必存在着丰富的根际微生物,如能加以利用,筛选有益的生防菌株,对于植物病害的生物防治有着重要的意义。本研究拟于黄岩地区栽培时间较长的橘园中采集不同品种的柑橘根部样品,从中分离内生放线菌,以期筛选获得对柑橘青霉病和绿霉病具有较好抑制效果的拮抗菌株,进一步研究拮抗菌株对柑橘果实采后的防病效果并探讨其应用前景。
1 材料与方法
1.1 柑橘内生放线菌的分离
1.1.1 样品的采集
在黄岩地区本地早、椪柑、温州蜜柑、槾桔、甜橙5个不同品种的柑橘园内,采集柑橘植株根部样品,每个品种10份,用于微生物的分离。
1.1.2 分离培养基
配制高氏合成1号培养基,成分如下:可溶性淀粉20 g,硝酸钾1 g,磷酸氢二钾0.5 g,硫酸镁0.5 g,氯化钠0.5 g,硫酸亚铁0.01 g,重铬酸钾0.05 g,琼脂20 g,纯净水1 000 mL,pH值7.2~7.4,于高压灭菌锅中灭菌后备用。
1.1.3 内生放线菌的分离
将采集的柑橘根用自来水冲洗干净,用99%乙醇处理1 min,3%次氯酸钠处理5 min,再用99%乙醇处理30 s,最后用灭菌水冲洗3次。灭过菌的根用无菌剪刀在无菌操作台上剪成1 cm的小段,置于分离培养基表面。之后将培养皿倒置于28℃微生物培养箱培养2~6周,待放线菌长出,挑取菌丝进行转接纯化,纯化培养的菌株再接种到含分离培养基的试管中培养,然后放于4℃冰箱保存备用[4]。
1.2 具抑菌活性的内生放线菌的筛选
1.2.1 指示菌平板的制备
柑橘青、绿霉病的病原菌由本实验室从患病的柑橘果实上分离并保存。将保存的2种病原菌转接于PDA培养基平板上,置于28℃的微生物培养箱培养,待菌落产生孢子后,往培养皿内加入10 mL无菌水收集孢子,用无菌纱布过滤后,用无菌水调整孢子悬浮液浓度至104个孢子·mL-1,用移液器吸取20 μL孢子悬浮液均匀涂布于PDA平板上待用。
1.2.2 具拮抗活性菌株的筛选
采用挖块法测定内生放线菌的生物活性:将分离获得的内生放线菌接种于高氏合成1号培养基平板上,28℃培养5 d后,在有菌生长处用打孔器取直径5 mm的菌饼,置于接种有指示菌的平板中央,然后于28℃的微生物培养箱培养。48 h后观察菌饼周围透明抑菌圈的有无和大小,据此判定内生放线菌的抑菌活性[4]。
1.3 菌株CR20发酵液对采后柑橘的防病效果
1.3.1 菌株CR20发酵液的制备
将菌株CR20接入高氏合成1号液体培养基(250 mL锥形瓶100 mL培养基)中,于28℃恒温摇床中200 r·min-1振荡培养7 d后,将培养物分装于离心管中,置于10 000 r·min-1的高速离心机中离心5 min,收集上清液,最后利用过滤除菌装置使上清液透过细菌过滤膜去除其中的孢子,收集滤液即为菌株CR20的发酵液[5]。
1.3.2 菌株CR20对病害的防效测定
取温州蜜柑的新鲜果实,用解剖刀在果实腰部刺一伤口 (3 mm×3 mm),在伤口处滴入15 μL菌株CR20发酵液,同时以滴加高氏合成1号液体培养基的果实为阴性对照,滴加咪鲜胺药液 (浓度为200 mg·mL-1)的果实为阳性对照,处理后的果实置于塑料盒内,于室温放置24 h,再分别接种浓度为104个孢子·mL-1的柑橘青霉菌和绿霉菌的孢子悬浮液,用保鲜袋密封塑料盒后放置于28℃下保湿培养,在接种后的第7,14天分别统计发病率并计算防效。每次实验处理30个果实,重复3次。
1.4 菌株CR20的形态学特征观察
1.4.1 菌株CR20的菌丝和孢子形态观察
制备菌株CR20的孢子悬浮液,吸取20 μL滴加在高氏合成1号培养基平板上,用无菌三角棒涂布均匀后,将灭菌的盖玻片斜插入平板内,每皿4片,放于28℃培养,在培养1,7和21 d后分别取出盖玻片用细胞壁染色法染色 (1%磷钼酸3~5 min,再用1%甲基绿染5 min),无菌水冲洗后,将盖玻片自然风干,在油镜下观察[4]。
1.4.2 菌株CR20在不同培养基上的生长特性
采用国际通用的5种培养基,包括2种合成培养基:ISP-4和ISP-5;2种有机培养基:ISP-3和ISP-2;1种产黑色素培养基:ISP-6。将菌株CR20接种到以上培养基上,并至于28℃恒温培养,接种后3~4周,观察菌株CR20的气生菌丝、基内菌丝的生长情况及可溶性色素的产生情况[4]。
1.5 菌株CR20的生理生化特性的测定
用于菌株生理生化特性测定的试验如碳源利用、黑色素产生、H2S产生、七叶苷利用、纤维素利用、明胶液化、淀粉水解、牛奶凝固及冻化、纤维素水解、硝酸盐还原等参照文献[4]进行。
1.6 菌株CR20的PCR扩增及序列分析
1.6.1 放线菌总DNA的提取
取于高氏合成1号液体培养基中培养4~5 d的CR20的菌液,分装于无菌离心管中,10 000 rpm·min-1离心10 min后弃上清液,收集菌体沉淀并用无菌滤纸吸干多余水分后,称取0.1~0.2 g菌体于无菌研钵中;加入少量PVP后用液氮研磨成粉末;之后参照王凡等[6]的方法利用CTAB法提取DNA,最后提取的DNA沉淀溶解于10~20 μL TE(含RNase 50 mg·L-1)中并放置于-20℃保存备用。
1.6.2 放线菌16S rDNA的PCR扩增
以提取的总DNA为模板,以细菌通用引物27F:5'-AGAGTTTGATCMTGGCTCAG-3'和1492R:5'-TACGGYTACCTTGTTACGACTT-3'扩增放线菌16S rDNA,PCR 反应体系为:10×Buffer 2.5 μL,dNTPs 2 μL,上 下 游 引 物 (10 μmol· L-1) 各1.5 μL,Taq DNA 聚合酶0.2 μL,DNA 模板1 μL,无菌水补足至总体积25 μL。反应条件为:94℃5 min;94℃ 1 min,55℃1 min,72℃ 2 min,35个循环;最后72℃延伸10 min。将PCR产物上样于含有GelRed染料的琼脂糖凝胶中电泳,并于凝胶成像系统中观察拍照。
1.6.3 PCR产物测序及序列分析
于琼脂糖凝胶上割取目的条带,利用琼脂糖凝胶回收试剂盒回收PCR产物,纯化产物送交上海Invitrogen公司测序,测序结果整理后,利用NCBI Blast进行在线比对,查找Genbank数据库中与之同源性较高的序列,通过 Mega4.1软件中的Neighbor joining方法构建系统发育树,在构建系统发育树时进行自举检验,重复抽样1 000次,随机种子数为64 238颗。
2 结果与分析
2.1 内生放线菌的分离
从采集的50份柑橘根部样品中分离获得内生放线菌共42株,其中链霉菌属Streptomyces放线菌占70%以上,其他一些则属于链轮丝菌属Streptoverticillium、小单孢菌属Micromonospora及一些尚未确定到属的放线菌种类。同时发现不同柑橘品种根部内生防线菌种群数量有差别,其中本地早蜜橘内生放线菌数量明显高于其他,种植时间较长的老橘园中柑橘根部内生放线菌数量也明显较高,推测老橘园土壤中可能富集更多的微生物。
2.2 具抑菌活性菌株的筛选
通过抑菌实验,从42株分离获得的内生放线菌中筛选出1株可同时对柑橘青霉菌和绿霉菌有抑菌活性的菌株,编号为CR20,该菌株较其他菌株对柑橘青、绿霉菌具有更为显著的抑制效果,其抑菌圈直径分别可达35和41 mm。
2.3 菌株CR20发酵液柑橘采后保鲜试验
从表1看出,接种7 d后,CR20发酵液对青霉病菌的防效达到100%,与咪鲜胺效果相当,对绿霉病的防效达到88%,稍低于咪鲜胺的防效;接种14 d后,拮抗菌株CR20发酵液对青霉病菌的防效为55%,对绿霉病的防效为49%,均低于咪鲜胺防效。
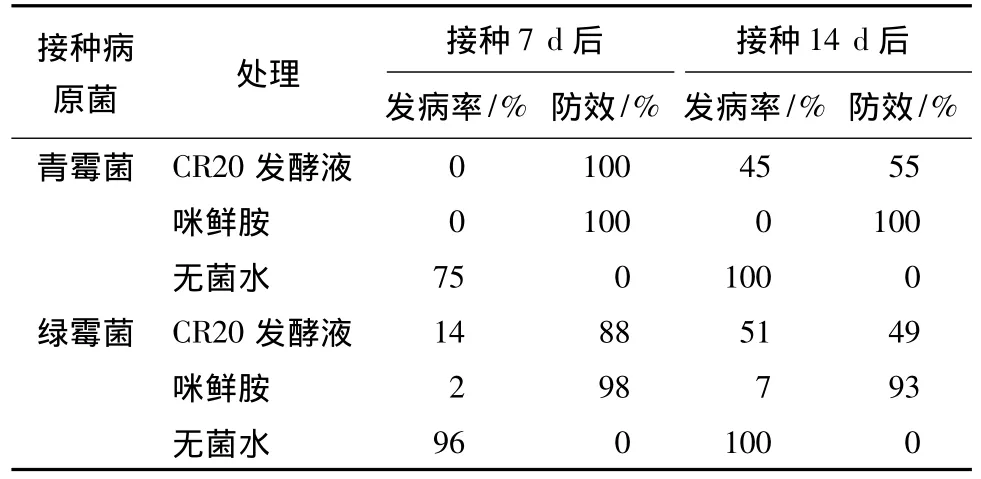
表1 CR20菌株发酵液对柑橘果实采后病害防效
2.4 菌株CR20的形态特征
2.4.1 形态特征
菌株CR20在高氏合成1号培养基上生长茂盛,气生菌丝为粉红色,基内菌丝为黄色,单个菌落表面有气孔 (图1)。在显微镜下可观察到其气生菌丝多分枝,孢子丝较直,孢子表面光滑,呈椭圆形至圆柱形。
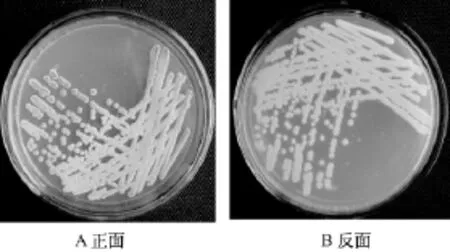
图1 CR20在高氏合成1号培养基上的培养特征
2.4.2 在不同培养基上的生长特性
菌株CR20在供试的6种培养基上生长情况见表2。在ISP-3和ISP-2这2种有机培养基上均可良好生长;在ISP-4和ISP-5这2种合成培养基上长势相差较大,在ISP-4生长良好,而在ISP-5上生长贫乏;在ISP-6黑色素培养基上生长贫乏,且有黑色素生成。
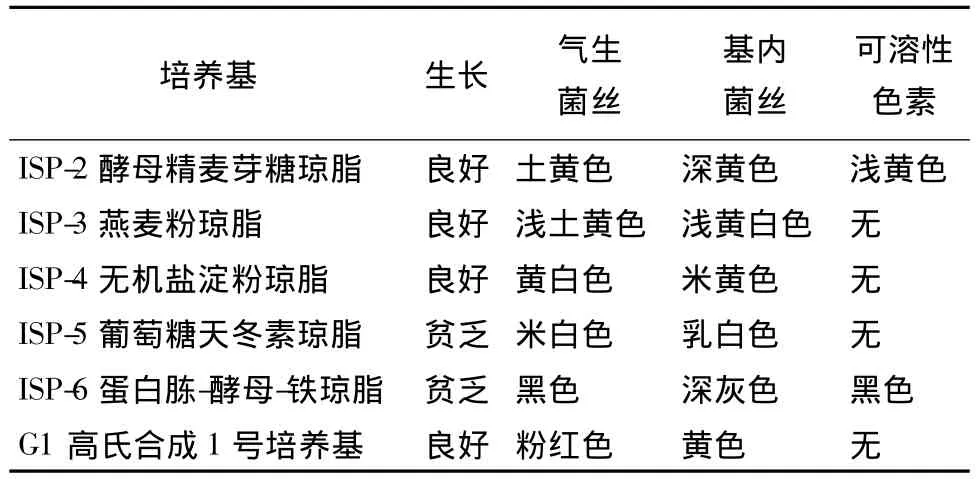
表2 放线菌CR20菌株的培养特征
2.5 菌株CR20的生理生化特性
菌株CR20可利用蔗糖、半乳糖、葡萄糖、甘露醇作为碳源,而不能利用果糖、肌醇、棉子糖、鼠李糖和阿拉伯糖。可使牛奶凝固并胨化,可以利用七叶苷及产生黑色素等 (表3)。

表3 放线菌CR20菌株的生理生化特征
2.6 菌株CR20 16S rRNA的PCR扩增及系统发育树构建
PCR产物经琼脂糖凝胶电泳检测,可观察到大小为1 500 bp左右的目的条带,与预期结果一致(图2)。测序结果经Blast比对分析发现,所测序列与Genbank中链霉菌属的多个种均具有较高的同源性。系统发育分析显示 (图3),所分离菌株CR20与Streptomyces cinnamonensis和Streptomyces virginiae具有极近的亲缘关系,其16S rRNA序列相似性可达100%。结合该菌种的形态学特征和生理生化特性,将菌株CR20初步鉴定为链霉菌属的弗吉尼亚链霉菌 (Streptomyces virginiae)。
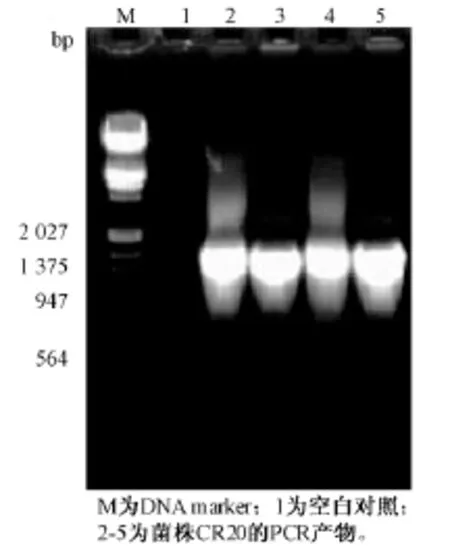
图2 CR20的16S rDNA的PCR产物电泳图谱
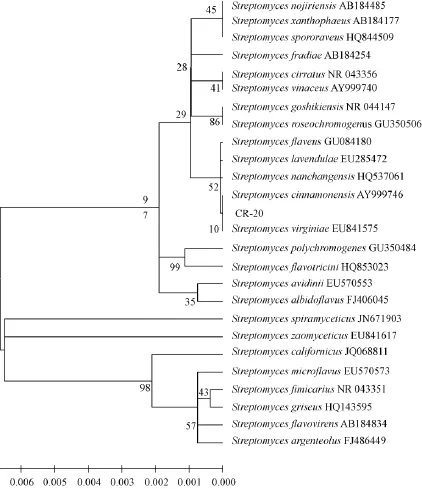
图3 基于16S rDNA的菌株CR20与相关菌株的系统发育树
3 小结和讨论
植物内生放线菌是一类新的生防微生物资源,在植物病虫害的防治中具有很大的应用潜力。内生放线菌作为内生菌的重要类群,是较新的研究领域,链霉菌属 (Streptomyces)少部分为稀有放线菌。从42株内生放线菌中筛选出一株有价值的生防菌株CR20,经鉴定初步确定为弗吉尼亚链霉菌(Streptomyces virginiae)。在利用内生菌对柑橘青绿霉病菌的防治研究上,李辉等[7]从广东果园土壤中分离获得了一株吸水类群链霉菌 (Streptomyces hygroscopicus),试验结果表明,该菌株对柑橘绿霉病菌具有较强的拮抗活性。弗吉尼亚链霉菌作为拮抗菌株用于对病原菌的抑制前人也已有报道。如Hala M.Rifaat等[8]从埃及土壤中分离获得弗吉尼亚链霉菌的HM3菌株,其对多种革兰氏阴性和阳性细菌、酵母菌、真菌有较高的杀菌活性。卞光凯等[9]从红豆杉根际土壤中分离获得了一株弗吉尼亚链霉菌,研究表明,该菌株对植物病原菌可可球二孢菌具有明显的抑菌活性。本研究所分离获得的弗吉尼亚链霉菌菌株CR20对柑橘青绿霉病菌均具有较强的拮抗作用,其实际防效虽不及化学农药咪鲜胺,但可考虑通过对菌株进行改良或发酵条件进行优化等,提高该菌株的实际应用效果。另外,本研究用于分离菌株的材料为柑橘根部样品,所用分离培养基为单一的高氏合成1号培养基,这可能在很大程度上限制了对具有更好拮抗活性的微生物资源的筛选获得。因此,在今后的研究中,应充分利用黄岩老柑橘产区的资源优势,采用多种分离培养基及培养策略以筛选获得具有更好活性的生防菌株。
[1] 虞轶俊,陈道茂,陈卫民.新编柑橘病虫害防治手册[M].上海:上海科学技术出版社,2001.
[2] El-Ghaouth A,Smilanick J L,Brown G E,et al.Control of decay of apple and citrus fruits in semicommercial tests with Candidasaitoana and 2-deoxy-D-glucose [J]. Biological Control,2001,20:96-101.
[3] Karabulut O A,Baykal N.Biological control of postharvest diseases of peaches and nectarines by yeasts [J].Phytopathology,2003,151:130-134.
[4] 阮继生,黄英.放线菌快速鉴定与系统分类[M].北京:科学出版社,2011.
[5] 谭庆伟,杜丹超,欧阳明安.天然海鱼共附生放线菌抑菌和抗病毒活性筛选研究 [J].激光生物学报,2010,19(6):824-831.
[6] 王凡,洪葵.CTAB法提取野野村菌基因组DNA[J].微生物学通报,2010,37(8):1211-1215.
[7] 李辉,耿鹏,郝卫宁,等.柑橘绿霉病菌拮抗放线菌MY-5的筛选与鉴定 [J].中国农学通报,2010,26(19):280-284.
[8] HalaM, Rifaat, Amany L K.Streptomycesvirginiae:Taxonomy,identification and biological activities[J].Arab J Biotech,2000,71:317-320.
[9] 卞光凯,缪倩,秦盛,等.一株拮抗可可球二孢菌放线菌的分离及鉴定[J].生物技术,2011,21(4):51-55.

