蓝藻对UV-B增强的响应及其紫外屏蔽物质的研究
王婉如,张昺林,张 楠,张东明,徐俊泉,薛林贵
兰州交通大学化学与生物工程学院,兰州730070
紫外辐射的波长范围是200~400 nm,通常分为三个波段,UV-A(320~400 nm),UV-B(280~320 nm)和UV-C(200~280 nm),UV-A辐射对生物无伤害作用,并且可以促进植物生长,但很少被臭氧吸收[1]。UV-C辐射就是通常所说的杀菌紫外线,它对生物体有强烈的影响,但能被极少量的臭氧层完全吸收,即便臭氧层厚度减少90%,UV-C辐射也不大可能到达地表[2]。UV-B大部分被臭氧层吸收,并且它到达地球表面的量受臭氧层变化的影响。臭氧层破坏导致一系列生态环境问题的发生,主要是由于UV-B辐射增强而导致生物体的损伤。Frederick实验证明,大气中的臭氧每减少1%,辐射到地面的UV-B就增加2%[3,4]。
目前,国际上关于紫外辐射对生物的个体、种群、群落以及生态系统的影响方面的研究十分活跃。我国在这一领域起步较晚,主要研究集中于高等植物(尤其是农作物)对UV-B增强的响应[5]。王勋陵先生关于UV-B与高等植物及陆生生态系统方面的研究作了详细报道[6]。相比之下,国内外对紫外辐射与浮游植物和水生生态系统之间的相关性研究较少。1999年,郑府相研究发现藻类及浮游生物经紫外辐射处理后生长缓慢、游动活力减弱[7]。李国才等研究表明,紫外辐照对蓝藻的光合色素均有一定的破坏作用[8]。南极冰藻在紫外增强后产生了明显的生理变化以适应环境的变化:酶活改变、色素组成有所改变、产生新的具有抗紫外辐射活性的物质等[9]。
蓝藻又称蓝细菌,是一类具有光合自养能力的原核生物,大约出现35亿年前的前寒武纪时期,然而那时的地球外部并没有形成臭氧层,在自然环境下,蓝细菌又常常暴露在高强度的紫外辐射下。因此推测蓝细菌曾面临更高强度的紫外线辐射,并且拥有一套完整的自我保护机制[10]。目前国内研究主要集中在UV-B辐射对蓝藻生物体生理变化的影响方面,对蓝藻中紫外吸收物质的研究报道较少。综上所述,本文综述了蓝藻对UV-B增强的响应及近年来国内外对蓝藻中紫外吸收物质及其应用方面的研究进展,以期对国内相关研究有所裨益。
1 UV-B增强对蓝藻的影响
近些年来,由于臭氧层变薄,紫外线辐射持续增强,国内外学者越来越关注于紫外线辐射对蓝藻的影响,尤其是UV-B辐射对蓝藻造成的损伤。尽管UV-B辐射占太阳光总能量的比例不到1%,但它具有极强的生物活性,能强烈诱导产生活性氧分子(ROS),能加速破坏脂类、蛋白质、DNA和其它相关生物分子[11]。研究表明,UV-B主要导致蓝藻生理特性的改变,包括阻碍光合作用进程、加速酶的失活、抑制蓝细菌的生长、改变细胞膜的渗透性、降低色素稳定性、阻碍营养物质的吸收、阻碍光敏色素或UV-B光接收体的信号传输等[12]。
1.1 形态及生物量变化
已有研究表明,阳光紫外辐射(UVR,280—400 nm)可降低浮游植物的光合作用速率[13],限制蓝藻的生长[14]并影响蓝藻的形态。紫外线对丝状蓝细菌Arthrospira platensis的形态与光合作用具有重要的影响,研究发现,经短期紫外辐射后,低细胞密度培养下的螺旋藻藻丝发生断裂,而经长期紫外线照射后,高细胞密度培养下的螺旋藻藻丝发生压缩和破裂,紫外灯照射移除以后,藻丝拉伸变长,排列变得松散,在UV辐射下,该蓝细菌的光合产氧受到严重抑制[15]。1998年 Suresh等[16]研究了3类蓝藻(Nostocsp.、Anabaenasp.和Scytonemasp.)对UV-B的敏感性,他们用5W·m-2的UV-B以2 J·d-1的剂量处理,实验结果表明,三种蓝藻生长速率分别下降28%、30%和36%,干重分别下降12%、27%和10%,叶绿素、蛋白质、淀粉含量也较对照有不同程度降低,这说明不同物种对UV-B的敏感性存在差异。也有研究表明,随着UV-B辐射强度的增大和处理时间的延长,螺旋藻的生物量逐渐减少,在UVB辐射强度为0.8 J/m2·s下处理6 h时,与对照相比,其生物量减少了31.88%,而在UV-B强度为0.6 J/m2·s下处理 6 h,其生物量减少了26.09%[17]。然而,在高强度的紫外线辐射下,蓝藻的存活率更有显著的下降,50 kJ·m-2的紫外线处理下Nostocsp.的存活率仅有40%[18]。此外,UV-B对蓝藻生长的抑制受温度影响,随着温度的降低UV-B对蓝藻的生长抑制逐渐增强[19]。
虽然不同种类的蓝藻受到紫外辐射所表现出的敏感性不同,但是高剂量的UV-B辐射对蓝藻的形态、生长率、生物量等有严重的损伤作用,这已经是不争的事实。
1.2 生理效应变化
UVR辐射对浮游生物的DNA、蛋白质以及其他主要生理过程均有一定的影响。DNA是遗传信息物质,它的改变会引起相应生物性状改变。UV-B对DNA最主要的损伤表现在嘧啶二聚体(环丁烷嘧啶二聚体约占75%,6-4光产物约占25%)的形成,嘧啶二聚体会阻碍DNA聚合酶和RNA聚合酶Ⅱ在DNA双螺旋上的推进,从而阻止了DNA的复制和转录[20]。UV-B辐射对蓝藻的基因表达也具有重要影响。1998年Campbell等[21]研究发现,1.3 W ·m-2的UV-B辐射处理15 min,Synechococcus PCC 7942野生型细胞psbA1基因表达没有变化,而psbA2和psbA3转录产物却急剧升高。Máté等[22]也发现在UV-B辐射下,psbA2 mRNA和psbA3 mRNA含量增加较为明显,psbA3 mRNA的含量上升更为显著。
UV-B辐射能够抑制蛋白质的合成,导致蛋白质降解、变构以及酶活性的丧失[18,23]。蓝藻光系统Ⅱ(PSⅡ)的D1蛋白对UV-B极为敏感,UV-B辐射导致D1蛋白的光降解,从而导致PSⅡ功能的下降[24,25]。UV-B辐射也会导致蓝藻Rubisco和ATP酶活性下降[26]。Lesser[27]报道,紫外线辐射能够抑制藻细胞的生长,引起叶绿素的降解和光合速率下降,并且进一步证实这些伤害性症状的出现是由于在紫外线辐射下藻细胞内产生对本身有伤害作用的活性氧(超氧阴离子自由基和过氧化氢)所致。紫外线辐射导致这些蛋白质的变构或降解,因而导致蓝藻的光合作用受阻,生长速率减弱,生物量下降。
1.3 光合作用变化
许多研究者发现,UV-B辐射对植物光合作用的抑制具体表现为光系统反应中心的破坏、电子传递链的抑制、羧化酶数量的减少和活性的降低[28,29]等。UV-B辐射对光合自养生物的光合器官有一定的损伤,导致光合作用释氧量和CO2固定速率下降,其淀粉、叶绿素和干重均有降低。蓝藻PSⅡ复合体主要由D1、D2蛋白组成,它们连接色素和辅因子,并将电子从水传递到质体醌,在UV-B辐射导致的PSⅡ活性降低过程中,常伴随着D1、D2蛋白的降解[21]。
在光合作用过程中,D1蛋白和少部分D2蛋白快速周转,它们通过PSⅡ复合体修复循环作用而不断合成新蛋白,用这种新蛋白质来取代降解蛋白,但是在UV-B辐射胁迫下,这种修复循环平衡被打破,D1蛋白的合成速率明显低于降解速率,D1蛋白出现了净损失,从而导致PSⅡ的功能下降。Campbell[21]发现光合作用量子产额发生光依赖性下降,也就是光抑制,光抑制的发生通常是由于捕获的光能超出PSⅡ反应中心的利用能力。科学家发现,在UV-B诱导下D1蛋白的编码基因发生改变,对UVB具有抗性的D1∶D2含量明显增高,这种编码基因转变是蓝藻适应UV-B胁迫的重要保护机制[21,22]。蒋明义等[30]发现叶绿素的漂白与MDA的产生是同时发生的。这表明光合色素的降解可能是膜脂过氧化作用引起的。并且,UV-B辐射也抑制了Hill反应,PSⅡ除向PSⅠ输送电子外,还连接了放氧系统,从水分子中取得电子。增强的UV-B辐射能明显抑制一些农作物(如大豆、小麦等)的Hill反应活力,降低Rubisco活性,抑制光合磷酸化作用,从而引起光合作用的降低[31]。
因此,科学家们总结出紫外线辐射对蓝藻的影响是多方面的,UV-B主要通过破坏PSⅡ反应中心、光系统之间的电子传递以及CO2固定、抑制Hill反应等各个方面来抑制蓝藻光合作用。
2 蓝藻对UV-B辐射的适应
2.1 通过合成和积累功能微生物色素的适应
藻类抵御UV-B辐射的一种有效方式就是增加细胞内吸收UV-B的化合物含量,这些化合物通常分布在细胞壁或分泌到其周围环境中,能够屏蔽和吸收紫外线辐射。然而这些物质有的是藻细胞所特有的,有些是受到UV-B辐射胁迫后诱导产生的,有些物质是蓝藻细胞本身能够合成的,但经UV-B辐射后该种物质含量会大量增加。有些蓝藻还可以直接通过垂直迁移的方式避开高强度的UV辐射[32]。
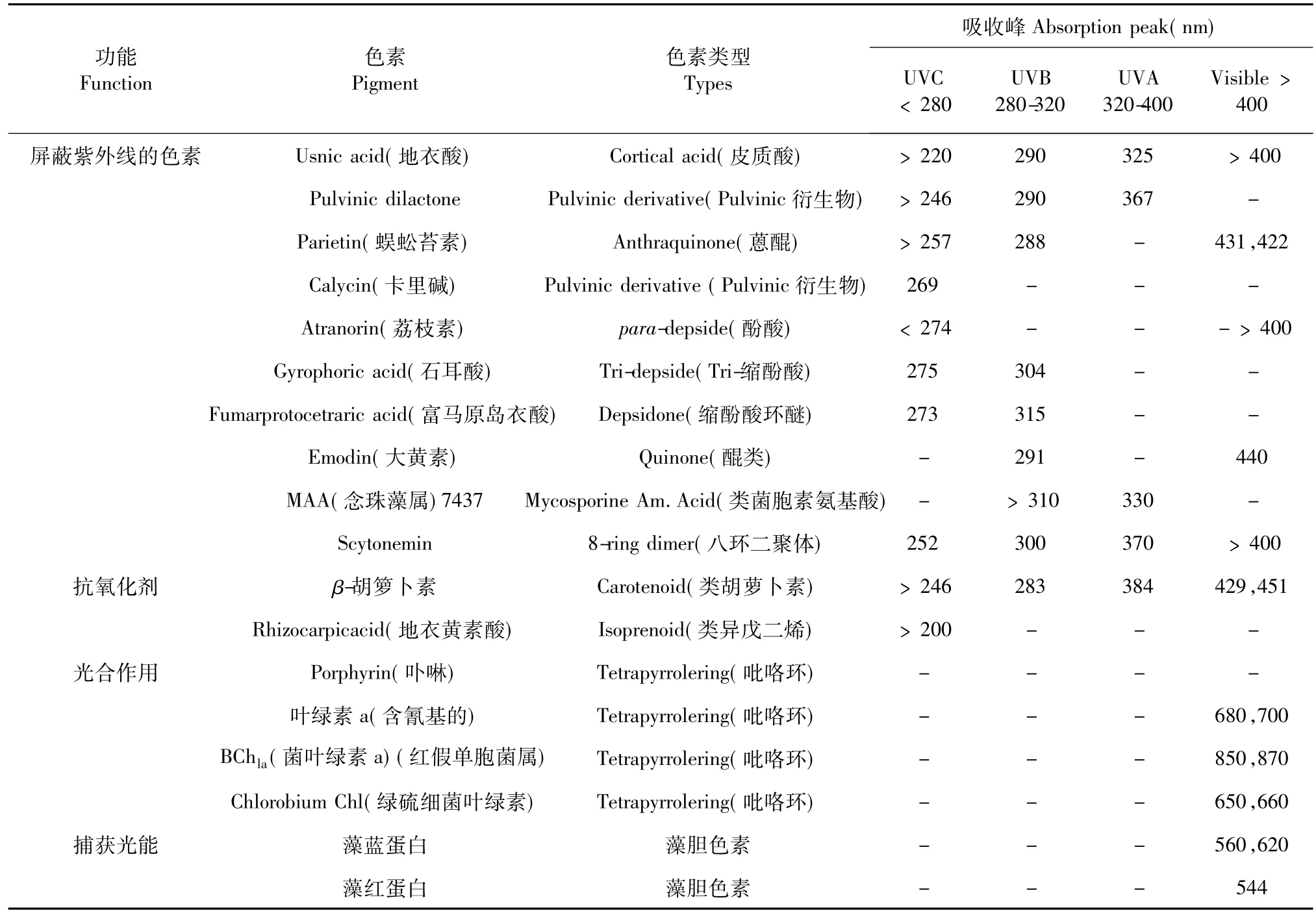
表1 极端南极陆地环境中功能微生物色素的最大吸收峰[33]Table 1 Absorption maxima for functional microbial pigments in extreme terrestrial Antarctic habitats
2.2 通过合成和积累紫外吸收物质的适应
紫外吸收物质通常是指能够吸收250~350 nm波长范围的高能有害紫外线的物质。太阳紫外线能量到达紫外吸收物质后通过光化学作用将紫外线吸收物质从基态激发到激发态,再由激发态回到基态,在这一过程中其所吸收的能量会通过发射低能量长波长的辐射(如红外线、可见光等)而消散,从而达到吸收太阳紫外线的目的。紫外吸收物质能作为UV-B辐射的过滤器而避免高能量光量子到达敏感部位,保护细胞的光合机构以及生物大分子DNA等免受紫外辐射损伤,同时,它也是羟自由基和过氧化氢自由基的有效猝灭剂[34,35]。蓝藻作为地球上最古老的光合自养生物,在进化过程中为了防止紫外线辐射损伤,能够产生大量紫外吸收物质作为屏蔽复合物对其起到保护作用。
2.2.1 光合色素
蓝藻的光合色素包括类胡萝卜素、叶绿素a和藻胆蛋白。UV-B辐射光大部分被藻细胞内的叶绿素和捕光色素复合体(主要是藻胆体)吸收,由此推断,蓝藻藻胆体和类囊体膜极易被紫外线辐射所伤害。
大量研究表明,在UV-B照射下蓝藻叶绿素a含量下降[16,36]。也有实验表明,叶绿素a含量不受UV-B影响,经辐射处理后其含量甚至还有所上升[37]。这可能是由于UV-B处理剂量不同或者是不同的蓝藻对UV-B的敏感性存在差异所导致的结果。目前还未发现叶绿素a是否真正对紫外线有屏蔽作用。
在蓝细菌中类胡萝卜素的含量较高,类胡萝卜素可与三线态叶绿素分子相互作用淬灭由UV-B诱导产生的活性氧,或以热量的形式耗散过量的激发能,从而起到减轻藻细胞受紫外线伤害的作用,因而被认为是一种UV保护色素,其含量在低剂量UV-B处理下一般有所上升[38]。为了抵消UV-B诱导产生的活性氧,在蓝藻M.aeruginosa 854中也观察到了类胡萝卜素的增多[39]。也有人报道了热带圭亚那地区的陆生蓝藻,由于受到紫外线辐射的影响出现了类胡萝卜素和叶绿素a的比值升高,这表明类胡萝卜素具有光保护和抗UVR的作用[12]。
藻胆蛋白主要包括藻蓝蛋白、藻红蛋白和别藻蓝蛋白,藻蓝蛋白是螺旋藻中重要的捕光色素蛋白,它以近乎100%的高效率把光能优先地传递给光系统Ⅱ[40],由于藻蓝蛋白本身的蛋白强烈吸收250 nm至300 nm的紫外光波,因而成为UV-B的主要攻击目标。UV-A也可能促进藻蓝蛋白的合成,因而使得在去除UV-B的UVR辐射处理条件下,蓝藻中具有较高的藻蓝蛋白含量[41]。在活细胞中,藻蓝蛋白既可以作为蛋白质存储单位,也可以作为抗氧化剂,使细胞在一定限度内免受光损伤[42]。许多研究结果已经证明,藻蓝蛋白不仅能清除过氧基、羟基、超氧化物基团,也能作为一种强效抗氧化剂抑制活性氧参与的脂质过氧化反应[43]。
2.2.2 MAAs
2.2.2.1 MAAs的结构
MAAs(mycosporine-like amino acids,类菌孢素氨基酸),是一类低分子(<400 Dk)水溶性色素复合物,其最大吸收波长在310~360nm[44,45],可以吸收紫外线。目前,MAAs化合物已经从很多生物中分离出来,如:真菌、蓝细菌、藻类、浮游植物、海洋无脊椎动物、浮游动物、鱼类及其他海洋生物等[46],其中只有真菌、蓝细菌、藻类和浮游植物可以自身合成MAAs化合物,而海洋无脊椎动物、浮游动物、鱼类及其他海洋生物等是通过食物摄入来达到体内的积累。目前已知的生物体含有MAAs的就有20余种,他们都对紫外辐射光具有吸收作用。不含MAAs或MAAs含量低的细胞对UV-B辐射的抵抗力比含高浓度MAAs的细胞低25%[47],细胞内MAAs含量与环境中的紫外辐射强度成正相关性。研究发现蓝藻含有大量的MAAs,可达到蓝藻干重的10%,它可以滤除十分之三的光子[48],能参与降低UVR的光照起保护作用,同时,也可以起到抗氧化剂作用[49]。目前,虽然有些MAAs结构已经确定(如表2),但大部分的化学结构还有待进一步确定。
2.2.2.2 MAAs的合成
MAAs在蓝藻细胞内的累积受到UV-B的影响,UV-B辐射使蓝藻MAAs含量增加。Sinha[53]等研究了UV-B对三种丝状具有异形胞节球藻属的影响,发现UV-B辐射诱导合成MAAs(shinorine和prophyra-334)。UV-B辐射下也可诱导一些蓝藻产生本身不具有的某些MAAs[54]。UV-B诱导MAAs的合成也受到其他因素的影响,盐胁迫可以促进UV-B诱导合成MAAs[55],含氮培养下MAAs的合成含量远远高于无氮培养[56]。MAAs主要存在于细胞内分散于细胞质中,在细胞壁外也有少量分布,目前只有在Nostoc commune发现MAAs位于细胞外,MAAs和寡糖通过共价作用连接到细胞肽聚糖鞘上。然而MAAs合成的途径目前还不清楚,可能合成途径(如图1)与草莽酸合成前部分有关。
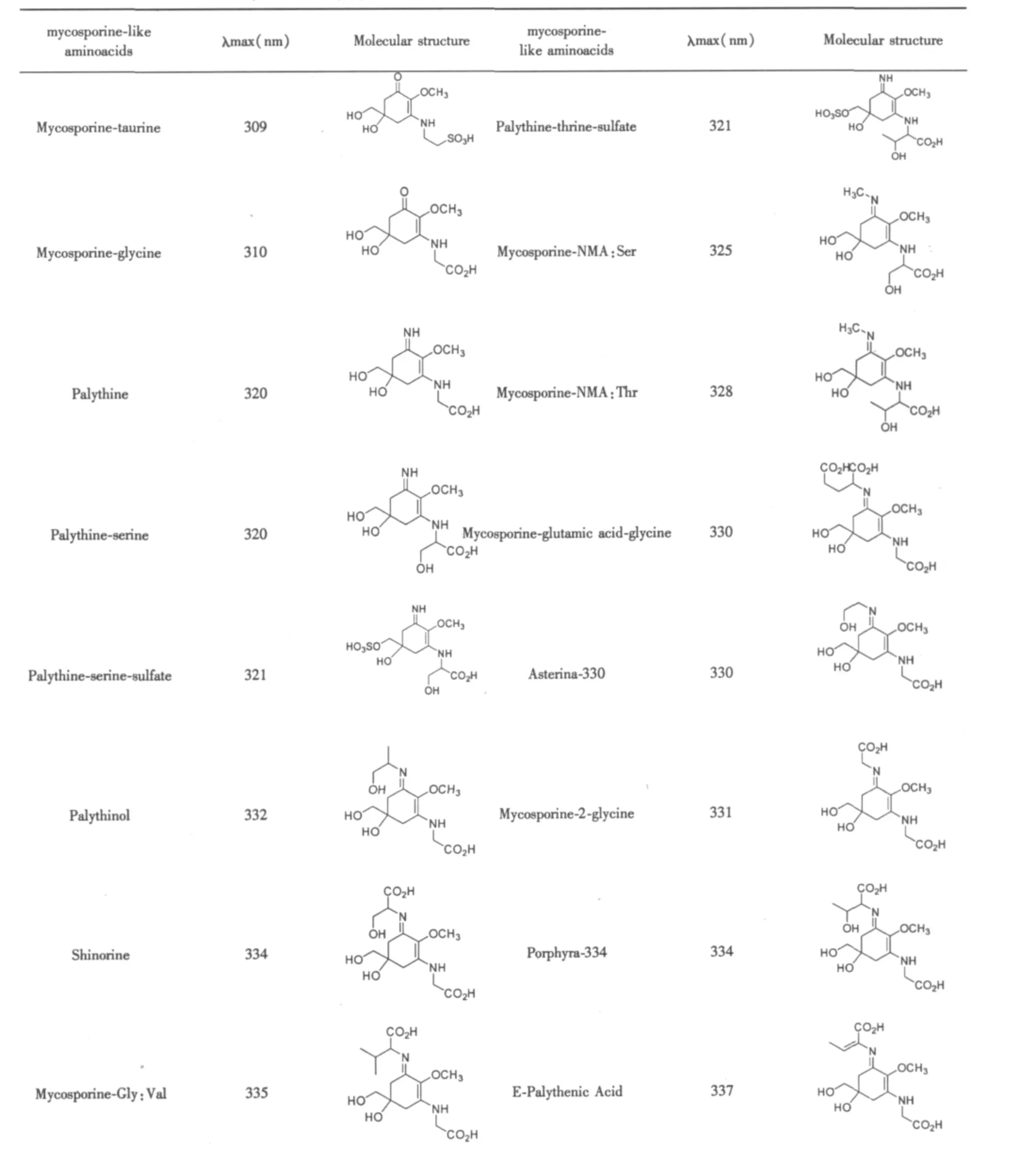
表2 MAAs的结构式与最大光吸收波长[50,51](粗体标出的MAAs由蓝藻合成)[52]Table 2 Molecular structure,absorption maximum and extinction coefficient of some mycosporine-like amino acids(MAAs)(MAAs indicated in bold are synthesized by cyanobacteria)

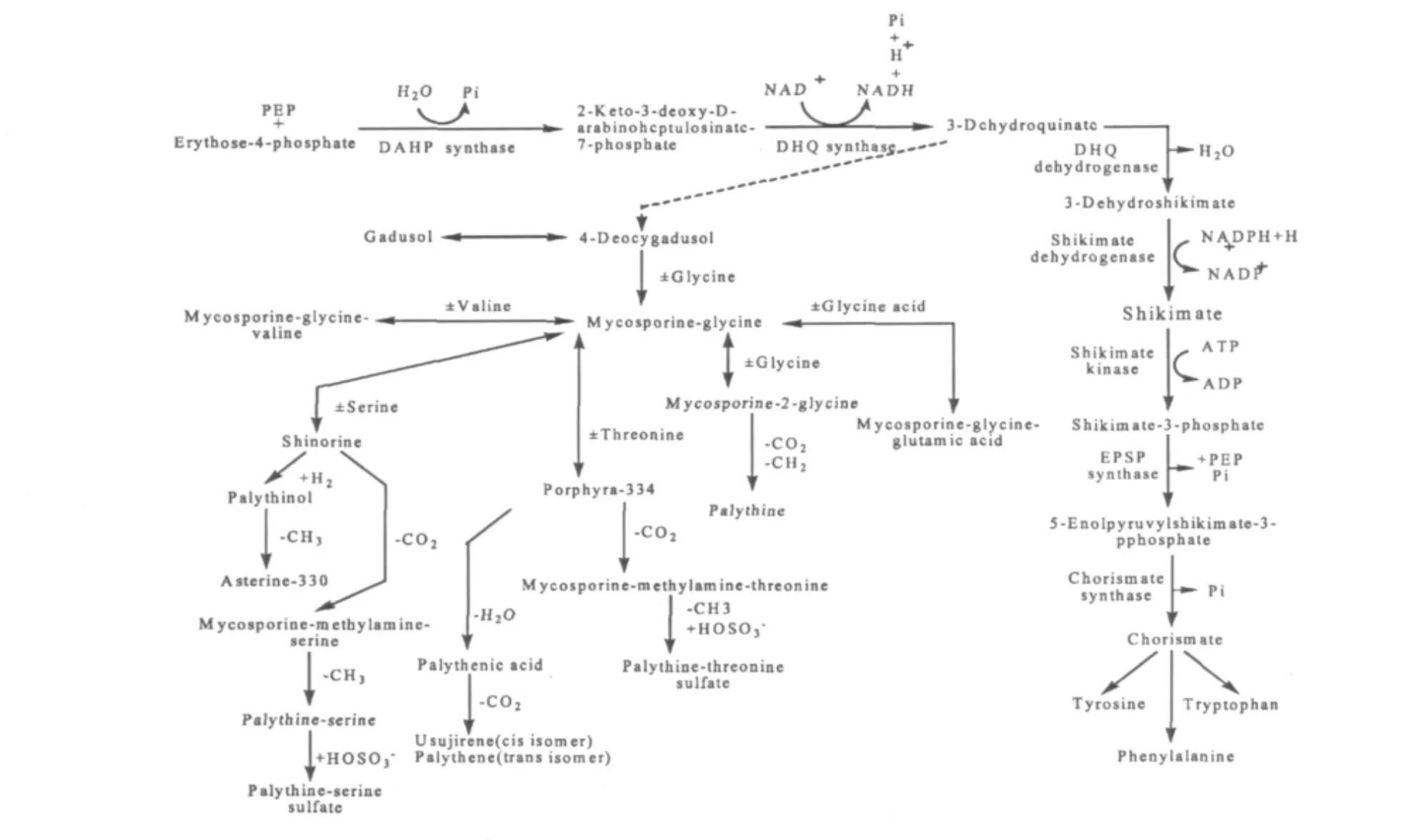
图1 MAAs的草莽酸生物合成途径途和可能的生物或化学转化[54]Fig.1 Biosynthetic routes for the formation of MAAs via the shikimate pathway and their feasible chemical and/or biochemical conversion.
2.2.2.3 MAAs的应用
MAAs由于它的生物功能特殊,可作为食品添加剂,抑制食品由紫外线辐射产生的光降解和光氧化作用[57],以保证食品的安全性,避免有毒物质的产生,在食品安全方面有极大的应用前景。
MAAs是一种被动防晒物质,也可用于非生物物质如塑料、橡胶等高分子聚合物的保护剂[58],以延长其使用寿命,增强其机械强度和加工性能。
除了能吸收紫外辐射外,一些MAAs同样具有抗氧化功能,也可作为兼容溶质[59]。有学者认为还有清除自由基的作用,减少因紫外辐射产生的活性氧对生物体的影响[49],因此,MAAs还可以作为日用化妆品的添加成分,起到保护皮肤、防止紫外损伤、抗衰老的特殊功效。
2.2.3 Scytonemin
2.2.3.1 Scytonemin的结构与合成
伪枝藻素(Scytonemin)存在于蓝藻外鞘中,是蓝藻中特有的一种脂溶性棕黄色二聚体色素,最大吸收峰在386 nm,在252、278 nm以及300 nm也有吸收峰[60],入射到蓝藻细胞中的90%的UV-A都被位于藻胶鞘中的 Scytonemin所吸收[61],UV-A和PRA可诱导 Scytonemin的大量合成,有些蓝藻的Scytonemin含量可高达细胞干重的5%[62]。也有研究表明在UV-B辐射胁迫下Scytonemin并不具有UV-B屏蔽作用[63],Scytonemin合成主要受UV-A影响。Scytonemin在各种逆境胁迫中(温度、高强度UV)具有很强的稳定性,一旦合成就能长期稳定存在。
Scytonemin的UV-B诱导与MAAs一样,也受其它环境因素的影响。研究表明,UV-A和渗透压胁迫也能诱导Scytonemin的合成,只是Scytonemin的合成没有UV-B诱导的明显,且形成的含量有限,但它们可以明显促进UV-B诱导Scytonemin合成,然而其它环境胁迫(如氧胁迫、强光、高温等)均不能诱导Scytonemin的形成[64]。Scytonemin的结构如图2、图3所示,然而其合成途径还不清楚,有待进一步研究。

图2 Scytomemin化学结构图[65]Fig.2 Structure of Scytonemin
图3 Scytonemin三维结构图[66]Fig.3 3D structure of Scytonemin
2.2.3.2 Scytonemin的应用
Stevenson[67]等发现Scytonemin是Polo样激酶1的首个小分子抑制剂,并期望它可以作为化学成分进一步应用到药物化学中,去开发更有效和更具选择性的抗恶性细胞增生药剂的特异药效基团。因此Scytonemin有望应用到医药工业造福人类。
然而,Edwards[68]等发现Scytonemin抗紫外辐射的能力比MAAs更强,约90%以上的UV-A被Scytonemin阻挡,因此它可用作化妆品中防晒霜的添加剂或其他材料的紫外保护物质,即涂料、塑料等高分子聚合物的紫外保护剂。
综上所述,MAAs和Scytonemin的研究将为食品工业、医药工业、生物天然高分子、人工合成高分子和精细化工等行业的产品质量提供一个科学的安全保证,并增强了其应用价值。它将为人类和生命免遭紫外线损伤提供一个可靠的屏障,将会产生巨大的社会效益和经济效益。
3 展望
蓝藻是一种极具开发潜力的资源,近年来,国内外对藻类的研究利用主要是从生物学、生命保健学、食品工程学等学科的角度出发,将藻类制成保健食品或者化肥等,但并没有对其他的活性成分进行研究并加以利用。蓝藻中紫外吸收物质的发现是近年来通过很多科学家的努力探索研究才公诸于世的,是目前研究的热点问题,有很广阔的发展前景。然而,目前国外对于海藻中天然紫外线吸收物质的研究还处于起步阶段,大多数研究主要集中在环境条件如光照、盐度、温度等对藻类积累紫外吸收物质的影响及紫外线对其的诱导等方面,国内相关方面的研究更是鲜见报道。然而,目前的室内实验大多采用强于自然太阳光的UV-B来处理样品,UV-B与可见光的比例远远大于自然条件,因此实验结果往往夸大了UV-B的伤害,而忽略了蓝藻自身的适应能力。大量实验表明,对紫外线适应力强的蓝藻,均含有高浓度的MAAs和Scytonemin。
综上所述,蓝藻是具有广阔开发利用前景的生物质资源,然而蓝藻中紫外吸收物质的提取和纯化工艺还是研究的重点和难点。随着生物化工技术的不断完善和发展,利用生物技术提供的各种可能性,攻克各种技术难题,大规模地利用蓝藻生产天然有用物质的工作将会取得重大进展,蓝藻作为一种生物质资源进行应用将具有非常巨大的开发应用潜力。
1 Xie CG,et al.人工模拟UV-B辐射对铜绿微囊藻(Microcystis aeruginosa)生长的影响.J Lake Sci,2011,23:223-229.
2 Madronich S,et al.Changes in biologically active ultraviolet radiation reaching the Earth s surface.J Photoch Photobio B,1998,46:5-19.
3 Zhai XL,Shi BL.紫外线辐射对生物的影响.Agric Tech,2000,20:44-45.
4 Frederick JE,et al.Annual and interannual behavior of solar ultraviolet irradiance revealed by broadband measurements. Photochem photobio,2000,72(4):48-96.
5 Jiang HB,Qiu BS.蓝藻对UV-B增强的响应与适应.Bull Botany,2005,25:1259-1268.
6 Wang XL(王勋陵).Research advances about effects of enhanced UV-B radiation on plants and ecosystems.Bull Botany,2002,22:670-681.
7 Zheng FX.紫外线对生物生长发育及生理过程的影响.J Guizhou Meteorol,1999,23(5):22-23.
8 Li GC,Song LR.紫外线辐射对蓝藻细胞活性的影响.Microbio,2002,22(4):31-33.
9 Miao JL,et al.UV-B对南极冰藻中抗辐射物质的诱导作用.High Tech Lett,2002,12(4):96-98.
10 Rajeshwar P Sinha,et al.Responses of aquatic algae and cyanobacteria to solar UV-B.Plant Ecology,2001,154:221-236.
11 Vincent W F Roy.Solar ultraviolet-B radiation and aquatic primary production:damage,protection,and recovery.Environ,1993:1-12.
12 Pang SH,et al.蓝细菌对紫外辐射的响应.Food Sci Tech,2010,35(9):41-45.
13 Bühlmann B,et al.The influence of longwave ultraviolet radiation(UV-A)on the photosynthetic activity(14C-assimilation)of phytoplankton.J Plankton Res,1987,9:935-943.
14 Quesada A,VincentW F.Strategies of adaptation by antarctic cyanobacteria to ultraviolet radiation.Eur J Phycol,1997,32: 335-342.
15 Wu H,et al.Effects of solar UV radiation on morphology and photosynthesis of filamentous cyanobacterium Arthrospira platensis.Appl EnvironMicrobiol,2005,71:5004-5013.
16 Suresh BG,et al.UVB-induced reduction in biomass and overall productivity of cyanobacteria.Biochem Biophy Res. Commun,1998,244:138-142.
17 Xue LG,et al.螺旋藻对增强的UV-B胁迫的响应.Acta Hydrobio Sin,2007,31:201-207.
18 Araoz R,et al.Translation activiy under ultraviolet radiation and temperature stress in the cyanobacterium Nostocsp.J Photochem Photobiol B,1998,47:115-120.
19 Jan CR,Vincent WF.Temperature dependence of UV radiation effects on Antarctic cyanobacteria Phormidium murrayi.J Phycol,1998,34:118-125.
20 Doanhue BA,et al.Transcript cleavage by RNA Polymerase (2)arrested by acyclobutane dimmer in the DNA template. Proc Natl Acad Sci,1994,91:8502-8506.
21 Campbell D,et al.The cyanobacterium Synechococcusresists UV-B by exchanging photosystem Ⅱ reaction-center D1proteins.Proc Natl Acad Sci,1998,95:364-369.
22 MáTé Z,et al.UV-B induced differential transcription of psb A genes encoding the D1protein of photosystemⅡin the cya-nobacterium Synechocystis 6803.J Biol Chem,1998,273: 17439-17444.
23 Quaite FE,et al.Action spectrum for DNA damage in alfalfa lowers predicted impact of ozone depletion.Nature,1992,358:576-578.
24 Kolli B,et al.Ultraviolet-B induced damage to photosystemⅡin intact filaments of Spirulina platensis.Nature,1998,53: 369-377.
25 Friso G,et al.Degradation of photosystemⅡreaction center D1polypeptide induced by UVB radiation isolated thylakoids. Identification and characterization of C-and N-terminal breakdown products.Biochim Biophys Acta,1994,1184:78-84.
26 Pinto ME,et al.Effects of UV-B radiation on growth,photosynthesis,UV-B-absorbing compounds and NADP-malic enzyme in bean(Phaseolus vulgarisL.)grown under different nitrogen conditions.J Photochem,1999,48:200-209.
27 Lesser MP.Elevated temperature and ultraviolet radiation cause oxidative stress and inhibit photosynthese in symbiotic dinoflagellates.Limnology and Oceanography,1996,41:271-283.
28 Smith RC et al.Ozone depletion:Ultraviolet radiation and phytoplankton biology in antarctic waters.Science,1992,255: 952-959.
29 Jordan BR,et al.Changes in mRNA levels and polypeptide subunits of ribulose 1,5-bisphophate carbonylase in response to supplementary ultraviolet-B radiation.Plant Cell Environ,1992,15:91-98.
30 Jiang MY.渗透胁迫下水稻幼苗中叶绿素降解的活性氧损伤作用.Bull Botany,1994,36:289-295.
31 Strid A,et al.Effects of supplementary UV-B radiation on photosynthesis in Pisum sativum.Biochim Biophys Acta,1990,102:260-268.
32 Castenholz RW,Garcia-ppchel F.Cyanobacterial responses to UV radiation.WHITTON B A,POTTS M,eds.The ecology of cyanobacteria:their diversity in time and space.Kluwer Academic Publishers,2000:591-611.
33 Wynn-Williams DD,et al.Pigmentation as a survival strategy for ancient and modern photosynthetic Microbes under high ultraviolet stress on planetary surfaces.Int J of Astrobio,2002:1:39-49.
34 Fedina I,et al.Effect of pretreatment of barley seedlings with different salts on the level of UV-B induced and UV-B absorbing compounds.Environm Experim Botany,2006,56: 225-230.
35 Lau TSL,et al.Ambient levels of UV-B in Hawaii combined with nutrient deficiency decrease photosynthesis in near-isogenic maize lines varying in leaf flavonoids:Flavonoids decrease photoinhibition in plants exposed to UV-B.Photosynthetica,2006,44:394-403.
36 Rajapopal S,et al.Effect of ultraviolet-B radiation on intact cells of the cyanobacterium Spirulina platensis:charcterization of the alteration in the thylakiod membranes.J Photochem Photobiol B,2000,54:61-66.
37 Monika ES,et al.UV-B-induced synthesis of photoprotective pigments and extracellular polysaccharides in the terrestrial cyanobacterium Nostoc commune.J Bac Mar,1997,179: 1940-1945.
38 Gotz T,et al.Protection of photosynthesis against ultraviolet-B radiation by carotenoids in transformants of the cyanobacterium Synechococcus PCC 7942.Plant Physiol,1999,120: 599-604.
39 Jiang H,Qiu B.Photosynthetic adaptation of a bloomforming cyanobacterium Microcystis aeruginosa(cyanophyceae)to prolonged UV-B exposure.J Phycol,2005,41:983-992.
40 Glazer AN.A macromolecular complex optimized for light energy transfer.Biochim Biophys Acta,1984,768:29-51.
41 Wu HY,et al.静止和充气培养条件下短期紫外辐射对钝顶螺旋藻光化学效率的影响.Acta Hydrobio Sin,2005,29: 673-677.
42 Zhuo SZ,Zhang H.螺旋藻中藻蓝蛋白的生理功能及其提取纯化研究进展.Food Sci Tech,2008,1:150-152.
43 Bhat VB,Madyastha KM.Scavenging of Peroxynitrite by Phycocyanin and Phycocyanobilin from Spirulina platensis: Protection against Oxidative Damage to DNA.Biochem Biophys Res Comm,2001,285:262-266.
44 Cockell CS,Knowland J.Ultraviolet radiation screening compounds.Biol Rev,1999,74:311-345.
45 Shick JM,Dunlap WC.Mycosporine-like amino acids and related gadusols:biosynthesis,accumulation and UV-protective function sinaquatic organisms.Ann Rev Physiol,2002,64: 223-262.
46 Chen XL,et al.水生生物的紫外光防护剂——类菌胞素氨基酸.Chin Bull Botany,2006,23:78-86.
47 Garcia-Pichel F,et al.Evidence regarding the UV sunscreen role of amycosporine-like compound in the cyanobacterium Gloeocapsa sp Appl.Environ Microbiol,1993,59:170-176.
48 Garcia-Pichel F,Castenholz RW.Occurrence of UV-absorbing,mycosporine-like compounds among cyanobacterial isolates and an estimate of their screening capacity.Appl Environ Microbiol,1993,59:163-169.
49 Dunlap WC.Yamamoto Y.Small-molecule antioxidants in marine organisms:antioxidant activity of mycosporine-glycine.Comp Biochem Physiol.Biochem Mol Biol.1995,112: 105-114.
50 Sinha RP,et al.Database on mycosporines and mycosporinelike amino acids(MAAs)in fungi,cyanobacteria,macroalgae,phytoplankton and animals.Photochem.Photobiol B,2007,89:29-35.
51 Rozema J.The role of UV-B radiation in aquatic and terrestrial ecosystems-an experimental and functional analysis of the evolution of UV-absorbing compounds.J Photochem Photobiol B,2002,66:2-12.
52 Böhm GA.Structure of a novel oligosaccharide-mycosporineamino acid ultraviolet A/B sunscreen pigment from the terrestrial cyanobacterium Nostoc commune.J Biol Chem,1995: 8536-8539.
53 Sinha RP.UV-B-induced synthesis of mycosporine-like amino acids in three strains of Nodularia(cyanobacteria).Photochem Photobiol B Biol,2003,71:51-58.
54 Singh SP.Mycosporine-like amino acids(MAAs)profile of a rice-field cyanobacterium Anabaena doliolum as influenced by PAR and UVR.Planta,2008,229:225-233.
55 Portwich A,Garcia Pichel F.Ultraviolet and osmotic stresses induce and regulate the synthesis of mycosporines in the the cyanobacterium Chlorogloeopsis PCC 6912.Arch Microbiol,1999,172:187-192.
56 Singh SP.Role of various growth media on shinorine(mycosporine-like amino acid)concentration and photosynthetic yield in Anabaena variabilis PCC 7937 World.Microbiol Biotechnol,2008,24:3111-3115.
57 Garcia-Pichel F,Castenholz RW.Characterization and biological implications of scytonemin,a cyanobacteria Sheath pigment.Phycol,1991,27:395-409.
58 Dunlap WC,Shick JM.UV radiation absorbing mycosporine-Like amino acids in coralreef organisms.Biochemical and Environmental perspective.Phycol,1998,34:18-30.
59 Suh HJ,et al.Mycosporine-glycine protects Biological systems against photodynamic damage by quenching single to xygen with ahigheciency.Photochem Photobiol.2003,78: 109-113.
60 Sinha RP.Biochemical and spectroscopic characterization of the cyanobacterium Lyngbya sp.inhabiting mango(Mangifera indica)trees:presence of an ultraviolet-absorbing pigment,scytonemin.Acta Protozool,1999,38:291-298.
61 Garcia-Pichel F,Castenholz RW.Characterization and biological implications of scytonemin,a cyanobacterial sheath pigment.J Phycol,1991,27:395-409.
62 Ca Stenhol ZRW.Multiple strategies for UV tolerance in cyanobacteria.Spectrum,1997,10:10-16.
63 Ehling-Schulz M,et al.UV-B induced synthesis of photoprotective pigments and extracellular polysaccharides in the terrestrial cyanobacterium Nostoc commune.Bacteriol,1997,179:1940-1945.
64 Dillon JG.Effect of environmental factors on the synthesis of scytonemin a UV-screening pigment,in a cyanobaterium (Chroococcidiopsissp.).Arch Microbiol,2002,177:322-331.
65 Bultel-Poncē V.New pigments from the terrestrial cyanobacterium Scytonema sp.collected on the Mitaraka Inselberg,French Guyana.Nat Prod,2004,67:678-681.
66 Proteau PJ.The structure of scytonemin,an ultraviolet sunscreen pigment from the sheaths of cyanobacteria.Birkhäuser Verlag Basel,1993,825-829.
67 Christopher S,et al.The Identification and Characterization of the Marine Natural Product Scytonemin as a Novel Antiproliferative Pharmacophore.Americ Society for Pharm and Experim Therap JPET,2002,303:858-866.
68 Edwards HGM,Moody CD.Raman spectroscopic analysis of cyanobacterial colonization of hydromagnesite,a putative martian extremophile.Icarus,2005.

