α-N-乙酰半乳糖胺酶的表达及活性检测
林毅刚, 夏 钢
(华东师范大学 脑功能基因组学教育部重点实验室、上海市脑功能基因组学重点实验室,上海 200062)
α-N-乙酰半乳糖胺酶的表达及活性检测
林毅刚, 夏 钢
(华东师范大学 脑功能基因组学教育部重点实验室、上海市脑功能基因组学重点实验室,上海 200062)
为了建立新型α-N-乙酰半乳糖胺酶的筛选、检测方法,实验中提取脑膜金黄杆菌的基因组DNA,以此为模板PCR扩增出α-N-乙酰半乳糖胺酶(A4).将A4克隆至pET-24a载体,转化Bl21表达菌株进行蛋白表达.使用亲和层析方法纯化His-A4酶,选择显色底物验证酶活性.同时,改进了传统的ELISA方法,直接将红细胞膜包被于ELISA检测平板中,以红细胞膜表面抗原作为直接底物,用ELISA方法检测酶活性.此研究建立了新型ELISA实验方法,以此方法验证了A4酶的活性,证明了此酶能够有效降低红细胞表面抗原抗体反应,且具有浓度和时间依赖性.
α-N-乙酰半乳糖胺酶; 重组蛋白; 蛋白纯化; ELISA方法
ELISA method
0 引 言
1900年Landsteiner发表论文[1],阐述了人类红细胞表面ABO血型抗原并根据红细胞表面抗原的差异,将人血划分为A、B、AB和O4种血型.1980年 Watkins等3位科学家分别阐述了红细胞表面ABO抗原的碳水化合物结构[2].暴露于红细胞表面的寡糖链上糖基的种类和顺序决定了红细胞表面的抗原.红细胞先在表面合成抗原H,若将乙酰半乳糖胺基连接在抗原H肽链中的半乳糖上,这就形成了抗原A,相应的红细胞称为A型红细胞;同理,若半乳糖被连接至同样位置,成为抗原B,这样就形成了B型红细胞;若红细胞的表面既有抗原A又有抗原B,则形成AB型红细胞.
在输血治疗中,由于红细胞表面抗原与血清中抗体的存在,因此如果接收到相同血型血液的输血,不会发生意外.但如果错误输血,抗原抗体发生凝集,可造成红细胞裂解,产生急性血管内溶血性输血反应,从而可能致人死亡[3].而O型红血液中红细胞不含A、B抗原,所以可以安全地输给A、B、AB与O型的受血者,因此O型血往往被称为“通用血”(universal red blood cells,RBCs)[4].通用型血可以极大减少因ABO血型不合所致输血反应,明显提高输血安全性,因此将其它血型转换成O型通用血具有重要意义.
使用酶切方法将红细胞表面最外端的糖苷切除,从而消除抗原抗体反应是一种常用的制备通用红细胞的方法.研究证明[5]α-半乳糖苷酶作用于两个半乳糖之间的糖苷键,将B抗原最外端的半乳糖切除;α-N-乙酰半乳糖胺酶则作用于半乳糖和N-乙酰半乳糖胺之间的糖苷键,将A抗原最外端的N-乙酰半乳糖胺切除.这两种酶可以分别作为B→O和A→O血型转变的工具酶.
Goldstein等人在1982年最早提出酶解法制备通用型RBC[6],并从咖啡豆克隆了α-半乳糖苷酶基因,在临床二期检验成功,实现B→O血型改造[7].相比之下,A→O血型改造进展缓慢,Goldstein认为原因是[8]自然界的α-N-乙酰半乳糖胺酶的数量比α-半乳糖胺酶少.
目前,科学家已从植物、海洋生物和动物脏器中发现了可以用以切除红细胞表面抗原最外端糖苷的多种糖苷酶,它们的酶切效率、作用温度和作用pH各不相同.Liu[4]等人在最近的研究中,报导了他们从2 500多种细菌与真菌中筛选出一种糖苷酶,具有α-N-乙酰半乳糖胺酶的活性,可以比较高效地切除A型红细胞表面的N-乙酰半乳糖胺.此酶反应条件温和,活性是已报道的α-N-乙酰半乳糖胺酶中最好的.在美国国立生物技术信息中心(NCBI)数据库中基因登录号为AM039444[4](为方便表示,此基因在本文内代称为A4).经过晶体结构的测定,此酶的空间结构已非常清楚,因此选取此酶用于实验.此基因全长为1 335 bp,编码的蛋白分子量约为50.5 kD,试验酶解A型表面抗原.
本文从细菌基因组DNA中PCR扩增出目的基因,在表达菌株中诱导蛋白表达,用ELISA方法检测,α-N-乙酰半乳糖胺酶确实可以除去A型红细胞表面最外侧的糖苷,为进一步大量制备α-N-乙酰半乳糖胺酶用于制备通用型血奠定基础.
1 材料与方法
1.1 材料
1.1.1 质粒与菌株
克隆载体pET24a购自美国Novagen公司,大肠杆菌DH5α和大肠杆菌BL21(DE3)购自天根生化科技(北京)有限公司.
A4基因所在的细菌名为Chryseobacterium meningosepticum,ATCC登录号为33958,购自美国ATCC菌株库.
1.1.2 主要试剂
HindIII与SacI购自美国NEB公司,Taq酶、dNTP、DL2000 Marker和1 kbp Marker等常用试剂购于Takara大连有限公司.其它所有用到的化学试剂均为市售分析纯.对硝基苯酚-N-乙酰-α-半乳糖胺(PNP-A)购自美国Sigma公司.抗A血型定型试剂购自上海血液所.二抗羊抗鼠与TMB显色液,5×SDS蛋白上样缓冲液和BCA试剂购自上海碧云天生物技术研究所,蛋白Marker PageRuler Prestained Protein Ladder购自美国Fermentas公司.镍柱(Ni2+agarose)购自美国Bio-Rad公司.质粒小提试剂盒,胶回收试剂盒,PCR回收试剂盒均购自上海捷瑞生物有限公司.PCR引物由Invitrogen上海分公司合成.
1.2 实验方法
1.2.1 PCR扩增序列与原核表达载体的构建
根据NCBI报道的序列编号AM039444(A4),设计引物扩增序列,具体序列为

PCR程序:94℃预变性5 min,94℃变性30 s,56℃退火30 min,72℃延伸1 min30 s,36个循环,最后72℃延伸10 min.
DNA回收试剂盒回收A4基因片段与克隆载体pET24a,均经过SacI和HindIII双酶切,将目的片段与载体片段用DNA回收试剂盒回收,将目的片段与载体连接,构建成质粒pET24a-A4,构建的pET24a-A4用SacI与HindIII双酶切鉴定,并经过测序验证序列的正确性.
1.2.2 重组蛋白的诱导
将正确的重组质粒pET24a-A4,转入BL21(DE3)后,挑取单克隆到5 mL含50μg/mL卡那霉素(Kana)的LB培养液中,37℃过夜摇菌.次日以1∶100接种于5 mL LB液体培养基中(50μg/mL Kana),于37℃摇床振荡培养,至吸光度(OD 值)达0.6左右,加入IPTG至终浓度为0.4 mmol/L.20℃下进行诱导表达,4 h后取1 mL培养物于8 000 r/min下离心5 min,菌液重悬于PBS缓冲液中,用超声破碎仪以20 kHz的频率超声破碎菌液,12 000 r/min离心5 min,加入5×SDS蛋白上样缓冲液,沸水煮沸5 min,收集含重组表达的蛋白备用.取10μL上述处理好的重组蛋白样品进行SDS-PAGE电泳分离鉴定,考马斯亮蓝染色.
1.2.3 重组蛋白的纯化
挑取单克隆到20 mL含50μg/mL Kana的LB培养液中,37℃过夜培养.次日以1∶100接种于1 L LB液体培养基中(50μg/mL Kana),过夜诱导表达蛋白(具体步骤同重组蛋白的诱导).8 000 r/min离心5 min,收集全部菌液,PBS漂洗两遍后,加入30 mL PBS超声破碎细菌,12 000 r/min 4℃离心20 min,取上清,参照Bio-Rad实验操作手册,上清与Ni+亲和层析柱结合,用全自动快速蛋白液相层析系统仪器纯化蛋白.
具体步骤 5 mmol/L咪唑缓冲液10 mL平衡整个系统(1 mL体积镍柱);上样30 mL上清溶液;10 mmol/L咪唑缓冲液10 mL洗去非特异结合蛋白;咪唑缓冲液浓度逐步提高,从10 mmol/L至250 mmol/L洗脱目的蛋白;最后用1 mol/L咪唑缓冲液10 mL洗脱全部蛋白.收集所有流出液以备SDS-PAGE检测.
1.2.4 酶活性测定
α-N-乙酰半乳糖胺酶对底物对硝基苯酚-N-乙酰-α-半乳糖胺(PNP-A)有专一性,能够特异性酶解该底物,水解后的显色基团对硝基苯酚将显出黄颜色,通过此方法证实酶有活性.以显色反应的进行程度作为酶活性的判断标志.在酶反应过程中通过连续观测吸收值ΔOD400/t,对酶解效率进行测定,计算其Kcatobserve,以评价酶活性.
测定PNP标准曲线 标准曲线横坐标为PNP-A的浓度(μmol/L),纵坐标为OD值,通过此曲线,可从OD值的读数计算出酶作用于底物后反应生成的产物浓度.
取200μL A4酶溶液(200μmol/L,酶浓度过量),加入等体积PNP-A溶液,使底物终浓度分别为2.5、5、10和20μmol/L.充分反应后,读取在400 nm的光吸收值.根据数值,以浓度对OD值作图,得到PNP-A标准曲线,以计算对硝基苯酚的摩尔消光系数(ε)(浓度为1 mol/L时的吸光系数).
Kcatobserve测定 200μL0.2μmol/L的A4酶溶液,加入PNP-A,终浓度为50μmol/L,立即开始毎10 s读取一次OD400,得到产物生成曲线,计算反应初期线性阶段的斜率K(OD/t),按照如下公式计算Kcatobserve=K×ε/(A4酶摩尔浓度).
1.2.5 ELISA鉴定
取5 mL A型红细胞,用75 mmol/L的氯化钾低渗液溶胀处理,3次低渗溶液洗涤离心,再经3次生理盐水洗涤离心后,得到较纯净的细胞膜悬浊液.将破碎的红细胞膜悬浊液用PBS稀释至相当于107个红细胞/mL,加入96孔ELISA酶标板100μL/孔,室温包被2 h,用PBS洗板5次;加入用PBS稀释的1%BSA100μL/孔,室温封闭1 h,PBS洗板5次;加入100μL纯化的A4酶,毎孔100μL,终浓度分别为3.3、10、33和100μg/mL,37℃放置过夜,PBS洗板5次;将1%BSA稀释10倍的抗A血型定型试剂加入酶标板,37℃孵育1 h,PBS洗板5次;二抗羊抗鼠IgG用1%BSA稀释3 000倍加入酶标板,37℃孵育1 h,PBS洗板5次;充分清洗二抗残余,毎孔加入TMB显色液50μL/孔,室温避光孵育5 min;毎孔加入2 mol/L H2SO4,50μL/孔,终止显色反应;读取450 nm的光吸收值.
2 结 果
2.1 pET24a-A4重组质粒的构建与鉴定
以细菌基因组DNA为模板,利用A4基因上游引物A4-F和下游引物A4-R进行PCR,PCR产物经琼脂糖凝胶电泳分离,在1 000 bp上方可见约1 350 bp的扩增产物(见图1a);扩增的基因片段经测序鉴定后,阅读框完整,与报道的A4基因一致,说明扩增出A4基因.将构建了的重组质粒pET24a-A4,转化至大肠杆菌DH5α后,挑取单克隆提质粒后,经SacI和HindIII双酶切验证,在琼脂糖凝胶电泳图中可见一条约1 350 bp的目的基因条带与一条约5 000 bp的载体条带(见图1b),与预期一致,经测序后证明A4基因插入在SacI和HindIII两个酶切位点之间,pET24a-A4重组质粒构建成功.

图1 pET24a-A4重组质粒的构建(单位:bp)Fig.1 Construction of pET24a-A4 plasmid(Unit:bp)
2.2 重组融合蛋白的诱导表达
将质粒pET24a-A4转入表达菌株BL21(DE3)进行诱导表达,表达后的菌体进行超声破碎,离心后分别收集上清与沉淀,10%的SDS-PAGE电泳分析,经考马斯亮蓝染色及脱色后,与未诱导的pET24a-A4相比,在55 kD的下方处可见一条明显的增粗的新生蛋白条带(见图2),与预期分子量52 kD相符.目的蛋白主要存在于上清中,部分在沉淀中.

图2 A4蛋白诱导表达(单位:kD)Fig.2 Expression of His-A4(Unit:kD)
2.3 A4蛋白的纯化分析
pET24a-A4质粒经诱导后,目的蛋白与带His-tag标签可形成融合蛋白,His-tag可与镍柱结合,通过亲和层析方法纯化蛋白.对成功诱导的菌株进行大量培养诱导后,将菌体超声破碎后,蛋白溶于上清PBS中,取上清过镍柱纯化蛋白,经SDS-PAGE分离与考马斯亮蓝染色分析.纯化后的A4蛋白为单一的蛋白条带(见图3),杂带较少,且与诱导表达的蛋白大小一致,说明纯化效果很好.经BCA方法测定,蛋白浓度为4.2 mg/mL.

图3 A4蛋白纯化(单位:kD)Fig.3 Purification of His-A4 protein(Unit:kD)
2.4 重组蛋白对底物PNP-A的活性测定
将纯化后的蛋白样品进行活性检测.实验中,为了测定PNP-A浓度与对应OD400值的关系,先用40μmol/L的初始浓度,按2倍做倍比稀释,做20、10、5和2.5μmol/L4个浓度梯度,绘制PNP-A的标准曲线.
被检His-A4蛋白浓度稀释至0.2μmol/L进行测定(见图4),测得10 s的反应速率为酶反应的初速度,即Δt为10 s,斜率为0.005ΔOD/t,根据PNP标准曲线可计算出产物生成速率为0.242 1μmol·L-1·s-1,计算酶动力得Kcatobserve=Δ[PNP-A]/(Δt×A4酶摩尔浓度)=1.159 s-1.
2.5 ELISA方法检测用酶处理过的红细胞与抗A定型试剂反应
红细胞破碎后离心得到的红细胞膜,预先包埋在酶标板底部,摸索建立新颖的ELISA方法对纯化过后的酶进行活性检测,用酶处理A型血液的红细胞,α-N-乙酰半乳糖胺酶能酶解A型红细胞表面的抗原.实验证明,当A型红细胞膜没有用酶处理时,与抗A定型试剂反应效果较强,OD值较高,而酶解过后A型细胞表面抗原就会减少,与抗A定型试剂反应就会变弱.不同酶浓度对红细胞的影响不同,随着酶浓度的增高3.3、10、33和100μg/mL,OD450值就越低(见图5),说明酶能切除细胞表面的抗原,抗原抗体反应降低.同样随着酶作用的时间延长,抗原抗体反应就越弱(见图6),说明酶确实能够切除A型红细胞最外的糖苷,与抗A定型试剂反应降低.
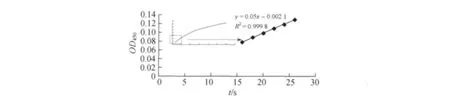
图4 酶反应的初速度计算Fig.4 Calculation of the initial velocity of enzyme reaction

图5 不同酶浓度下的ELISA检测效果Fig.5 Detection effects of ELISA at different concentrations of enzyme

图6 不同时间下的ELISA检测效果Fig.6 Detection effects of ELISA at different times of enzyme
3 讨 论
血液短缺是世界性难题,各国科学家都在努力攻克.如果能将其它血型的血液转换为O型血,并且输血安全有效,那么这通用型血液具有巨大的经济与临床价值[9,10],同时对镰刀贫血症、地中海贫血症和白血病等需要反复输血以维持生命的病人使用通用型血,也是理想的输血治疗方案[6,11,12].
本实验克隆了以往报道的活性最好的α-N-乙酰半乳糖胺酶基因,并在细菌中进行过表达所编码的蛋白,在IPTG终浓度为1 mmol/L,37℃过夜诱导的条件下,SDS-PAGE分析后得到52 kD的蛋白,绝大部分蛋白形成包涵体在沉淀中.因此重新优化了诱导条件,在IPTG终浓度为0.4 mmol/L,低温20℃过夜诱导的条件下,经SDS-PAGE分析后,可知重组A4酶经低温诱导可表达,产生活性蛋白,易于纯化,为大规模纯化提供实验依据.
为了证明α-N-乙酰半乳糖胺酶可消除A型红细胞表面的抗原,本文改进了传统的ELISA方法,直接将红细胞膜包被于ELISA检测平板中,以红细胞膜表面抗原作为直接底物,用ELISA方法对改造过后的A型红细胞进行抗体凝集检测.本实验中建立的新型ELISA方法验证了A4酶的活性,证明了此酶能够有效降低红细胞表面抗原抗体反应,且具有浓度和时间依赖性.此优化的ELISA方法的另一个优点在于更加接近实际情况,酶直接作用于红细胞膜,不但可以检测酶活性,更可以体外模拟A型血转化为O型血,为以后相关检测提供了检测方法.
我国科学家已经使用α-半乳糖苷酶实现B型血向O型血的转化[13],但是A型血的转化仍然不顺利,主要难题是酶活性较低.目前科研人员在自然界中继续寻找α-N-乙酰半乳糖胺酶,期望得到活性更高的酶.另一方面,针对已经报道的酶,运用基因重组等分子生物学手段过量表达蛋白的工作也在积极进行.但是现有的α-N-乙酰半乳糖胺酶催化效率仍然比较低,无法用于实际生产.由此可见,利用糖苷酶酶解红细胞表面抗原上的糖分子,从而得到通用红细胞是一项具有巨大潜力的技术方案,前人已经在这方面做出了不懈的努力,但是至今人们没有得到理想的工具酶.本实验室构建的A4基因,已成功改变了A型红细胞表面抗原的结构,下一步拟进行通过体外进化技术——DNA改组(DNA shuffling)[14],提高酶活性.期望得到活性高的酶,为大规模血型转化奠定基础.
[1] LANDSTEINER K.Agglutination phenomena of normal human blood[J].Wiener Klinische Wochenschrift,2001,113(20-21):768-769.
[2] WATKINS W M.Biochemistry and genetics of the ABO,Lewis,and P blood group systems[J].Advances in Human Genetics,1980(10):1-136,379-385.
[3] 章扬培,季守平,杨军.血型转变[J].中国实验血液学杂志,1998,6(2):91-97.
[4] LIU Q P,SULZENBACHER G,YUAN H,et al.Bacterial glycosidases for the production of universal red blood cells[J].Nature Biotechnology,2007,25(4):454-464.
[5] BAEHR R V.Biotechnology of blood[J].Biotechnology,1991,19:1-463.
[6] GOLDSTEIN J,SIVIGLIA G,HURST R,et al.Group B erythrocytes enzymatically converted to group O survive normally in A,B,and O individuals[J].Science,1982,215(4529):168-170.
[7] KRUSKALL M S,AUBUCHON J P,ANTHONY K Y,et al.Transfusion to blood group A and O patients of group B RBCs that have been enzymatically converted to group O[J].Transfusion,2000,40(11):1290-1298.
[8] ZHU A,GOLDSTEIN J.Cloning and functional expression of a cDNA encoding coffee bean alpha-galactosidase[J].Gene,1994,140(2):227-231.
[9] OLSSON M L,CLAUSEN H.Modifying the red cell surface:towards an ABO-universal blood supply[J].British Journal of Haematology,2008,140(1):3-12.
[10] DANIELS G,WITHERS S G.Towards universal red blood cells[J].Nature Biotechnology,2007,25(4):427-428.
[11] LENNY L L,GOLDSTEIN J.The production of group O cells[J].Biotechnology,1991,19:75-100.
[12] LAVECCHIO J A,DUNNE A D,EDGE A S.Enzymatic removal of alpha-galactosyl epitopes from porcine endothelial cells diminishes the cytotoxic effect of natural antibodies[J].Transplantation,1995,60(8):841-847.
[13] 杨军,宫锋,季守平.B→O血型转变工具酶α-半乳糖苷酶cDNA克隆及表达[J].中国生物化学与分子生物学报,2000,16(4):438-442.
[14] STEMMER W P.Rapid evolution of a protein in vitro by DNA shuffling[J].Nature,1994,370(6488):389-391.
Overexpression and characterization of a bacterial α-N-acetylgalactosaminidase
LIN Yi-gang, XIA Gang
(Key Laboratory of Brain Functional Genomics,Ministry of Education,Shanghai Key Laboratory of Brain Functional Genomics,East China Normal University,Shanghai 200062,China)
The coding sequence of alpha-N-acetylgalactosaminidase(A4)was amplified from genomic DNA of Chryseobacterium meningosepticumand subcloned into pET24a,which was then transformed into BL21(DE3)for overexpression of His-A4.The overexpressed His-A4 enzyme was purified by using affinity chromatography and its activity was comparable to that previously reported by using a conventional method with an artificial substrate.To better measure the activity ofα-N-acetylgalactosaminidase in real application,we established a novel method in which we directly used the surface antigen of red blood cell as substrate and applied ELISA to the detection of un-cleaved antigen.The activity of His-A4 was evaluated in the new ELISA method and was demonstrated to be able to decrease the blood cell surface antigen-antibody reaction in concentration-and time-dependent manner.
α-N-acetylgalactosaminidase; recombination protein; protein purification;
Q55
A
10.3969/j.issn.1000-5641.2012.04.009
1000-5641(2012)04-0067-08
2011-05
教育部重点项目(V200704)
林毅刚,男,硕士研究生.
夏钢,男,研究员.E-mail:gxia@brain.ecnu.edu.cn.

