不同培养体系对脐血造血干细胞粒细胞-巨噬细胞集落形成单位的影响
刘晋辉 何吉 陈舒 秦斐 王芳 徐罡 朱发明 吕杭军 严力行
造血干细胞移植是治疗血液系统恶性肿瘤、实体瘤、免疫缺陷病、遗传性疾病的有效手段。近年来脐血造血干细胞因其来源广泛、HLA配合程度要求低、患者移植后移植物抗宿主病发生率低等优点,已广泛应用于临床造血干细胞移植中。评价脐血造血干细胞质量的一个重要指标是集落培养效果[1],但是目前国内脐血造血干细胞库所采用的各种培养体系在集落培养效果方面存在差异[2]。我们对比分析了脐血造血干细胞库常用的H4534和GF-H4434两种甲基纤维素培养基生成细胞集落的能力,以期为脐血造血干细胞培养体系选择提供参考依据。
1 材料与方法
1.1 脐血来源
选择2009年1月至2011年1月足月分娩的565名产妇作为志愿者。在志愿者知情同意下,用三联采血袋从其脐静脉采集脐血。
1.2 主要仪器设备和试剂
二氧化碳培养箱(HEPA class 100,Thermo,美国),倒置相差显微镜(TE2000-U,NIKON,日本),台式离心机(MACH 1.6,SORVALL,美国)。
RPMI 1640培养液(Gibco®,美国),淋巴细胞分离液(1.077 g/mL,上海华精生物高科技有限公司),H4534甲基纤维素培养基(MethoCult®,加拿大)和GF-H4434甲基纤维素培养基(MethoCult®,加拿大)。GF-H4434系在H4534基础上添加促红细胞生成素(erythropoietin,EPO)。
1.3 方法
1.3.1 标本制备
采用两步法获得浓缩的造血干细胞[3]。用3 mL RPMI 1640培养液洗涤转移袋中脐血干细胞,加至4 mL淋巴细胞分离液表面,以800 g离心20 min,吸取白膜层,用RPMI 1640培养液洗涤2次,调节细胞浓度至1×106/L备测。
1.3.2 集落培养
根据不同培养条件分为H4534组(n=251)和GF-H4434组(n=314)。H4534组采用H4534甲基纤维素培养基,该培养基含1.0%甲基纤维素、30%FBS、1% 牛血清蛋白、10 μmol 2-巯基乙醇、2 mol L-谷氨酰胺、10 ng/mL IL-3、10 ng/mL 粒细胞-巨噬细胞集落刺激因子和50 ng/mL干细胞因子,可生成含有粒细胞-巨噬细胞集落形成单位(granulocytemacrophage colony forming unit,CFU-GM)、巨噬细胞集落形成单位(macrophage colony forming unit,CFU-M)和粒细胞集落形成单位(granulocyte colony forming unit,CFU-G)的细胞集落。GF-H4434组为GF-H4434甲基纤维素培养基,其培养体系成分在H4534体系的基础上增加3 U/mL EPO,可生成含有CFU-GM、红细胞爆裂型集落形成单位(erythrocytic burst-forming unit,BFU-E)和粒细胞-红细胞-巨噬细胞-单核细胞集落形成单位(granulocyte-erythrocyte-macrophage-monocyte colony forming unit,CFU-GEMM)的细胞集落。
将100μL脐血干细胞分别加入0.9 mL细胞培养基,混匀后加入六孔培养板,37℃、5%二氧化碳饱和湿度条件下培养14~16 d。
1.3.3 观察指标
培养后将六孔板放于倒置显微镜下观察细胞生长情况、形态学特征,并计数各种集落数,以含40个细胞及以上的细胞团为1个集落,记录每个脐血培养皿中的各类集落数量。因CFU-M和CFU-G集落为CFU-GM的同一类集落,观察结果时以CFU-GM统一计数。
1.4 统计学分析
采用SPSS 19.0软件包。数据分析用u检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组样本中CD34+细胞百分率和有核细胞总数比较
两组样本中CD34+细胞百分率和有核细胞总数检测结果差异无统计学意义(P>0.05),具有可比性,见表1。
表1 两组标本中CD34+细胞百分率和有核细胞总数检测结果比较±s)
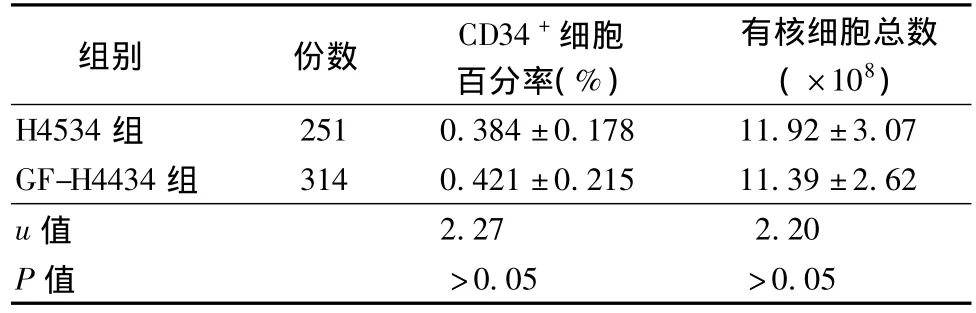
表1 两组标本中CD34+细胞百分率和有核细胞总数检测结果比较±s)
组别 份数 CD34+细胞百分率(%)有核细胞总数(×108)H4534组251 0.384±0.178 11.92±3.07 GF-H4434组 314 0.421±0.215 11.39±2.62 u值2.27 2.20 P值 >0.05 >0.05
2.2 两组样本培养后集落形成比较
H4534组培养后观察到 CFU-GM、CFU-M和CFU-G细胞集落,集落特征见图1。GF-H4434组培养后观察到CFU-GM、BFU-E和CFU-GEMM细胞集落,集落特征见图2。
H4534组CFU-GM集落数为(55.71±28.24)/105;GF-H4434组CFU-GM集落数为(66.28±31.99)/105,BFU-E 集落数为(64.89 ±34.95)/105,CFU-GEMM集落数为(2.53±2.08)/105。两组CFU-GM集落数差异有统计学意义(u=4.16,P<0.05),提示GF-H4434培养基更利于CFU-GM形成。

图1 脐血在H4534培养基中形成的集落特征
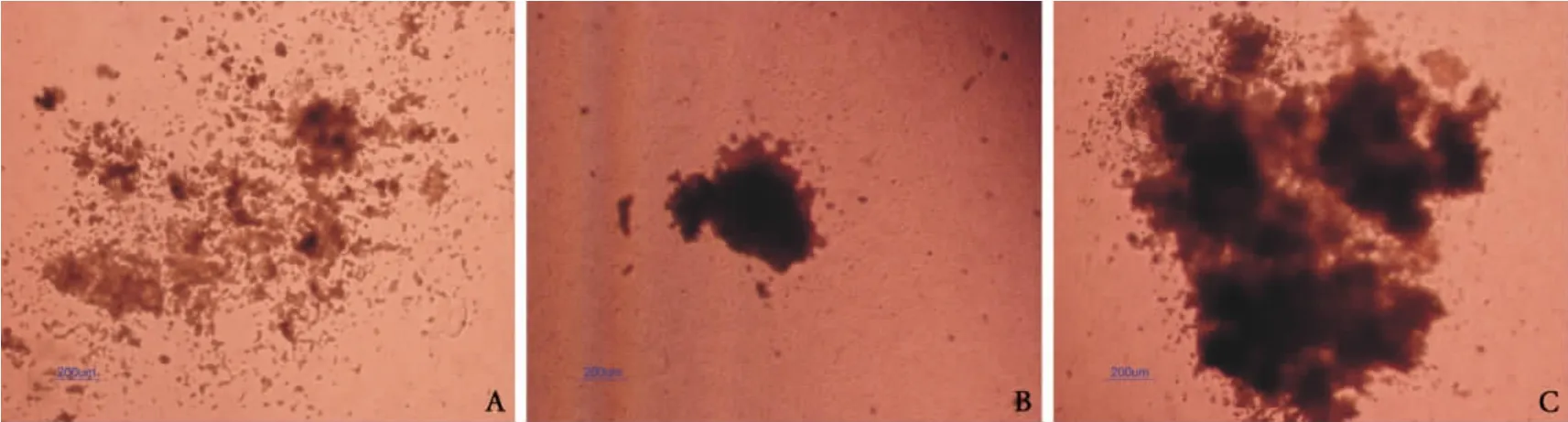
图2 脐血在GF-H4434培养基中形成的集落特征(×40)
3 讨论
脐血的质量是确保脐血移植安全的重要因素,脐血复苏后需要达到较高的有核细胞数量和细胞活性及无病原体感染、无潜在遗传疾病要求,以便为脐血移植成功和提高受者存活率奠定良好的基础。目前临床评价脐血质量的指标主要有HLA匹配程度、有核细胞总数、CD34+细胞数量以及CFU-GM集落数量,这些指标是决定脐血移植后受者造血和免疫重建成功与否的重要因素。
体外半固体细胞培养集落形成单位是评价造血前体细胞增殖分化能力的重要指标,在适宜的细胞因子诱导下,不同的定向祖细胞可产生相应的集落,如 CFU-GM、BFU-E、CFU-GEMM 等。CFU-GM 数量能够较好反映脐血造血干细胞的增殖分化能力,与造血重建的快慢和植入率[4]有关,但是目前国内外脐血造血干细胞库报道的脐血造血干细胞中CFU-GM的数量差异较大,其原因可能是选择的培养体系、操作方法存在不同之故[5-9]。由于H4534和GF-H4434这两种培养基都为商品化试剂盒,且试剂各项指标经过严格的验证,其实验结果在不同实验室具有可比性;目前,该两种试剂为国内外许多脐血库所采用,因此我们选择了H4534和GF-H4434两种培养体系做比较,观察CFU-GM集落数形成的差异,以期为不同的脐血库选择培养基时提供参考。
脐血中CD34+细胞数与CFU-GM集落数量有明显的相关性[10],本研究为了排除两组样本因CD34+细胞含量不同导致的培养后集落数量的差异,我们检测分析了两组脐血中CD34+细胞和有核细胞总数,结果两组间CD34+细胞百分率和有核细胞总数差异均无统计学意义。本研究结果显示添加了EPO的GF-H4434培养基比H4534培养基产生CFU-GM的数量更多,提示两种培养体系下产生的CFU-GM集落数差异主要由于培养体系不同而致。
EPO是造血分化中的主要刺激因子,能促进造血干细胞向原始红细胞分化,加速幼红细胞的分裂、增殖,促进血红蛋白的合成和红细胞诱导分化。GF-H4434培养体系中除CFU-GM集落外还产生了BFU-E和CFU-GEMM等细胞集落。CFU-GM是粒单细胞集落形成单位,其数量多少反应了造血重建时粒单细胞形成能力,这关系着移植后中性粒细胞的植入效果。BFU-E是红细胞系造血祖细胞,其数量反应了红细胞系造血恢复的能力。CFU-GEMM具多系分化能力,包括向红细胞系、巨核细胞系、粒细胞系方向分化等,其数量多少反应了造血干细胞的多细胞系分化能力。这可能是EPO在刺激干细胞向红细胞系细胞分化的过程中与其他细胞因子相互作用的结果。EPO作用于造血前体细胞的胞内信号转导是多个通路交联、互补、形成网络的复杂传导过程[11],其机制有待进一步研究。
本实验结果提示GF-H4434培养基培养脐血产生的CFU-GM较多,而且能产生如 BFU-E和CFU-GEMM等集落,对脐血的造血重建能力有更为全面的反映,有助于临床对脐血造血能力的评估。因此,相比H4534而言,GF-H4434是一种更适合脐血干细胞培养的体系。
1 任汉云.脐血移植临床评价和主要问题探讨[J].中华血液学杂志,2006,27(11):791-792.
2 吴洁莹,廖灿,许遵鹏,等.广州脐血库造血干细胞保存及临床应用[J].中华生物医学工程杂志,2010,16(5):438-443.
3 刘晋辉,何吉,朱发明,等.1963份脐血造血干细胞的处理与保存[J].中国实验血液学杂志,2005,13(1):143-146.
4 Barker JN.Umbilical cord blood(UCB)transplantation:an alternative to the use of unrelated volunteer donors?[J].Hematology Am Soc Hematol Educ Program,2007:55-61.
5 刘颉,周淑芸,黄国栋,等.广东省胎盘脐带血库的质检分析[J]. 中国输血杂志,2004,17(6):430-433.
6 李茜,韩俊领,句凤华,等.天津市脐带血库质量管理体系的建立和实施[J].生物医学工程与临床,2004,8(2):109-112.
7 龙慧,马燕琳,龙志高,等.脐血库造血干/祖细胞的分离、保存和集落培养[J].中国现代医学杂志,2007,17(3):261-263,268.
8 刘会兰,孙自敏,汪健,等.脐血造血干/祖细胞体外扩增实验研究[J]. 白血病·淋巴瘤,2004,13(3):132-135.
9 Gaia S,Smedile A,OmedèP,et al.Feasibility and safety of G-CSF administration to induce bone marrow-derived cells mobilization in patients with end stage liver disease[J].JHepatol,2006,45(1):13-19.
10 Jansen EM,Hanks SG,Terry C,et al.Prediction of engraftment after autologous peripheral blood progenitor cell transplantation:CD34,colony-forming unit-granulocyte-macrophage,or both?[J].Transfusion,2007,47(5):817-823.
11葛全兴,陈垦,龙友明,等.EPO/EPOR及其信号转导机制研究进展[J].国际病理科学与临床杂志,2009,29(5):416-420.

