碘促进合成杂环醌类化合物
王 维 孔凯明 李郁锦
(浙江工业大学化学工程与材料学院,杭州 310014)
研究与开发
碘促进合成杂环醌类化合物
王 维 孔凯明 李郁锦*
(浙江工业大学化学工程与材料学院,杭州 310014)
采用分子碘促进合成杂环醌类化合物,首先以二氯萘醌和乙二胺反应得到杂环醌类化合物,研究了工艺条件对反应的影响。结果表明,二氯萘醌、乙二胺、碘和NaOH的摩尔比为1:1.2:1.1:1,溶剂为氯仿时收率大于80%,目标产物结构经核磁共振仪确认。虽然二氯萘醌和1,6-己二胺反应时并没有得到预期的产物,但是该方法具有操作方法简单,大大缩减操作步骤,反应条件温和,收率较高等优点。
杂环醌类化合物;二氯萘醌;乙二胺;碘;合成
杂环类化合物在工业、农业、医药和日用化工方面有重要的用途,其中含氮杂环在其中占有重要地位,常用于染料与中间体、化学制药、感光材料、生物化学、生化工程、高分子及复合材料专业基础有机化学中,无论是在理论研究还是实际应用方面都具有很大的意义,已愈来愈引起人们的极大重视[1-3]。
醌类杂环合成工艺的报道较少,并且反应步骤繁琐、收率较低,大大限制了其工业化进程[4-7]。本研究利用碘促进二氯萘醌和二胺反应,简单有效地合成了杂环醌类化合物。
1 实验部分
1.1 仪器与试剂
仪器:RE-52AA旋转蒸发仪;Bruker-AC-400(500 Hz)核磁共振仪(1H-NMR);薄层色谱(TLC),玻璃板,2.5 cm×7.5 cm,涂层厚度 250 μm,展开剂为石油醚和乙酸乙酯(体积比4:1)。
试剂:二氯萘醌,乙二胺(无水),1,2-环己二胺,邻苯二胺,1,2-丙二胺,1,6-己二胺,碘,氢氧化钠,氯仿,无水硫酸钠,均分析纯。
1.2 实验步骤
1.2.1 二氯萘醌和乙二胺合成杂环醌
将 5 mL 氯仿、1 mmol二氯萘醌(1)、1.2 mmol乙二胺(2)、1 mmol氢氧化钠和1.1 mmol碘依次加入到烧瓶中,室温下搅拌10 h,反应过程用TLC检测跟踪。反应式为:

反应结束后,用氯仿进行萃取,合并有机相,并且用无水硫酸钠干燥,静置过夜;过滤,滤液采用柱层析法进行分离,收率为93%。所得产品为黄褐色固体,1H-NMR(500 MHz,CDCl3):δ=3.50~3.53(m,2H),4.20~4.23(m,2H),5.65(s,1H),7.58~7.61(m,2H),8.16~8.22(m,2H)。
1.2.2 二氯萘醌和其他二胺合成杂环醌
将5 mL氯仿、1 mmol二氯萘醌、1.2 mmol其他二胺(1,2-丙二胺、邻苯二胺或1,2-环己二胺)、1 mmol氢氧化钠和1.1 mmol碘依次加入到烧瓶中,室温下搅拌10 h,反应过程用TLC检测跟踪。反应式为:

2a~2c分别为1,2-丙二胺、邻苯二胺、1,2-环己二胺时,所得产物分别为:

收率分别为80%、80%、87%。反应结束后,用氯仿进行萃取,合并有机相,并且用无水硫酸钠干燥,静置过夜;过滤,滤液采用柱层析法进行分离。

1.2.3 二氯萘醌和1,6-己二胺合成杂环醌
将5 mL氯仿、1 mmol二氯萘醌、1.2 mmol 1,6-己二胺、1 mmol氢氧化钠和1.1 mmol碘依次加入到烧瓶中,室温下搅拌10 h,反应过程用TLC检测跟踪。反应式为:
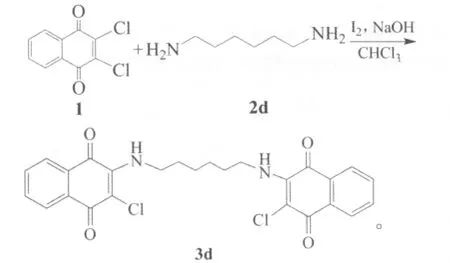
反应结束后,用氯仿进行萃取,合并有机相,并且用无水硫酸钠干燥,静置过夜;过滤,滤液采用柱层析法进行分离,收率为87%。3d:红色固体,1HNMR(CDCl3,500 MHz):δ=1.48~1.51(m,2H),1.73~1.76(m,2H),3.85~3.90(m,2H),6.09(s,1H),7.62~7.65(m,1H),7.72~7.75(m,1H),8.04~8.05(d,J=5,1H),8.15~8.17(d,J=10,1H)。
2 结果与讨论
以二氯萘醌(C10H4Cl2O2)和乙二胺(C2H8N2)反应为例(溶剂均为氯仿),反应物的配比、反应时间、碱的品种对收率的影响见表1。

表1 不同的碱和碘的量对反应的影响Tab 1 Effect of different base and I2ratio on the reaction
由表1可看出碘对反应的重要性,在反应体系中不加入碘收率明显很低;碱性增强收率也会提高,选择氢氧化钠作为合适的碱,同时由于二氯萘醌在氯仿中溶解度很好,因此选择氯仿作溶剂,所以优化反应的条件为二氯萘醌、乙二胺、I2、NaOH的摩尔比为1:1.2:1.1:1,氯仿作溶剂,反应时间为10 h时,收率较高。
3 结论
利用碘促进二氯萘醌和二胺反应合成醌类化合物,优化反应的条件为二氯萘醌、乙二胺、I2、NaOH的摩尔比为1:1.2:1.1:1,氯仿作溶剂,反应时间为10 h时,收率均在80%以上。该方法收率较高,简单可行,具备工业化条件。
[1]Heiner Eckert.Diversity Oriented Syntheses of Conventional Heterocycles by Smart Multi Component Reactions(MCRs)of the Last Decade[J].Molecules,2012,17:1074-1102.
[2]陈敏为.有机杂环化合物[M].北京:高等教育出版社,1985.
[3]彭司勋.药物化学进展[M].北京:化学工业出版社,2001.
[4]Kallmayer Hans Joerg,Seyfang Karlheinz.Quinone-amine reactions.XVI:synthesis and properties of 2-and/or 3-substituted benzoquinoxalinones[J].Archiv der Pharmazie(Weinheim,Germany),1986,319(1):52-60.
[5]M A Berghot.New activation method of chloroenaminone quinones for synthesis of polynuclear heterocyclic systems[J].Phosphorus,Sulfur and Silicon,2003,178:627-637.
[6]Soon Ok Kim,Jae Kyoung Park,Sa Mi Hong.Multicyclization reaction of 2,3-dichloro-1,4-naphthoquinone[J].Yakhak Hoeji,1995,39(2):118-130.
[7]Rodney W Purr,Jumes A Reiss.N-Substituted Enaminones from 3-Aminobutenoic Acids and 1,4-Naphthoquinones[J].Aust J Chem,1984,37:389-94.
Synthesis of Heterocyclic Anthraquinones Promoted by Iodine
Wang Wei,Kong Kaiming,Li Yujin
(College of Chemical Engineering and Material Science,Zhejiang University of Technology,Hangzhou 310014)
Heterocyclic anthraquinones were efficiently synthesized with excellent yields promoted by iodine using dichlone naphthoquinone and ethylenediamine as raw materials.The influence of process conditions on the reaction was discussed.The results showed that:the yield was more than 80%when the molar ratio of dichlone naphthoquinone,ethylenediamine,iodine and NaOH was 1:1.2:1.1:1 and chloroform as solvent.The target product structures were confirmed by NMR.Although the product was not produced by the reaction of dichlone naphthoquinone and 1,6-hexamethylenediamine,but the method had advantages of simple operation,greatly reduced operation steps,mild reaction conditions,higher yield,etc..
heterocyclic anthraquinones;dichlone naphthoquinone;ethylenediamine;iodine;synthesis
TQ254.18
ADOI10.3969/j.issn.1006-6829.2012.04.005
*通讯联系人。E-mail:lyjzjut@zjut.edu.cn
2012-05-17

