青蒿琥酯诱导食管癌Eca109细胞凋亡
刘 亮,左 静,左连富*,郭建文
(河北医科大学第四医院1.肿瘤研究所流式细胞室,河北石家庄050011;2.肿瘤内科,河北石家庄050011)
食管癌是我国较常见的恶性肿瘤,尤其是河北省的磁县,食管癌发病率及死亡率较高。抗肿瘤药物较大的不良反应是导致化疗效果下降的主要原因之一,寻找高效低毒的抗肿瘤药物,是肿瘤学研究者长期从事的工作。中药治疗肿瘤已具有几千年的历史,具有低毒、价廉等优点。青蒿琥酯 (Artesunate,Art)化学名为二氢青蒿素-1,2-α-2琥珀酸单酯,是具有倍半萜结构的抗疟药青蒿素的衍生物之一,研究发现,青蒿琥酯除了具有抗疟作用以外还具有抗肿瘤活性[1-2],但在食管癌中的研究较少。本实验主要研究青蒿琥酯诱导食管癌细胞凋亡的作用。
1 材料与方法
1.1 材料
1.1.1 细胞系来源:人食管癌细胞系Eca109细胞为本实验室传代培养。
1.1.2 主要实验仪器及试剂:Epics-XLⅡ型流式细胞仪 (Beckman-Coulter公司);BCL-2抗体(克隆号:sc-7480)及BAX抗体(克隆号:sc-7382)(Santa Cruz公司);青蒿琥酯(批号:ZA070802)(桂林南药有限公司);胎牛血清(杭州四季青公司)。
1.2 方法
1.2.1 药物干预实验:取对数生长期的Eca109细胞以1×106/mL接种至细胞培养瓶中,待细胞贴壁后,加入不同浓度的青蒿琥酯,使终浓度分别达到10、20、40 mg/L,对照组使用0.9%氯化钠代替青蒿琥酯,作用24 h后,收集细胞,PBS液洗涤2次,部分细胞70%乙醇固定放入4℃冰箱保存用于流式细胞术检测,部分细胞用于Western blot检测。每组实验重复3次。
1.2.2 流式细胞术检测细胞凋亡率及细胞周期:调整每份样品的细胞数为1×106/100μL,加入50 mg/L PI染液1 mL,在4℃冰箱中染色30 min,上机检测DNA含量。应用Expo 32 ADC软件对凋亡
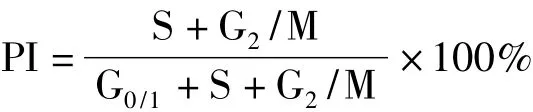
1.2.3 流式细胞术检测细胞中BCL-2及BAX蛋白表达量:调整每份样品的细胞数为1×106/100μL,分别加入小鼠抗人BCL-2及BAX抗体,常温放置30 min,PBS液洗涤2次,加入1∶50稀释的羊抗小鼠FITC标记的IgG二抗,常温下放置30 min,PBS液洗涤2次,上流式细胞仪检测。流式细胞术检测蛋白含量以平均荧光强度表示。
1.2.4 Western blot方法检测细胞中BCL-2及BAX蛋白表达水平:冷PBS洗涤细胞2次,使用RIPA试剂常规方法提取细胞蛋白。常规Western blot方法检测细胞中BCL-2及BAX蛋白,其中β-actin为内参照。
1.3 统计学分析
2 结果
2.1 流式细胞术检测细胞凋亡率及细胞周期
10、20、40 mg/L青蒿琥酯作用 Eca109细胞24 h后,与对照组相比,细胞凋亡率显著增高(p<0.05),细胞增殖指数显著降低(p<0.05),细胞G0/G1期显著增高(p<0.05),且具有剂量依赖性(表1,图 1,2)。
2.2 流式细胞术检测细胞中BCL-2及BAX蛋白表达水平
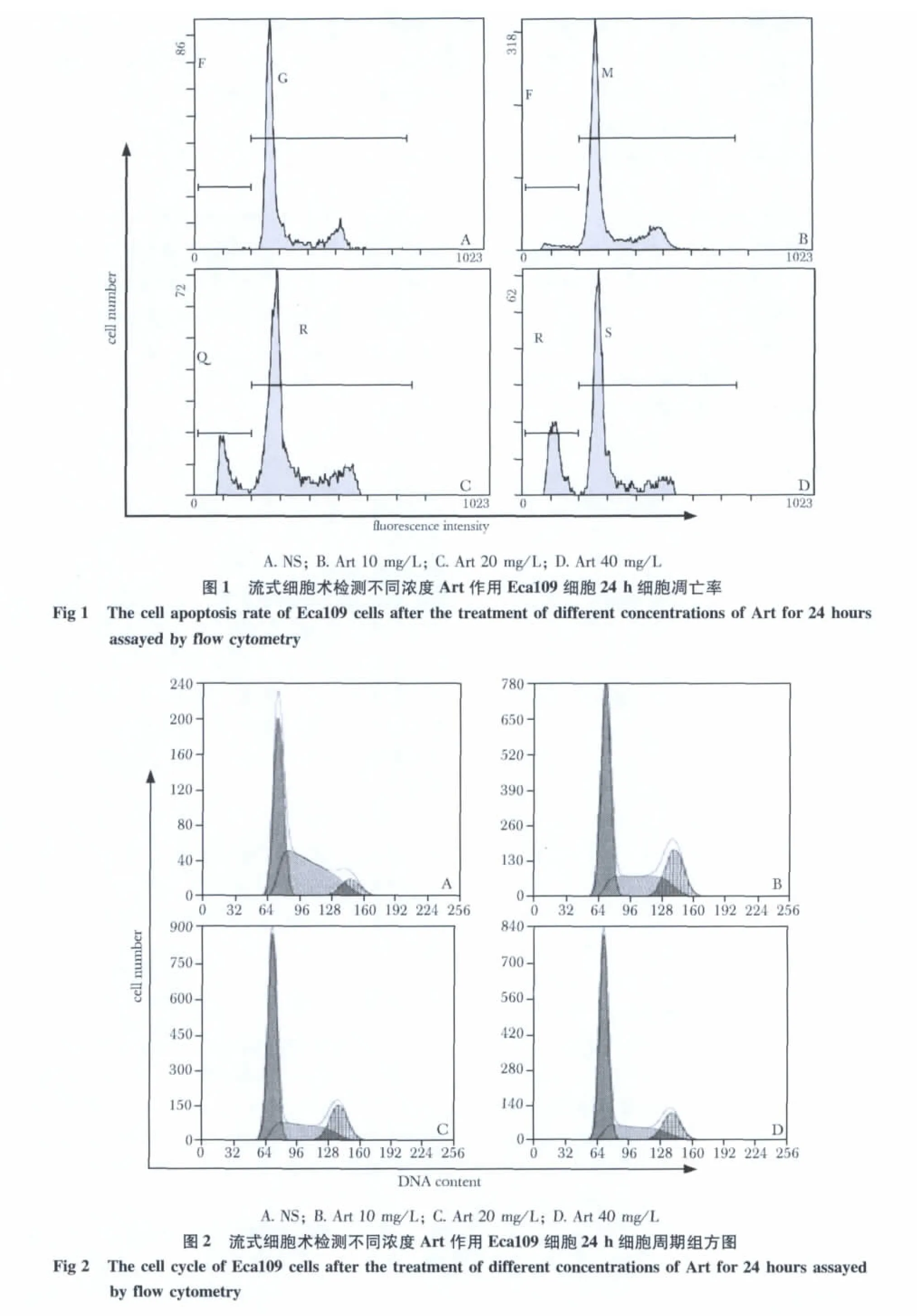
表1 流式细胞术检测不同浓度Art作用Eca109细胞24 h细胞凋亡率及细胞周期Table 1 The cell apoptosis rate and cell cycle of Eca109 cells after the treatment of different concentrations of Art for 24 hours assayed by flow cytometry,n=3)
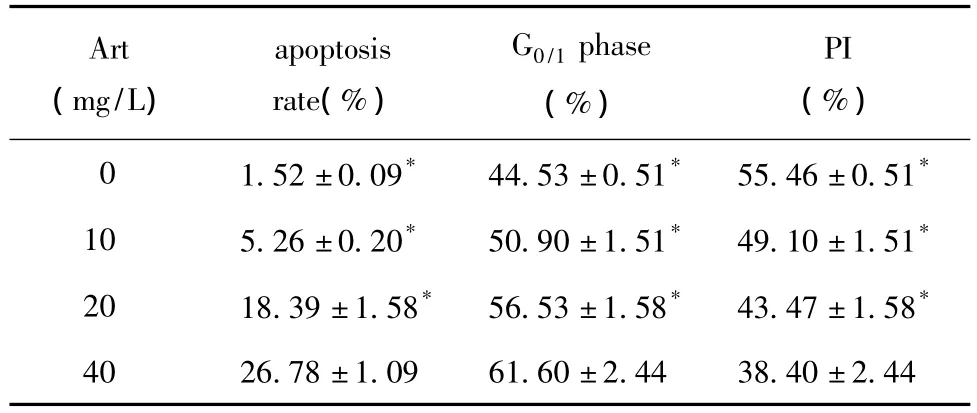
表1 流式细胞术检测不同浓度Art作用Eca109细胞24 h细胞凋亡率及细胞周期Table 1 The cell apoptosis rate and cell cycle of Eca109 cells after the treatment of different concentrations of Art for 24 hours assayed by flow cytometry,n=3)
*p<0.05 compared with Art 40 mg/L group
Art(mg/L)apoptosis rate(%)G0/1 phase(%)PI(%)0 1.52±0.09* 44.53±0.51* 55.46±0.51*10 5.26±0.20* 50.90±1.51* 49.10±1.51*20 18.39±1.58* 56.53±1.58* 43.47±1.58*40 26.78±1.09 61.60±2.44 38.40±2.44
青蒿琥酯组与对照组相比,细胞中BCL-2蛋白表达水平显著降低(p<0.05),细胞中BAX蛋白表达水平显著增高(p<0.05),且具有剂量依赖性(表2,图3,4)。
2.3 Western blot方法检测细胞中BCL-2及BAX蛋白表达水平
青蒿琥酯实验组与对照组相比,Eca109细胞中BCL-2蛋白表达水平降低,BAX蛋白表达水平增高(图5),与流式细胞术检测结果一致。
表2 流式细胞术检测不同浓度Art作用Eca109细胞24 h细胞中BCL-2和BAX蛋白表达水平Table 2 The BCL-2 and BAX protein expression level of Eca109 cells after the treatment of different concentrations of Art for 24 hours assayed by flow cytometry(,n=3)
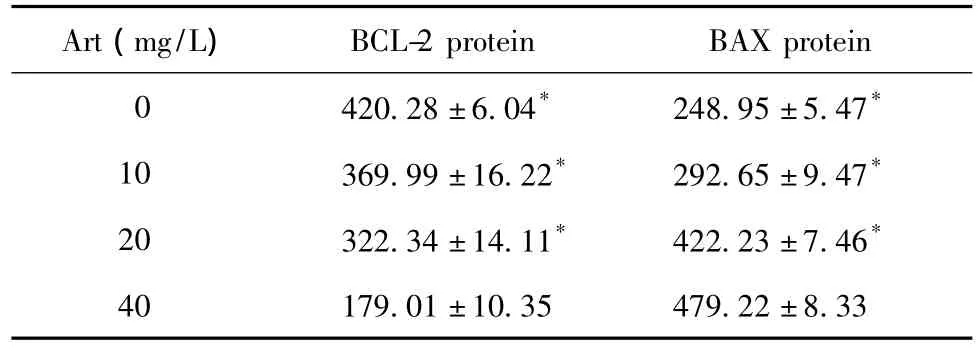
表2 流式细胞术检测不同浓度Art作用Eca109细胞24 h细胞中BCL-2和BAX蛋白表达水平Table 2 The BCL-2 and BAX protein expression level of Eca109 cells after the treatment of different concentrations of Art for 24 hours assayed by flow cytometry(,n=3)
*P <0.05 compared with Art 40 mg/L group.
Art(mg/L)BCL-2 protein BAX protein 0 420.28±6.04* 248.95±5.47*10 369.99±16.22* 292.65±9.47*20 322.34±14.11* 422.23±7.46*40 179.01±10.35 479.22±8.33
2.4 青蒿琥酯作用后Eca109细胞中BCL-2及BAX蛋白表达相关性分析
青蒿琥酯作用后,Eca109细胞中BCL-2及BAX蛋白表达呈显著负相关(pearson相关系数=-0.922,P=0.000)。
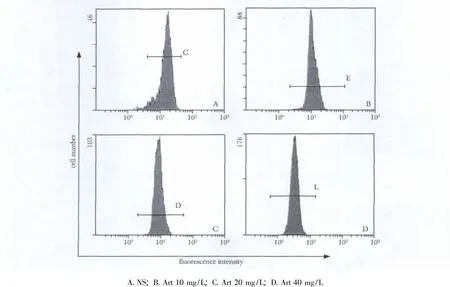
图3 流式细胞术检测不同浓度Art作用Eca109细胞24h细胞中BCL-2蛋白表达水平Fig 3 The BCL-2 protein expression level of Eca109 cells after the treatment of different concentrations of Art for 24 hours assayed by flow cytometry
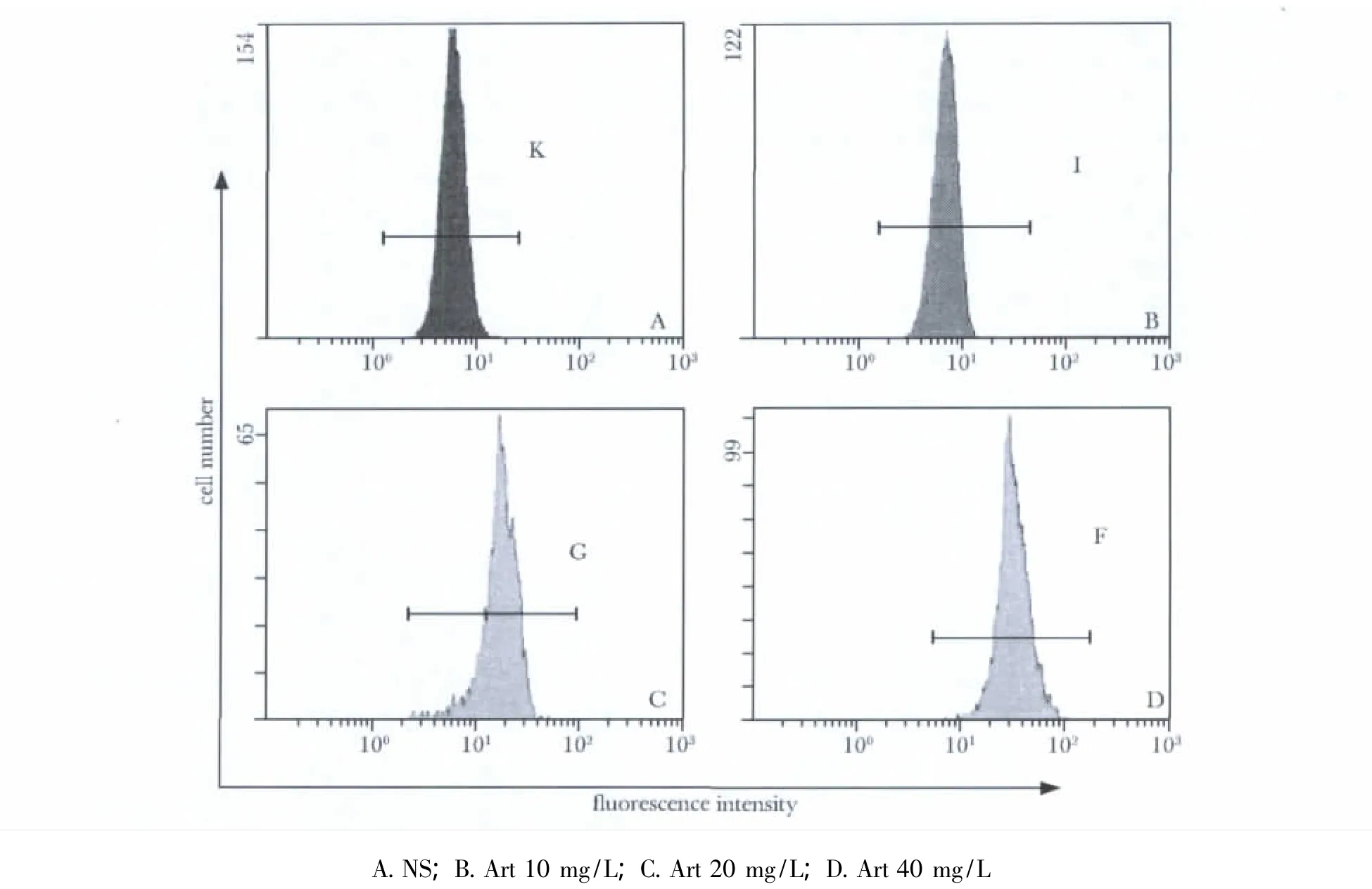
图4 流式细胞术检测不同浓度Art作用Eca109细胞24h细胞中BAX蛋白表达水平Fig 4 The BAX protein expression level of Eca109 cells after the treatment of different concentrations of Art for 24 hours assayed by flow cytometry

图5 Western blot方法检测Eca109细胞中BCL-2及BAX蛋白表达水平Fig 5 The BCL-2 and BAX protein expression of Eca109 cells assayed by Western blot
3 讨论
食管癌是我国较常见的恶性肿瘤,目前食管癌的化疗效果欠佳,主要原因在于药物不良反应较大和多药耐药的产生,寻找低毒、不耐药的抗肿瘤药物就显得十分重要。中药治疗肿瘤已有久远的历史,具有不良反应少,价格低等优点。青蒿琥酯是青蒿素衍生物之一,具有较好的抗疟作用[3-4],尤其对重型和耐药型疟疾具有较好的疗效[5-7],进一步研究发现,青蒿琥酯还具有调节免疫、抗血吸虫及抗肿瘤作用[8-9]。本实验主要研究青蒿琥酯诱导食管癌细胞凋亡作用,为临床上寻找高效、低毒的抗食管癌药物提供实验基础。
大量文献报道,青蒿琥酯抗肿瘤主要是通过诱导细胞凋亡而发挥作用[10-11],但少见在食管癌中的研究,在本实验中选取了青蒿琥酯的3个浓度,发现青蒿琥酯可以诱导食管癌Eca109细胞产生凋亡,而起到抗食管癌作用,且诱导细胞凋亡作用具有青蒿琥酯剂量依赖性。进一步研究发现,青蒿琥酯作用后抗凋亡基因蛋白BCL-2表达水平显著降低,而BAX蛋白表达水平显著升高,其两者之间具有显著的负相关性。降低细胞中BCL-2蛋白表达水平,升高BAX蛋白表达水平可以诱导细胞凋亡。本研究除了发现青蒿琥酯通过诱导细胞凋亡而起到抗食管癌作用外,实验中还发现,青蒿琥酯可以显著降低Eca109细胞增殖指数,抑制食管癌细胞增殖,将其细胞周期阻滞在G0/G1期。
综合本实验研究,提示青蒿琥酯具有抗食管癌作用。青蒿琥酯抗食管癌作用与诱导细胞凋亡、细胞周期阻滞及抑制细胞增殖有关。青蒿琥酯具有低毒、高效及价廉等优点,如果能将其开发为抗肿瘤药物,将具有广泛的应用前景。
[1]Thanaketpaisarn O,Waiwut P,Sakurai H,et al.Artesunate enhances TRAIL-induced apoptosis in human cervical carcinoma cells through inhibition of the NF-κB and PI3K/Akt signaling pathways[J].Int J Oncol,2011,39:279 -285.
[2]Michaelis M,Kleinschmidt MC,Barth S,et al.Anti-cancer effects of artesunate in a panel of chemoresistant neuroblastoma cell lines[J].Biochem Pharmacol,2010,79:130-136.
[3]Gbotosho GO,Sowunmi A,Okuboyejo TM,et al.Therapeutic efficacy and effects of artemether-lumefantrine and artesunate-amodiaquine coformulated or copackaged on malaria-associated Anemia in children with uncomplicated plasmodium falciparum malaria in southwest nigeria[J].Am JTrop Med Hyg,2011,84:813 -819.
[4]Avabratha KS,Chettiyar LA,John NP.Oral artesunate for neonatal malaria[J].J Trop Pediatr,2010,56:452 -453.
[5]Shanks GD.For severe malaria,artesunate is the answer[J].Lancet,2010,376:1621 -1622.
[6]Zoller T,Junghanss T,Kapaun A,et al.Intravenous artesunate for severe malaria in travelers,europe[J].Emerg Infect Dis,2011,17:771-777.
[7]Bello SO.Pre-referral artesunate in severe malaria[J].Lancet,2009,373:1762 -1763.
[8] Konkimalla VB,McCubrey JA,Efferth T.The role of downstream signaling pathways of the epidermal growth factor receptor for Artesunate's activity in cancer cells[J].Curr Cancer Drug Targets,2009,9:72 -80.
[9]Steinbrück L,Pereira G,Efferth T.Effects of artesunate on cytokinesis and G2/M cell cycle progression of tumour cells and budding yeast[J].Cancer Genomics Proteomics,2010,7:337-346.
[10]Li B,Yao Q,Pan XC,et al.Artesunate enhances the antibacterial effect of{beta}-lactam antibiotics against Escherichia coli by increasing antibiotic accumulation via inhibition of the multidrug efflux pump system AcrAB-TolC[J].JAntimicrob Chemother,2011,66:769 -777.
[11]Hamacher-Brady A,Stein HA,Turschner S,et al.Artesunate activates mitochondrial apoptosis in breast cancer cells via iron-catalyzed lysosomal reactive oxygen species production[J].JBiol Chem,2011,286:6587-6601.

