舒肝颗粒对大鼠肝星状细胞的凋亡的影响
秦文燕 曹群奋 李昌平
肝纤维化是大多数慢性肝病所共有的病理特征,也是慢性肝炎进一步向肝硬化和肝癌发展的重要环节[1]。而肝星状细胞(hepatic stellate cell,HSC)的活化增殖是肝纤维化形成的主要细胞基础,细胞外基质(extra cellular matrix,ECM)的大量合成是肝纤维化形成的直接原因,也是肝纤维化发生的中心环节[2]。活化的HSC主要通过凋亡机制减少,故促进HSC凋亡可逆转肝纤维化[3]。鉴于HSC在肝纤维化发病机制中的主导作用,大多数抗肝纤维化研究都以HSC为靶标。所以,抑制HSC的活化和增殖,促进HSC的凋亡,成为治疗肝纤维化的基本策略。已有实验证明舒肝颗粒可通过抑制HSC增殖和胶原蛋白的分泌,减少胶原纤维在肝脏内的沉积,但它是否具有促进肝星状细胞凋亡,及其可能的作用机制,未曾进行过研究,故本实验选择观察舒肝颗粒作用于体外培养的活化的大鼠肝星状细胞,采用流式细胞仪进行检测结果[4]。
肝星状细胞凋亡机制较为复杂,可通过多途径凋亡。目前,国内外对中药诱导HSC凋亡的研究实验已逐渐展开,而中药具有多层次、多靶点的抗纤维化作用,且不良反应少,价格低廉,拥有广阔的前景,值得我们深入研究和实践。HSC凋亡途径主要包括:①经典的线粒体途径;② 死亡受体途径:包括Fas/FasL途径、肿瘤坏死因子相关的凋亡诱导配体(TRAIL)途径和肿瘤坏死因子-α(TNF-α)途径;③非死亡受体途径。本实验选择死亡受体途径及Bcl家族蛋白两条途径,对舒肝颗粒可能诱导肝星状细胞凋亡的机制进行探讨。
材料与方法
1.实验材料:肝星状细胞株HSC-T6,购自上海中医药大学肝病研究所,其表型为活化的HSC。舒肝颗粒由泸州医学院附属医院药物研究所提供、特级胎牛血清、RPMI 1640培养基、胰蛋白酶购自北京元亨圣马生物技术研究所,Annexin-v/FITC抗体购自Beckman公司,CD95抗体、Bax抗体、Bcl-2抗体购自Sant Cruz Biotechnoloyg公司,浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司。
2.实验方法:(1)舒肝颗粒的配制:参照杨玲等[5]方法,由于直接加药法和含药血清法所得结果一致。取舒肝颗粒10g,用178ml蒸馏水溶解,装入250ml玻璃瓶中,高压蒸气灭菌,用0.45μm的滤器除菌及杂质,取100ml滤液,其浓度56mg/ml,再用0.22μm的滤器过滤除菌分装。(2)实验分组:实验组:肝星状细胞10%特级胎牛血清RPMI 1640培养液中加入舒肝颗粒药液,参照李志等[4]研究结果,根据预实验情况,设置3个药物浓度组,分别:4.2mg/ml舒肝颗粒组;2.8mg/ml舒肝颗粒组;1.4mg/ml舒肝颗粒组。对照组:肝星状细胞10%特级胎牛血清RPMI 1640培养液中不加其他处理因素。(3)HSC-T6的复苏与培养:从液氮罐中取出细胞冻存管,迅速置入37℃水浴中,轻轻振荡至冻存液完全溶解(1~2min)。75%乙醇擦拭冻存管后打开,将冻存液吸入15ml无菌离心管中,边滴加含10%PBS的DMEM培养基边振荡混匀。1000r/min离心5min,吸弃上清液,重复洗1次,再加入含10%PBS的RPMI 1640培养基3ml,接种于25ml培养瓶中,放入37℃、5%CO2培养箱中培养,24h后,更换培养基继续培养。待细胞将近长满培养瓶底时,用0.25%胰蛋白酶消化,按1∶3传代。(4)流式细胞仪检测舒肝颗粒对肝星状细胞凋亡的影响:细胞复苏后,胰酶消化、离心、吹打、计数、调整细胞浓度5×104左右,接种六孔板,培养1天,分组加药,继续培养24h,镜下观测细胞形态的变化。然后分别按实验组和对照组进行流式细胞仪检测,每组选4个复孔,行5次检测。具体如下:吹打细胞,使其成为单细胞悬液,收集细胞液,1500r/min离心,冷PBS冲洗,再离心,丢弃上清液,每根试管中加入100μl冷PBS,振荡器振荡摇匀成单细胞悬液,调整细胞浓度1×106/ml,缓冲液稀释1∶4(4ml结合缓冲液加16ml去离子水),取100μl细胞悬液,于5ml流式管中加入5μl Annexin V/FITC和10μl 20mg/ml碘化丙锭 (propidine iodide,PI),混匀后室温避光孵育15min,在反应管中加入400μl PBS上机分析。(5)流式细胞仪检测舒肝颗粒对CD95的影响:方法如上述,细胞复苏后,接种六孔板,培养一天,按实验组和对照组分别加药,继续培养24h后,镜下观测细胞形态的变化。同样用流式细胞仪检测CD95表达。(6)免疫细胞化学法检测Bax、Bcl-2的表达:取对数生长期细胞经上述相同处理后接种于置有经多聚赖氨酸处理的盖玻片的24孔板中,置于37℃,5%CO2孵箱中培养,待细胞生长达70%融合,将细胞分4组:空白对照组、4.2mg/ml舒肝颗粒组;2.8mg/ml舒肝颗粒组;1.4mg/ml舒肝颗粒组。以无血清培养基洗细胞3次,加入不同浓度舒肝颗粒。舒肝颗粒处理24h后,采用4%多聚甲醛固定细胞15min,0.3%Tri-tonX -100通透细胞 30min,3%过氧化氢-甲醇液中浸泡10min,非免疫性动物血清中孵10min,加一抗(Bax抗体)4℃冰箱过夜后,生物素标记的二抗中孵育10min,加HRP标记链亲和素孵育10min(以上每次操作均用PBS洗细胞3次后再进行下一步)。然后进行DAB显色(显微镜下观察掌握显色程度):自来水充分冲洗,苏木素复染,盐酸乙醇分化,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察,照相。以PBS代替一抗作阴性对照实验。同样的方法检测Bcl-2表达。Bax、Bcl-2阳性结果判断:阳性信号为棕黄色或棕褐色,位于细胞质的线粒体膜、内质网膜及核膜上,用Imge plus 7.0版专业图像处理软件半定量分析系统对各组肝星状细胞Bax和Bcl-2反应细胞进行显微图像分析,每组随机检测4个视野细胞的光密度,计算其积分光密度,并计算出Bax/Bcl-2的比值。
结 果
1.舒肝颗粒对肝星状细胞凋亡的影响:从FITC和PI荧光双参数点图观察到,对照组HSC-T6细胞主要分布在3区,因操作等原因引起的机械性死亡细胞数量非常少(<2%)。正常对照组(n=20)的凋亡率是3.40% ±0.82%,不同浓度的舒肝颗粒1.4mg/ml(n=20)、2.8mg/ml(n=20)、4.2mg/ml(n=20)组,对应的肝星状细胞的凋亡率分别是:42.61%±6.42%、61.07% ±3.19%、87.84% ±5.49%。在1.4mg/ml组,肝星状细胞的早期凋亡率明显较正常对照组增加,而中晚期凋亡率较少。在2.8mg/ml组,肝星状细胞的早期凋亡率和中晚期凋亡率均明显升高。4.2mg/ml组,肝星状细胞在舒肝颗粒作用24h后,大部分已属于中晚期凋亡,早期凋亡较低浓度组明显减少,但较正常对照组仍明显增高,从早期凋亡和中晚期凋亡的总体趋势看,随着浓度增高,总的凋亡率增加,且各组间的差别具有统计学意义(F=2847.115,P <0.01),具体见图 1。
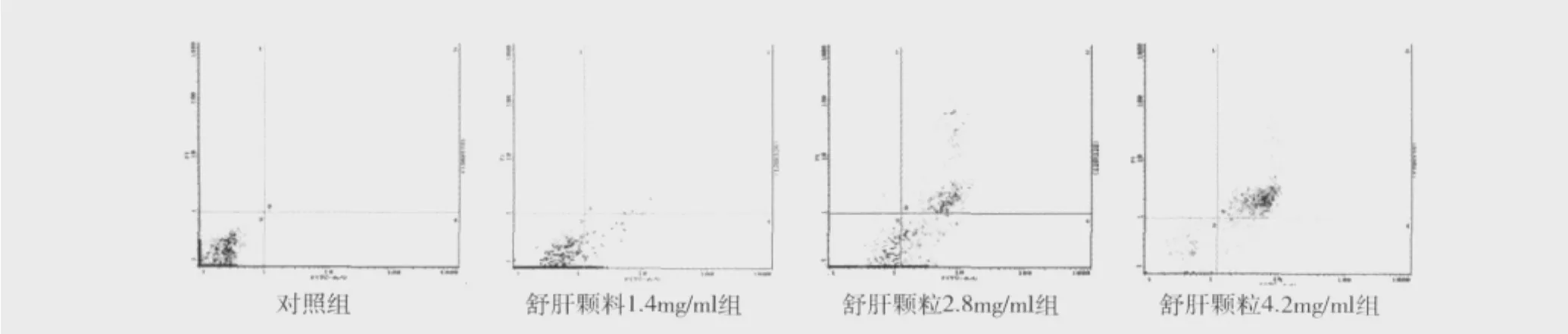
图1 流式细胞术检测舒肝颗粒对HSC凋亡的作用
2.舒肝颗粒对肝星状细胞表达CD95的影响:活化的大鼠肝星状细胞经不同浓度的舒肝颗粒作用24h后,经流式细胞仪检测荧光标记的CD95的表达率。正常对照组(n=20)的 CD95的表达率是0.10% ±0.04%,不同浓度的舒肝颗粒1.4mg/ml(n=20)、2.8mg/ml(n=20)、4.2mg/ml(n=20)组,CD95 的表达分别是:4.77%±0.84%、9.44%±0.61%、24.51%±5.91%,并随着浓度增高,CD95的表达率也增高,且各组间的差别具体统计学意义(F=810.155,p<0.05)。
3.舒肝颗粒对肝星状细胞表达凋亡蛋白Bax/Bcl-2的影响:Bax的表达正常组为 574.17±190.97,随着药物浓度组的增高,Bax的表达增多,不同浓度的舒肝颗粒 1.4、2.8、4.2mg/ml,对 Bax 的表达分别是:1113.14 ± 556.74、1418.75 ± 604.05、1765.43 ±716.801,且各组间差别具有统计学意义(F=3.729,p<0.05),Bcl-2的表达,药物浓度组与正常对照组无明显差别,(F=2.70,P >0.05)。但总体 Bax/Bcl-2的比值随着药物浓度组的增加而升高,具体见表1及图2。

表1 不同浓度的舒肝颗粒作用HSC后Bax和Bcl-2的IOD值及Bax/Bcl-2比值
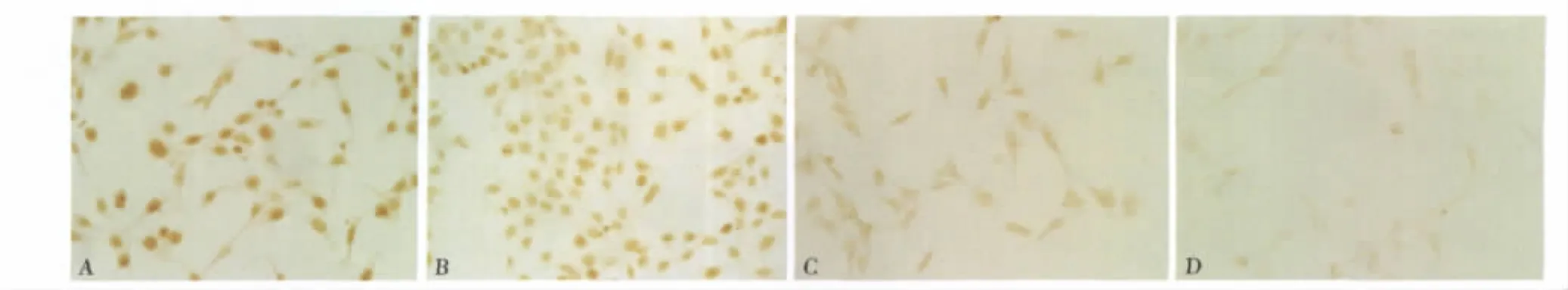
图2 Bax表达(SABC,×400)
讨 论
HSC是一种主要合成分泌细胞外基质(ECM)和胶原酶的间质细胞。激活的HSC的减少主要不是通过转化为静止的HSC实现,而是凋亡的结果。HSC凋亡是导致HSC数量减少的中心环节。促进HSC凋亡有利于肝纤维化的逆转并可能成为未来抗肝纤维化的突破口。现研究表明HSC凋亡是转化依赖性的,即转化中与激活后的HSC才能发生凋亡并且与激活程度相平行[6]。本实验所采用的是激活后的HSC,这符合肝纤维化中HSC的状态。本实验结果表明,舒肝颗粒在1.4~4.2mg/ml浓度范围内,舒肝颗粒无细胞毒性作用,能诱导HSC凋亡,其作用呈剂量依赖性。1.4mg/ml舒肝颗粒作用HSC-T6 24h,流式细胞仪检测Annexin V单阳性细胞即凋亡细胞开始增多,至4.2mg/ml时 Annexinv及PI双阳性细胞即坏死细胞也开始增多。各实验组总的凋亡率,随舒肝颗粒浓度的增高,而增高,各组间的差别具有统计学意义。这表明舒肝颗粒科诱导肝星状细胞凋亡,且具体浓度依赖性。
肝星状细胞可通过多途径凋亡。激活的HSC凋亡主要通过死亡因子FasL及其相应的死亡因子受体(Fas也称Apo-21或CD95)介导的信号传导途径,它是机体内细胞凋亡的主要途径之一。研究发现,因为随着HSC活化的进展,其表达Fas和FasL不断地增加,用阻断Fas的抗体可以完全阻止正常的和已经进入凋亡周期的星状细胞继续凋亡;用其激活抗体则可以显著增加凋亡细胞数量[7]。为了进一步探讨舒肝颗粒诱导HSC凋亡的可能作用机制,本实验通过流式细胞仪检测舒肝颗粒作用24h的HSC细胞,是否有死亡因子受体CD95的表达增多。实验结果表明随着舒肝颗粒浓度的增高,其CD95的表达明显增强,各组间差别具体统计学意义,提示舒肝颗粒可能是通过Fas介导的信号传导途径诱导HSC凋亡。
HSC的另一条凋亡途径Bcl-2/Bax家族,Bcl-2类为凋亡抑制因子,Bax类,为凋亡促进因子[8]。正常时Bax类和Bcl-2类这对正负凋亡调节基因在体内形成二聚体,处于动态平衡之中。当Bax的量高于Bcl-2时,诱导细胞凋亡,反之,细胞存活。本实验研究中发现随着舒肝颗粒的浓度增高Bax的表达明显增加,而Bcl-2的表达在正常对照组较少,随着舒肝颗粒的浓度组增高,Bcl-2的变化无统计学意义,而Bax/Bcl-2的比值明显增高,促进了HSC的凋亡,考虑Bcl-2没有明显的减少,可能是舒肝颗粒诱导肝星状细胞凋亡的机制中对Bcl-2的表达无明显影响。Elsharkawy等[3]研究也发现在肝纤维化逆转中HSCs的凋亡是通过上调caspase-3、Bax实现的。故经舒肝颗粒作用的HSC促凋亡蛋白表达占优势,对凋亡的敏感性增加而向凋亡转化,这也可能是舒肝颗粒促进HSC凋亡的作用机制之一。
综上所述,本实验可以明确舒肝颗粒可以诱导肝星状细胞凋亡,且呈浓度依赖,其作用途径可能为Fas介导的信号传导途及与Bax蛋白表达上调相关。但舒肝颗粒素通过何种途径影响HSC的Fas、Bax、P53表达,其具体机制尚不清楚,是否还通过其他信号传导途径诱导HSC的凋亡、或通过对凋亡调控基因的调节而影响HSC的凋亡,尚有待于进一步的研究。但本实验为舒肝颗粒治疗肝纤维化临床应用提供了理论依据。
1 孙妩弋,桂双英,吴丽,等.芍芪多苷对肝纤维化大鼠肝脏星状细胞基质金属蛋白酶13及组织金属蛋白酶抑制因子1表达的影响[J].中国中药杂志,2010,35(11):1147-1151
2 Novo E,di bonzo LV,Cannito S,et al.Hepatic myofibroblasts:a heterogeneous population of multifunctional cells in liver fibrogenesis[J].Int J Biochem Cell Biol,2009,41(11):2089 -2093
3 Elsharkawy AM,Oakley F,Mann DA.The role and regulation of hepatic stellate cell apoptosis in reversal of liver fibrosis[J].Apoptosis,2005,10(5):927 -939
4 李志,漆红,李昌平.舒肝颗粒对大鼠肝星状细胞增殖及胶原分泌的影响[J].世界华人消化杂志,2010,18(2):169 -172
5 杨玲,朱清静,笪邦红,等.中药抗纤软肝颗粒抑制PDGF诱导的肝星状细胞MEK-1和c-fos表达[J].世界华人消化杂志,2004,12:347-350
6 Guicciardi ME,Gores GJ.Apoptosis as a mechanism for liver disease progression[J].Semin Liver Dis,2010 30(4):402 -410
7 Kordes C,Sawitza I,Hussinger D.Hepatic and pancreatic stellate cells in focus[J].Biol Chem,2009,390(10):1003 -1012
8 Shin HW,Park SY,Lee KB,et al.Down-regulation of Wnt signaling during apoptosis of human hepatic stellate cells[J].Hepatogastroenterology,2009,56(89):208 -212

