脂肪干细胞调节创面炎症反应并促进创面愈合
董 瑶 董飞君 李幼华
皮肤是人体最大的器官,大面积的皮肤缺损和难愈性创面会导致皮肤功能的丧失,其治疗也是临床上的难题。临床治疗中采用的各种自体皮片或皮瓣移植修复,会造成供区新的创伤。同时,供皮来源的问题也限制了其有效的应用。近年来,干细胞相关机制及应用的研究为皮肤创伤的治疗带来了新的突破。研究表明,间充质干细胞(mesenchymal stem cells,MSCs)能够促进皮肤创面的愈合,其机制包括分化为皮肤组织相关细胞[1]、促进成纤维细胞的增殖[2]、促进创面血管化[3]等,但其相关机制仍需要进一步阐明。本研究利用GFP-C57BL小鼠脂肪组织来源的干细胞(adipose-derived stem cells,ADSCs)用于小鼠皮肤创伤的治疗,并探讨ADSCs是否通过调节创面局部的炎症反应促进创面愈合。
材料与方法
1.材料:DMEM(L)培养基、胰酶、Ⅰ型胶原酶胎牛血清、TRIzol Reagent(均购自美国Gibco公司),反转录试剂盒(Takara公司),超净工作台(苏州净化总厂),CO2培养箱(德国Heraeus公司),倒置显微镜、荧光显微镜(日本Olympus公司)。
2.GFP小鼠脂肪组织来源干细胞(ADSCs)的分离、培养、鉴定:取5周龄GFP转基因小鼠(GFP-C57BL)2只,10g/L戊巴比妥钠腹腔注射麻醉,75%乙醇消毒腹股沟处,无菌条件下取腹股沟部的脂肪组织约1ml,去除血管及其他组织,用青、链霉素的PBS反复冲洗以除去血液。用剪刀将脂肪组织剪成1mm3小块,置于2.5ml I型胶原酶中,37℃摇床100r/min消化50min,然后800r/min离心5min,弃去上层的脂肪及上清,沉淀用含100ml/L胎牛血清的DMEM(L)培养基制成单细胞悬液,进行细胞计数,以2×l05/ml的密度接种于培养瓶中,置于37℃、50ml/L CO2,培养箱中常规培养,原代培养2天后换液,细胞长满80%时用胰酶和EDTA消化传代培养。
3.ADSCs体外向脂肪细胞和成骨细胞的诱导分化:取第3代GFP-ADSCs细胞接种于6孔板内,用含100 ml/L FBS的DMEM(L)培养基培养,达到80%融合后分为实验组和对照组,实验组分别更换成脂和成骨诱导液诱导培养。向成骨细胞的诱导:实验组细胞培养板中加入成骨诱导液培养(含50μmol/L抗坏血酸、10mmol/L的β-磷酸甘油钠、0.01μmol/L的维生素D3及100ml/L FBS的DMEM/F12培养基),3~4天换液1次。培养21天时,取部分细胞爬片行茜素红钙盐染色观察矿化结节的形成。向脂肪细胞的诱导:实验组细胞换用成脂诱导液培养(含1μmol/L地塞米松、10μmol/L牛胰岛素、200 μmol/L吲哚美辛、0.5 μmol/L的 IBMX、10%FBS的DMEM/F12培养基),观察细胞形态变化,21天后用4%多聚甲醛固定,油红O染色。
4.动物移植实验:2月龄C57BL14只,按随机数字法分为两组:ADSCs注射组(实验组)及对照组。于实验前10g/ml戊巴比妥钠麻醉,在小鼠背部左右两侧分别制备1个直径为1cm的圆形创面,完整去除全层皮肤。将5×105个ADSCs混悬于500μl PBS注射入实验组小鼠创面周围,500μl单纯PBS注射入对照组小鼠创面周围。术后凡士林油纱布包扎。
5.创面愈合情况的观察和分析:记录并比较分析各组1、2、3周创面愈合情况的差异,创面局部照片通过Image J软件分析创面愈合率。
6.荧光显微镜观察:取移植后2周实验组与对照组动物创面组织的冷冻切片,用丙酮固定10min后置于湿盒中,PBS冲洗后,Hoechst33342衬染5min。荧光显微镜观察移植细胞的存活情况。
7.Real-time RT-PCR检测创面组织中炎症因子的表达:分别取移植后1、2周实验组与对照组动物创面区域组织,液氮冷冻环境下研磨,加入细胞裂解液(TRIzol Reagent),常规方法提取RNA、反转录。IL-1、IL-6、MCP-1和β-actin的引物由Takala公司设计及合成。采用Toyobo公司荧光定量PCR试剂盒,real-time RT-PCR反应由Light Cycler Instrument(Toyobo公司)完成,RNA相对表达量的分析方法为相对CT法,β-actin设为内参。
8.统计学方法:实验数据采用SPSS13.0软件进行t检验分析,以p<0.05为差异有统计学意义,
结 果
1.ADSCs的分离培养和鉴定:第1代ADSCs在倒置显微镜下观察呈小多角形或短梭形并存在一些脂滴(图1A),经传代后脂滴减少。细胞持续表达GFP蛋白,在荧光显微镜下呈绿色荧光(图1D)。在成脂及成骨诱导环境下,ADSCs可向成脂及成骨方向分化,出现油红O阳性的脂滴(图1B)及茜素红阳性的矿化结节(图1C),证明其具有多向分化潜能。
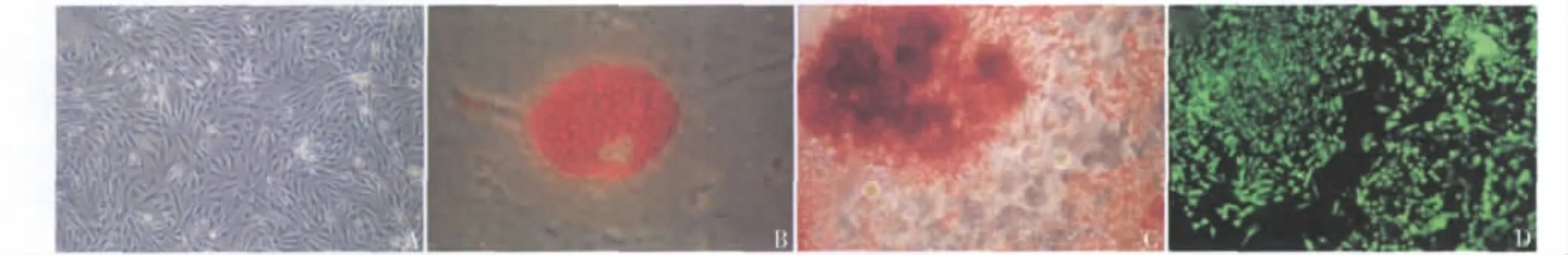
图1 ADSCs的培养及鉴定
2.ADSCs促进创面愈合及在创面区域的存活:ADSCs移植后2周,实验组较对照组愈合情况更为良好(图2A、B)。利用Image J软件分析1~3周创面局部照片计算创面愈合率,在第1周和第2周,ADSCs显著促进了实验组创面愈合率(图2C),在第3周时实验组与对照组的愈合率没有显著性差异。通过荧光显微镜观察移植后2周创面区域组织的冷冻切片,发现只有少量移植ADSCs的存活(图2D~F)。
3.ADSCs调节创面愈合过程中的炎症反应:取1周和2周创面区域组织进行real-time PCR分析,结果显示在上述两个时间点,与对照组相比,实验组创面区域组织中炎症因子IL-1、IL-6显著下降(图3A、B);MCP-1在第1周时显著下降,第2周时与对照组无显著性差异(图3C)。与对照组相比,实验组中抑制炎症发生的因子IL-10在上述两个时间点均有显著上升(图3D)。

图2 ADSCs促进创面愈合及在创面周围的存活

图3 ADSCs对创面愈合过程中(1、2周)炎症因子IL-1(A)、IL-6(B)、MCP-1(C)和IL-10(D)表达的影响(*p<0.01)
讨 论
如何获得足够数量的可以应用于治疗的干细胞一直是干细胞应用过程面对的难题。胚胎干细胞具有分化为人体各种类型细胞的潜能,但是其应用一直受到伦理学的限制。成体干细胞,尤其是MSCs的应用,受到了广泛的关注。MSCs具有自我更新及多向分化潜能,其应用不受伦理学限制。目前研究最为深入的MSCs为骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs),然而BMMSCs需要从骨髓中获取,其应用也受到一定的限制。2001年Zuk PA和Zhu Min从人抽脂术中抽取的脂肪组织悬液中第一次分离获得了具有多向分化潜能的干细胞,能向脂肪细胞、软骨细胞、成骨细胞及肌肉细胞等定向诱导分化[4~6]。脂肪组织中干细胞含量远远高于骨髓中的干细胞含量,而且人脂肪组织获取较为容易,可以从抽脂手术中获取大量的脂肪组织。因此,脂肪干细胞可以作为人干细胞库的重要来源,有非常重要的研究和应用价值。本研究中成功从GFP-C57BL小鼠腹股沟脂肪组织中获取ADSCs,其具有成脂及成骨多向分化潜能,并能持续表达GFP蛋白,为体内干细胞的示踪提供很好的条件。
MSCs促进皮肤创面愈合的机制一直受到广泛的关注,研究表明MSCs可通过分化为皮肤相关细胞、促进成纤维细胞的增殖、促进创面血管化[3]等途径促进皮肤创面的愈合,而另外存在的机制仍需要进一步研究[1~3]。MSCs具有免疫调节和炎症调节能力,能够抑制过度发生的炎症,缓解炎症相关疾病发生的程度[7]。有大量的研究表明,胚胎期皮肤愈合是低炎症环境下发生的,愈合速度较成体皮肤快,并且不会有瘢痕的形成[8];同时,创面炎症程度的适当减弱以及某些炎性细胞的缺失也能够促进创面愈合的速度。基于上述研究背景可以推测,MSCs有可能通过缓解创面局部的炎症反应促进创面的愈合。本研究发现,在创面术后1周和两周,ADSCs可以显著抑制促炎因子IL-1、IL-6和MCP-1的表达,提示ADSCs缓解了创面局部炎症的发生。同时,ADSCs促进了抗炎因子IL-10的表达,提示ADSCs是通过促进体内IL-10的表达调节炎症反应的。研究表明,BMMSCs可在炎症环境下分泌前列腺素E2(prostaglandin E2,PGE2),后者可促进巨噬细胞分泌IL-10。由此可以推测,ADSCs植入体内后,在炎症环境诱导下分泌PGE2,PGE2促进体内巨噬细胞分泌抗炎因子IL-10,IL-10最终缓解了创面愈合过程中的炎症反应,进而愈合速度加快。
早期研究一般认为干细胞修复组织再生主要通过分化为组织相关细胞,参与新生组织的构建[1,3]。近年来,越来越多的研究倾向于认为干细胞在移植后存活数量随时间急剧下降,极少量的细胞不会通过直接参与新生组织的构建促进组织再生,更有可能是通过改变局部微环境(如炎症)促进组织再生的。本研究同样证实了这一观点。利用本研究中获取GFPC57BL小鼠来源的ADSCs持续表达GFP蛋白的特点,进行了细胞在体内失踪及存活情况的研究。结果表明,在细胞移植后2周,体内只有少量ADSCs存活,提示ADSCs可能是通过旁分泌作用缓解创面局部炎症反应,进而促进创面愈合。
1 Altman AM,Yan Y,Matthias N,et al.Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model[J].Stem Cells,2009,27(1):250-258
2 Kim WS,Park BS,Sung JH,et al.Wound healing effect of adipose-derived stem cells:a critical role of secretory factors on human dermal fibroblasts[J].J Dermatol Sci,2007,48(1):15 -24
3 Wu Y,Chen L,Scott PG et al.Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis[J].Stem Cells,2007,25(10):2648-2659
4 Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,(12):4279 -4295
5 Ogawa R,Wizuno H,Hyakusoku H.Chondrogenic and osteogenic differentation of adipose-derived stem cells islated from GFP transgenic mice[J].Nippon Med Sch,2004,71(4):240-241
6 孙雅娟,刘鲁川,金岩,等.绿色荧光蛋白转基因小鼠脂肪间充质干细胞的多向分化潜能[J].第四军医大学学报,2008,29(7):623-625
7 Zhang Q,Shi S,Liu Y,et al.Mesenchymal stem cells derived from human gingiva are capable of immunomodulatory functions and ameliorate inflammation-related tissue destruction in experimental colitis[J].J Immunol,2009,183(12):7787 -7798
8 吴国强,李耀辉,刘晓艳,等.兔胚胎皮肤伤口无瘢痕愈合机制研究[J].中国临床康复,2004,8(26):5574-5575

