血清IL-6、IL-8和TNF-α在胆道术后感染监测中的价值
姚燕珍 鲍舟君 张晓帮 安明和 方国安
胆道感染在肝胆外科比较常见,术后倘若认识不足或治疗措施不当可进展为重症胆道感染,后者的病死率高达30%[1]。因此,术后密切监测感染的严重程度、准确评估病情是预防恶化的关键。由于仅30%~60%的胆道感染患者胆汁培养呈阳性,因此,多数情况下需借助一些非特异性的炎症标志物来判断是否有细菌感染,如常规的体温、WBC计数和GR%(中性粒细胞百分比)等,但它们受个体间差异、生理和病理因素的影响较大,在准确性和及时性方面已经难以满足要求[2]。细胞因子是由免疫细胞主动分泌的、具有广泛生物学功能的多肽或蛋白质。研究表明,血浆中细胞因子的变化甚至早于急性时相蛋白,且与感染程度具有良好的线性关系[3]。然而,国内将细胞因子检测用于胆道术后感染监测的报道很少。本文通过对35例胆汁细菌培养阳性的胆道感染患者的血清IL-6、IL-8和TNF-α进行联合检测,并分别以细菌性肺炎、病毒性肝炎为对照,探讨了它们在胆道感染术后炎症监测中的临床应用价值。
资料与方法
1.病例与分组:35例胆汁细菌培养阳性的胆道感染患者均来源于笔者医院2010年肝胆外科的住院患者,其中胆囊切除21例、胆总管切开14例,男性13例、女性22例,中位年龄65岁(31~80岁);细菌性感染对照组为40例细菌性肺炎患者,其中男性32例,女性8例,中位年龄75岁(44~88岁);病毒性感染对照组为21例慢性乙型病毒性肝炎患者,其中男性16例,女性5例,中位年龄44岁(20~66岁);正常对照组是19例来自本院体检中心的健康个体,其中男性10例,女性9例,中位年龄60岁(32~76岁)。
2.血液学检测:所有病例于清晨抽取空腹肘静脉血3ml,分离血清,并保存于-80℃冰箱,待标本收齐后一次性检测IL-6、IL-8和 TNF- α,均采用 ELISA 法,单位为 pg/ml,试剂购自上海朗道生物公司,测定仪器为美国Bio-Rad公司生产的680型酶标仪。
3.统计学方法:采用SPSS 16.0统计软件,计量资料以(x±s)表示,因测定值不呈正态分布,全部转换为10为底的对数,然后采用单因素方差分析(one-way ANOVA)进行均数比较,均数间两两比较采用最小显著差法(LSD),以p<0.05为有统计学差异;诊断价值通过计算ROC曲线下面积(AUG)来评价,以约登指数(灵敏度+特异度-1)最大值对应的切点值来确定阳性临界值。
结 果
1.各组IL-6、IL-8和TNF-α的测定值及组间比较:见表1,IL-6、IL-8和TNF-α在各组均存在显著差异(p<0.01),其中IL-6和IL-8由高到低均依次为:胆道感染组=细菌性肺炎组>病毒性肝炎组>正常对照组,TNF-α则依次为:细菌性肺炎组>胆道感染组>病毒性肝炎组>正常对照组。

表1 各组IL-6、IL-8和TNF-α的均值及组间两两比较
2.IL-6、IL-8和TNF-α在诊断细菌性感染中的价值比较:将胆道感染组和细菌性肺炎组分为细菌性感染组,病毒性肝炎组和正常对照组分为非细菌性感染组,然后绘制ROC曲线,见图1。其中TNF-α的曲线下面积最大,为 0.984(95%CI:0.953~1.015),其次是 IL -8,为 0.952(95%CI:0.915 ~0.989),IL -6最低,为 0.918(95%CI:0.866 ~0.971)。IL-6的约登指数等于0.708时值最大,即测定值>17.4 pg/ml时诊断细菌性感染的敏感度为93.3%,特异度为77.5%;IL-8的约登指数等于0.768时值最大,即测定值>102.1pg/ml时诊断细菌性感染的敏感度为89.3%,特异度为87.5%;TNF-α的约登指数等于0.975时值最大,即测定值 >104.5pg/ml时诊断细菌性感染的敏感度为100.0%,特异度为97.5%,见表2。
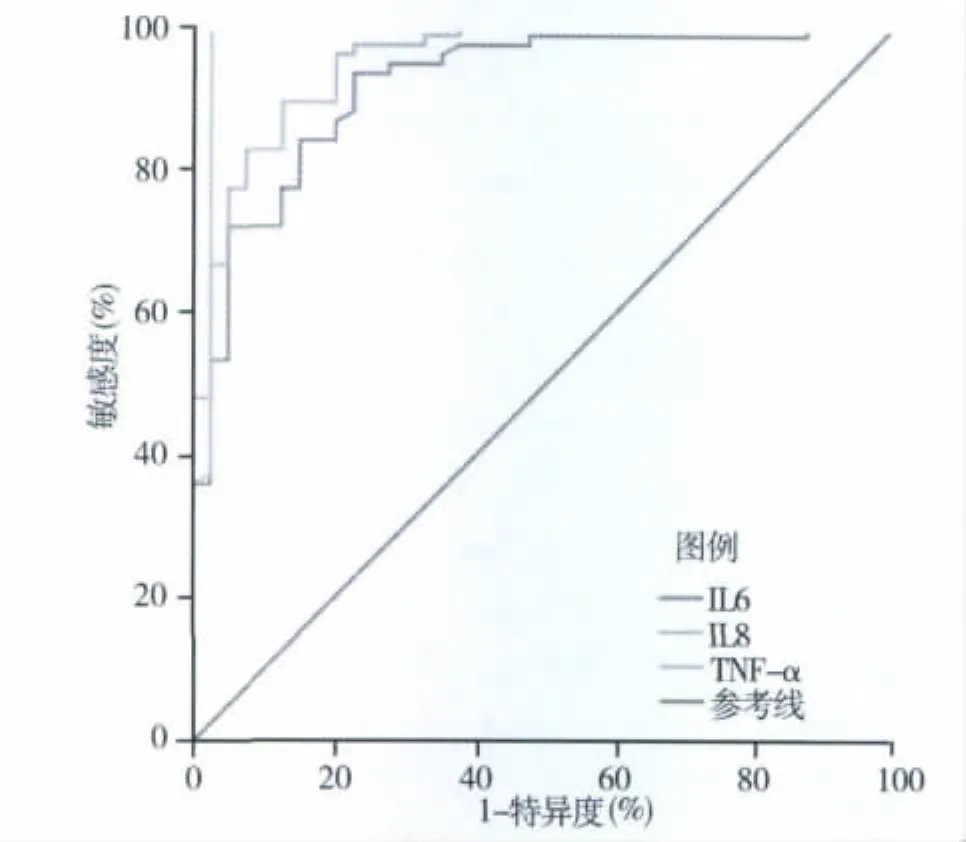
图1 IL-6、IL-8和TNF-α诊断细菌性感染的ROC曲线

表2 IL-6、IL-8和TNF-α取约登指数最大值时的敏感度、特异度及诊断临界值
讨 论
IL-6、IL-8和TNF-α都属于促炎细胞因子,主要由活化的单核-吞噬细胞和血管内皮细胞产生[4]。本研究结果显示,IL-6、IL-8和 TNF-α 在胆道感染组和细菌性肺炎组均比病毒性肝炎组和正常对照组显著增高(p<0.01),表明胆道感染不仅与细菌性肺炎等其他细菌性感染一样,IL-6、IL-8和TNF-α都是增高的,而且还比病毒性感染(至少比病毒性肝炎)高[5]。然而,IL -6和IL -8在胆道感染组和细菌性肺炎组间没有统计学差异(P>0.05),提示二者在鉴别感染部位中作用不大,符合非特异性炎症标志物的特点。不过,TNF在细菌性肺炎组较胆道感染组高(p<0.05),尽管增高幅度不大(表1),具体原因有待进一步阐明,可能与肺部感染一般范围较大、较易扩散有关。
既然IL-6、IL-8和TNF-α在细菌性感染组(胆道感染组和细菌性肺炎组)要比非细菌性感染组(病毒性肝炎组和正常对照组)显著增高,本研究进一步比较了三者的特异度和敏感度。ROC曲线显示三者都在参考线的左上区域,其中线下面积由大到小依次为TNF-α、IL-8和IL-6,且当约登指数取最大值时,特异度和敏感度最好的是TNF-α、其次是IL-8和IL-6,表明在鉴别细菌性感染和非细菌性感染中TNF-α的价值最高,IL-8和IL-6次之。因为胆道感染中60%以上的患者胆汁细菌培养呈阴性(不能排除有细菌感染)而无法做药敏试验,因此,只能根据经验尝试性使用抗生素。此时,迫切需要一个特异、敏感、且能快速反映感染严重程度的监测指标。本研究显示,IL-8、IL-6和TNF-α都符合这一要求,其中以TNF-α为最佳,但由于本次研究病例数较少,还需大样本量的研究来进一步确认[6]。
1 陈规划,易述红.重症胆道感染[J].腹部外科,2009,22(1):8-9
2 温先勇,郑燕,向成玉,等.医院感染诊治中急性时相蛋白的变化研究[J].中华医院感染学杂志,2006,16(12):1343-1346
3 Scheller J,Chalaris A,Schmidt-Arras D,et al.The pro- and anti-inflammatory properties of the cytokine interleukin-6[J].Biochim Biophys Acta,2011,1813(5):878 -888
4 董旭,刘素云,毕建成,等.氟伐他汀对高血压病患者血压与C反应蛋白和白介素6的影响[J].中华心血管病杂志,2008,36(4):344-345
5 马爽,滕琳,尹辛大,等.可溶性E-选择素和白介素8与重症肺炎严重程度的相关性研究[J].中华急诊医学杂志,2009,18(11):1203-1206
6 Friebe A,Volk HD.Stability of tumor necrosis factor alpha,interleukin 6,and interleukin 8 in blood samples of patients with systemic immune activation[J].Arch Pathol Lab Med,2008,132(11):1802 -1806

