自体骨髓间充质干细胞移植加动员在重症急性胰腺炎大鼠胰腺保护中的作用
项爱斋 蔡 阳 封光华 陆 贝 单毓强 贾 忠 杨祺俊 方 欣
重症急性胰腺炎(severe acute pancreatitis,SAP)是常见高危急腹症之一,其早期主要的病生理特点是胰腺细胞的凋亡、坏死和全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),可导致多脏器功能衰竭甚至死亡。目前,治疗上仍缺乏特异有效的手段来控制早期炎症级联反应阻止病程的进展。近几年对骨髓间充质干细胞(mesenchymal stem cell,MSC)的研究发现其有组织修复、抗炎和调节细胞凋亡的功能,为SAP早期治疗带来了新希望。本研究拟观察大鼠自体MSC移植和动员对SAP胰腺的保护作用[1~3]。
材料与方法
1.材料:清洁级的健康雄性 Sprague-Dawley大鼠240只,体重270~330g,购自浙江大学医学院实验动物中心。L-精氨酸、戊巴比妥钠购自 Sigma公司(Sigma-Aldrich,St.Louis,MO,USA)。兔抗鼠 Bax、Bcl-2抗体购自 Santa公司(Santa Cruz,California,USA)。TUNEL试剂盒购自 Takara公司(Jindu,Japan)。粒细胞集落刺激因子(Granulocyte-Colony Stimulating Factor,G-CSF)购自齐鲁制药有限公司。
2.动物分组与模型建立:SD大鼠240只随机分为假手术组、模型组、干细胞移植组(MSC)、重组人粒细胞集落刺激因子组(G-CSF)及MSC+G-CSF组(n=48),各组再按术后时间随机分为12、24、48、72h亚组(n=12)。大鼠术前12h禁食,自由饮水。用2.5%戊巴比妥钠(0.2ml/100g)经腹腔内注射麻醉。剪开股部皮肤暴露股静脉,建立股静脉输液通道,用微量输液泵持续输液[1ml/(h·100g)]。通过2次腹腔注射L-精氨酸2.0g/kg(浓度20g/L,间隔1h)制作SAP模型。MSC组在造模前3天采集自体骨髓间充质干细胞,造模后6h经股静脉一次性注入骨髓间充质干细胞悬液1.2ml,G-CSF组在造模前3天分别皮下注入G-CSF液40μg/(kg·d)。假手术组仅腹腔注射等体积生理盐水。
3.自体骨髓干细胞采集和静脉回输:在无菌条件下行股骨穿刺抽取骨髓,立即1000r/min离心10min后弃上层液体,无菌PBS缓冲液离心洗涤3次弃上清,细胞沉淀以PBS混匀后叠加于2倍体积淋巴细胞分离液上2500r/min离心30min,收集骨髓单核细胞层再用PBS洗涤2次。利用密度梯度离心技术收集骨髓单核细胞,洗涤后铺板培养,根据MSC与造血干细胞(hematopoietic stem cell,HSC)贴壁性能的差异将两类细胞分离。将上述骨髓间充质干细胞以约1ml PBS液悬浮,备用经股静脉回输[4]。
4.死亡率及胰腺病理变化的观察:记录各组的死亡率,直到各组对应的观察时间结束。观察大鼠胰腺大体及光镜下的病理改变,主要观察有无水肿、出血、细胞坏死和间质炎症细胞浸润及各自程度,按照Kusser方法进行评定,各项分值均为0~4分,总分0~16分[5]。
5.胰腺细胞凋亡指数(apoptosis index,AI)和腺泡细胞Bax蛋白测定:对胰腺组织切片进行DNA缺口原位末端标记(TUNEL)染色,高倍镜下(400倍)随机选取10个视野,计数1000个腺泡细胞中的凋亡细胞数,计算凋亡指数(AI=视野内的阳性细胞数/视野内总细胞数×100%)。Bax蛋白测定采用SABC免疫组化染色,具体操作参照试剂盒说明书。结果判定:利用图像分析系统分析阳性面积和阳性区域平均灰度值,并将阳性面积和平均灰度值换算成阳性单位(positive unit,PU),以PU值大小定量。
6.血清 TNF- α、IL -6、AMS、CRP 水平的检测:在全自动生化分析仪上进行检测,具体操作参照试剂盒说明书。
结 果
1.死亡率比较:假手术组大鼠全部存活,模型组48、72h死亡率分别为8.3%和33.3%。MSC组、G -CSF组和MSC+G-CSF组48h前未见死亡,72h死亡率分别为8.3%、16.7%和8.3%,与模型组比较差异无显著性(P >0.05)。
2.胰腺组织病理改变比较:假手术组胰腺大体标本无明显改变,镜下胰腺细胞形态结构大多正常,未见实质出血、坏死和间质炎性细胞浸润。模型组大体6h即可见胰腺肿胀,并有散在小出血点和灰黑色坏死灶;光镜下6h可见胰腺间质炎性细胞浸润,血管扩张、实质出血,胰腺腺泡细胞和脂肪细胞散在变性、坏死,且随时间延长逐渐加重。MSC组、G-CSF组和MSC+G-CSF组各时间点病理改变较模型组不同程度减轻,以MSC+G-CSF组改变最轻。具体评分见表1。
3.胰腺Bax蛋白表达水平和凋亡指数(AI)的比较:治疗组各时间点Bax蛋白表达水平和AI均较模型组上调(P <0.05)。MSC+G -CSF 组24、48、72h点Bax蛋白含量,48、72h点AI与MSC组、G-CSF组比较差异显著(p<0.05)。MSC组和G-CSF组各时间点比较无显著差异(P>0.05),见表2、表3。
表1 胰腺病理评分比较(n=12)
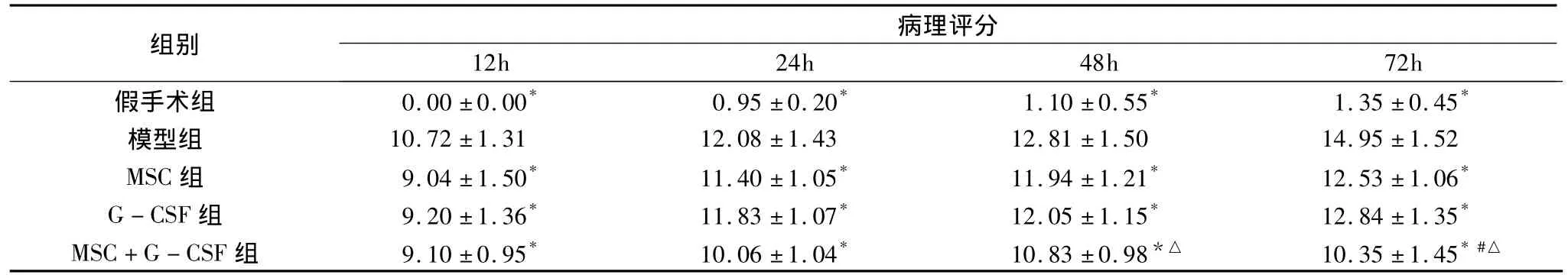
表1 胰腺病理评分比较(n=12)
与模型组比较,*P <0.05;与 MSC 组比较,#P <0.05;与 G -CSF组比较,△P <0.05
病理评分12h 24h 48h 72h假手术组 0.00 ±0.00* 0.95 ±0.20* 1.10 ±0.55* 1.35 ±0.45组别*模型组 10.72 ±1.31 12.08 ±1.43 12.81 ±1.50 14.95 ±1.52 MSC 组 9.04 ±1.50* 11.40 ±1.05* 11.94 ±1.21* 12.53 ±1.06*G -CSF 组 9.20 ±1.36* 11.83 ±1.07* 12.05 ±1.15* 12.84 ±1.35*MSC+G -CSF 组 9.10 ±0.95* 10.06±1.04* 10.83±0.98*△ 10.35 ±1.45*#△
表2 各组胰腺Bax蛋白表达水平的比较)(n=12)

表2 各组胰腺Bax蛋白表达水平的比较)(n=12)
与模型组比较,*P <0.05;与 MSC 组比较,#P <0.05;与 G -CSF组比较,△P <0.05
12h 24h 48h 72h假手术组 3.07 ±0.23* 3.11 ±0.19* 2.98 ±0.26* 3.10 ±0.28组别 Bax(PU)*模型组 10.74 ±0.43 10.93 ±0.38 9.64 ±0.27 7.58 ±0.65 MSC 组 15.78 ±1.13* 13.88 ±1.35* 13.07 ±1.56* 10.42 ±1.34*G -CSF 组 15.65 ±2.27* 13.85 ±1.79* 12.95 ±1.37* 10.73 ±1.35*MSC+G -CSF 组 15.73 ±1.45* 15.60 ±1.25*#△ 15.69 ±1.72*#△ 13.73 ±1.32*#△
表3 各组胰腺腺泡细胞凋亡指数比较(n=12)
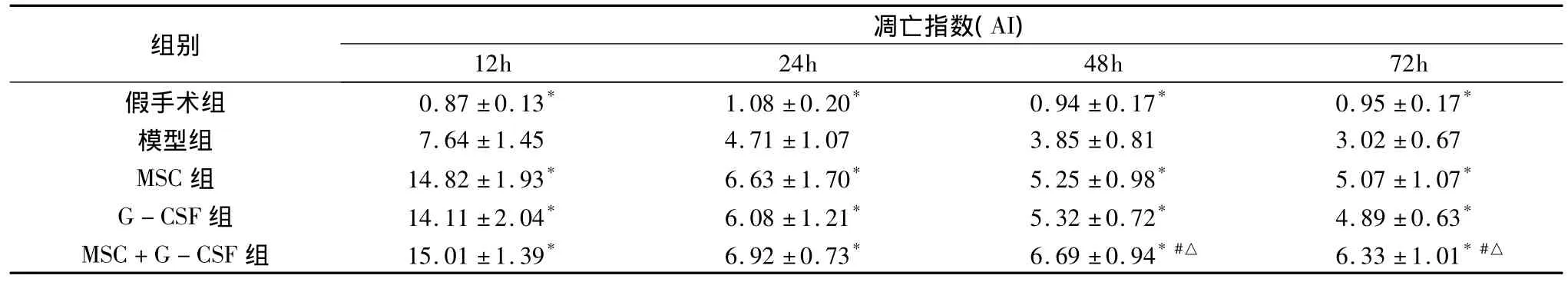
表3 各组胰腺腺泡细胞凋亡指数比较(n=12)
与模型组比较,*P <0.05;与 MSC 组比较,#P <0.05;与 G -CSF组比较,△P <0.05
12h 24h 48h 72h假手术组 0.87 ±0.13* 1.08 ±0.20* 0.94 ±0.17* 0.95 ±0.17组别 凋亡指数(AI)*模型组 7.64 ±1.45 4.71 ±1.07 3.85 ±0.81 3.02 ±0.67 MSC 组 14.82 ±1.93* 6.63 ±1.70* 5.25 ±0.98* 5.07 ±1.07*G -CSF 组 14.11 ±2.04* 6.08 ±1.21* 5.32 ±0.72* 4.89 ±0.63*MSC+G -CSF 组 15.01 ±1.39* 6.92 ±0.73* 6.69 ±0.94*#△ 6.33 ±1.01*#△
4.各组血清 TNF-α、IL-6、AMY、CRP 含量比较:模型组各指标含量于造模24h后达到高峰。治疗组各指标含量随时间延长有不同程度下降,24、48h后与模型组比较差异有显著性(p<0.05)。MSC+G-CSF组48、72h上述各指标含量明显低于MSC组和 G -CSF组(p<0.05),见表4。
表4 血清TNF-α、IL-6、AMY、CRP含量比较(n=12)

表4 血清TNF-α、IL-6、AMY、CRP含量比较(n=12)
与模型组比较,*P <0.05;与 MSC 组比较,#P <0.05;与 G -CSF组比较,△P <0.05
时间(h) 假手术组 模型组 MSC组 G-CSF组 MSC+G-CSF组12 45.1 ±3.8* 205.4 ±32.8 205.0 ±40.1 204.4 ±38.7 202.8 ±41.2 TNF-α(ng/L)IL-6(ng/L)AMY(U/L)CRP(mg/L)24 48.0 ±6.0* 231.3 ±33.1 210.3 ±30.6 211.2 ±32.3 202.5 ±31.7*48 43.5 ±4.1* 247.2 ±38.3 215.6 ±32.1* 216.8 ±31.3* 190.3 ±29.2*△72 51.3 ±6.7* 237.1 ±35.5 204.2 ±31.0* 207.0 ±30.4* 178.7 ±28.9*#△12 158.7 ±20.8* 1224.1 ±180.6 1105.9 ±159.0 1101.4 ±172.1 1080.2 ±150.0*24 153.5 ±25.4* 1408.3 ±251.1 1224.1 ±170.6* 1222.1 ±175.4* 1215.3 ±172.1*48 160.1 ±21.5* 1374.5 ±198.7 1170.3 ±160.2* 1198.9 ±164.3* 1032.1 ±150.6*#△72 155.4 ±20.3* 1289.2 ±179.4 995.6 ±143.7* 1052.0 ±155.2* 861.4 ±140.9*#△12 690.7 ±101.4* 3706.9 ±982.7 3416.1 ±736.0 3846.7 ±834.3 3671.0 ±506.8 24 701.2 ±91.8* 5738.8 ±887.2 4502.1 ±954.9 4717.2 ±760.1 4016.9 ±485.2*48 687.6 ±99.3* 6084.2 ±1005.8 4102.4 ±854.7* 3905.7 ±683.1* 3074.3 ±503.1*#△72 697.3 ±105.1* 5436.0 ±658.3 3436.5 ±745.9* 3075.7 ±654.4* 2483.8 ±550.7*#△12 0.95 ±0.24* 4.70 ±2.52 2.93 ±1.82 3.03 ±2.05 1.76 ±0.65*24 1.01 ±0.31* 4.85 ±2.81 3.09 ±1.91 3.13 ±2.11 1.85 ±0.73*48 1.10 ±0.22* 5.43 ±2.74 3.21 ±2.28* 3.29 ±2.02* 1.90 ±0.71*△72 1.06 ±0.27* 5.18 ±2.69 3.16 ±1.95* 3.20 ±2.06* 1.71 ±0.58*#△
讨 论
骨髓间充质干细胞在体内体外均有较强可塑性,在特定条件下可通过血液循环到达其他组织器官,并经微环境诱导分化为不同胚层来源的组织细胞,参与组织器官的生理更新和病理损伤修复。目前,临床上MSC已用于血液系统疾病、心脏衰竭、肝脏损伤、糖尿病等多种疾病的治疗,并取得了确切的疗效。MSC对SAP治疗效果的研究主要来自于动物实验,在病理再生修复方面也得到了证实,如江学良等应用核染料标记胰腺炎大鼠自体MSC并跟踪测定,在损伤的第2周观察到MSC归巢至损伤的胰腺组织并部分分化,在损伤后的第8周MSC转化为成熟的胰腺功能细胞,证实其参与了胰腺细胞的病理再生,在胰腺损伤的后期修复中发挥了重要作用。另有一些研究表明,MSC还能通过分泌调节蛋白和细胞因子等发挥调节细胞凋亡和抑制炎症反应的作用,而炎症级联反应是SAP早期(急性炎症期)最主要的病生理过程,从而推断MSC可能成为SAP早期一个新的特异有效的治疗手段[6,7]。
本研究通过皮下注射G-CSF动员SAP大鼠的自体骨髓MSC,以及直接静脉移植两种方式,了解各自的治疗疗效,同时比较联合与单独治疗的差异。结果显示治疗组中的MSC+G-CSF组大鼠72h死亡率较模型组和G-CSF组低,胰腺病理损害最轻,提示MSC有助于减轻SAP病情,降低死亡率。同时我们发现治疗组能明显上调胰腺腺泡细胞Bax蛋白表达(p<0.05),且与凋亡指数变化正相关,表明MSC可能通过调节Bax蛋白的表达在SAP早期诱导胰腺腺泡细胞凋亡。细胞凋亡不释放炎症介质,与细胞坏死不同,对胰腺组织是一种保护作用。Lugea等[8]研究发现抑制胰腺腺泡细胞凋亡后,坏死细胞明显增多,胰腺炎的严重程度加重,从反面也证实了凋亡在胰腺炎中对胰腺腺泡细胞的保护作用。3个治疗组48、72h血清中 TNF- α、IL -6、AMY、CRP 含量均下降,而TNF-α已有研究证实是SAP的始动因子,IL-6参与SAP的多脏器功能损害,说明MSC可通过抑制SAP早期的炎症级联反应,减轻胰腺和胰外组织细胞的损伤。
MSC组与G-CSF组对SAP的凋亡调控及炎症抑制指标无明显差别,与文献报道一致。我们认为骨髓MSC移植和动员技术途径不同但作用相似,GCSF也有促进骨髓MSC增殖的效果,与Wexler的研究一致,但动员后外周血MSC含量是否和静脉移植一样稳定未进一步评估,且动员所需的时间偏长,在本实验中给予提前3天给药,有一定的局限性。静脉骨髓MSC移植技术操作上要求更高,优点是在SAP后可以及时注射,迅速提高并稳定外周血MSC浓度,节省动员等待期,在SAP早期即可发挥治疗作用,较骨髓动员更具临床治疗意义。另外,我们发现联合治疗组的实验结果优于单独治疗组,推测联合治疗不仅有利于促进MSC量的表达,甚至还可能与G-CSF同时动员其他类型干细胞有关。有研究显示,骨髓中存在CD34+的原始造血干细胞,具有更强大的自我更新和分化潜能,可能是HSC、MSC和EPC的共同谱系祖先,在一定微环境下可以转化为组织细胞[9]。通过本研究我们看到了骨髓干细胞对SAP胰腺损害保护作用确切,在SAP早期可提高胰腺细胞的凋亡及减少炎症介质的释放,以及在其他研究中证实的病理再生修复特性,使MSC极有可能成为治疗SAP的新希望。
1 江学良,李兆申,崔慧斐.骨髓间充质干细胞在胰腺生理更新和病理再生中的作用[J].世界华人消化杂志,2006,14(4):398-404
2 Scolding N,Marks D,Rice C.Autologous mesenchymal bone marrow stem cells:practical considerations[J].J Neurol Sci,2008,265(1 -2):111-115
3 Omary MB,Lugea A,Lowe AW,et al.The pancreatic stellate cell:a star on the rise in pancreatic diseases[J].J Clin Invest,2007,117(1):50-59
4 Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147
5 Kusser AM,Rongione AJ,Ashley SW,et al.Interleukin-10 prevents death in lethal necrosising pancreatitis in mice[J].Surgery,1999,120:284
6 Fortunato F,Bürgers H,Bergmann F,et al.Impaired autolysosome formation correlates with Lamp-2 depletion:role of apoptosis,autophagy,and necrosis in pancreatitis[J].Gastroenterology,2009,137:350 -360,360.e1 -360.e5
7 Gupta N,Su X,Popov B,et al.Intrapulmonary delivery of bone marrow-derived mesenchymal stem cells improves survival and attenuates endotoxin - induced acute lung injury in mice[J].J Immunol,2007,179(3):1855-1863
8 Lugea A,Nan L,French SW,et al.Pancreas recovery following cerulein-induced pancreatitis is impaired in plasminogen-deficient mice[J].Gastroenterology,2006,131:885 -899
9 姚巍,王凤芝.骨髓间充质细胞静脉移植联合自体骨髓干细胞动员对心肌病心力衰竭大鼠心功能的影响[J].中国组织工程研究与临床康复,2008,12(29):5645-5648

