原发性阴道恶性黑色素瘤的研究进展
杨莉 吴小华 程玺
复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海200032
女性生殖道恶性黑色素瘤是一种罕见的恶性肿瘤,占女性恶性肿瘤的0.4%~0.8%,占女性生殖系统恶性肿瘤的1%~3%,约占女性黑色素瘤的1.6%[1]。阴道恶性黑色素瘤居女性生殖道恶性黑色素瘤的第二位,约占阴道恶性肿瘤的3%[2]。阴道恶性黑色素瘤的恶性程度高,易发生复发转移,治疗效果差,预后不良,至今文献报道不足300例。
1 发病相关因素
恶性黑色素瘤是起源于神经嵴的弥散神经内分泌(amine precursor uptake and decarboxylation,APUD)细胞的恶性肿瘤,通常好发于皮肤,原发于黏膜者少见。3%的健康女性阴道黏膜基底层中能发现黑色素母细胞,这是由于黑色素细胞在迁移过程中错误地定植于阴道黏膜,从而成为阴道黑色素瘤的起源部位[3]。在大部分原发性黏膜黑色素瘤中,存在沿交界处扩散的黑色素细胞。
Curtin等[4]根据黑色素瘤的不同基因改变,将黑色素瘤分为4个类型:非慢性光损伤皮肤黑色素瘤、慢性光损伤皮肤黑色素瘤、黏膜黑色素瘤、肢端黑色素瘤。在非慢性光损伤皮肤黑色素瘤中,BRAF及NRAS的变异很常见,分别为59%及22%。其中80%的BRAF突变表现为缬氨酸被谷氨酸替代(V600E),16%表现为缬氨酸被赖氨酸替代(V600K)[5]。对于黏膜黑色素瘤(BRAF及NRAS的变异为11%及5%)、慢性光损伤的皮肤黑色素瘤(11%及15%)及肢端黑色素瘤(23%及10%),此种变异则较少见。在黏膜黑色素瘤中,发生KIT基因突变者占25%,在慢性光损伤皮肤黑色素瘤中占19%,在肢端黑色素瘤中占24%,而在非慢性光损伤皮肤黑色素瘤中未发现KIT变异[6]。总之,黏膜黑色素瘤的生长类似皮肤黑色素瘤中的结节型。
2 诊断
2.1 临床特征
阴道恶性黑色素瘤常见于60~70岁的绝经后女性,最常见的症状是阴道流血、排液和肿块。AJCC将早期征象归纳为A、B、C、D共4个特点:A(asymmetry)为不对称病变;B(irregularity)为边缘不规则;C(color variegation)为颜色多样;D (diameter enlarging)为直径增大。对阴道色素性病变出现上述早期征象时,应警惕恶性黑色素瘤。阴道恶性黑色素瘤常见于阴道下1/3[7]。30%~40%的病例具有多中心性。典型黑色素瘤存在黑色或棕色的色素沉着,易诊断。但有10%~23%是无色素性的[8]。当恶性黑色素瘤伴有溃疡与坏死或为无色素性者时易误诊,需联合免疫组化检测确诊。诊断原发性恶性黑色素瘤时,需进行全身皮肤及眼科检查,从而排除皮肤或眼部黑色素瘤。由于黑色素瘤具有易发生转移的特性,为排除转移灶的存在,需进行乳酸脱氢酶、胸片、MRI或PET/CT等检查。
2.2 病理组织学诊断
以往认为,肿瘤部分切取活检会加速恶性黑色素瘤的转移。Bong等[9]的大样本对照研究结果表明,恶性黑色素瘤的部分切取活检与完全切除活检的复发率及死亡率差异无统计学意义(P>0.05)。因此,当怀疑为恶性黑色素瘤时,应尽可能行完全切除活检;如有困难时,可在切取活检明确诊断后尽快行根治性手术切除。
2.3 免疫组化
采用特异性的免疫组化染色如S-100、HMB-45、Melan-A、酪氨酸激酶及MITF(小眼球相关转录因子)等可以帮助诊断及鉴别诊断[10]。S-100几乎在所有黑色素瘤细胞中表达,但特异性不高,而HMB-45、Melan-A及MITF特异性高,但有一定的假阴性率。联合使用这些抗原抗体诊断黑色素瘤可以提高诊断的准确性[11]。
3 分期
3.1 临床分期
阴道恶性黑色素瘤有多种分期方法,但最合适的分期方法尚未确定[12]。目前可采用的临床分期方法有:皮肤黑色素瘤的American Joint Committee on Cancer (AJCC) TNM分期及阴道癌的Internation al Federation of Gynecology and Obstetrics (FIGO)分期等。FIGO分期是目前较常用的分期标准,不足之处在于未考虑肿瘤大小与区域淋巴结转移情况,其与预后的关系还有待进一步探讨[8]。
3.2 镜下分期
由于阴道黏膜缺乏乳头层、真皮网状组织、皮下脂肪等结构,因此皮肤黑色素瘤的Clark分期及Chung等的改良分期方法不适合于阴道恶性黑色素瘤。Breslow分期对预后有意义,可用于早期阴道黑色素瘤的分期[12]。
4 治疗
阴道恶性黑色素瘤的治疗方法包括手术、放疗、化疗、免疫治疗及靶向治疗等。
4.1 手术治疗
手术是首选的治疗手段,可有效延长患者的生存期[8]。目前关于手术的争议在于手术范围的选择及区域淋巴结切除的问题。
4.1.1 手术范围
手术方式包括局部扩大切除术、广泛性手术及盆腔脏器去除术等多种方式。
有研究报道认为由于阴道恶性黑色素瘤的恶性程度高,局部复发率可高达80%,即使肿瘤极小也应行广泛性手术[2]。Geisler等[13]报道了肿瘤浸润深度>3 mm者行盆腔脏器去除术后的结果。其总3例患者在长期随访中未发现肿瘤复发或转移,9例未行盆腔脏器去除术的患者均在诊断后48个月内死亡。Van Nostrand等[14]报道4例行广泛性手术者2年生存率(75%)明显高于4例行局部性手术者(0%),并分析119例文献报道的病例后发现,50例广泛性手术患者2年生存率(48%)明显高于69例局部性手术患者(20%)。
但目前多数学者支持局部扩大切除术,认为初始治疗时就有微转移存在的可能,广泛性手术的作用不确定。局部扩大切除术不仅可获得良好的局部控制率,还可以减少广泛性手术导致的并发症[15]。Miner等[8]报道35例患者中,12例行广泛性手术,12例行局部扩大切除手术,两组中位无瘤生存期分别为12个月及10个月,差异无统计学意义(P>0.05)。Buchanan等[16]报道的Meta分析比较了生存期超过5年和未超过5年的患者的手术情况,行广泛性手术与局部扩大切除的患者比例差异无统计学意义(35% vs 33.3%,P>0.05)。Reid等[17]对31例行广泛性手术及24例行局部扩大切除术的患者进行Meta分析发现,总生存期及无瘤生存期差异无统计学意义(P>0.05,表1)。
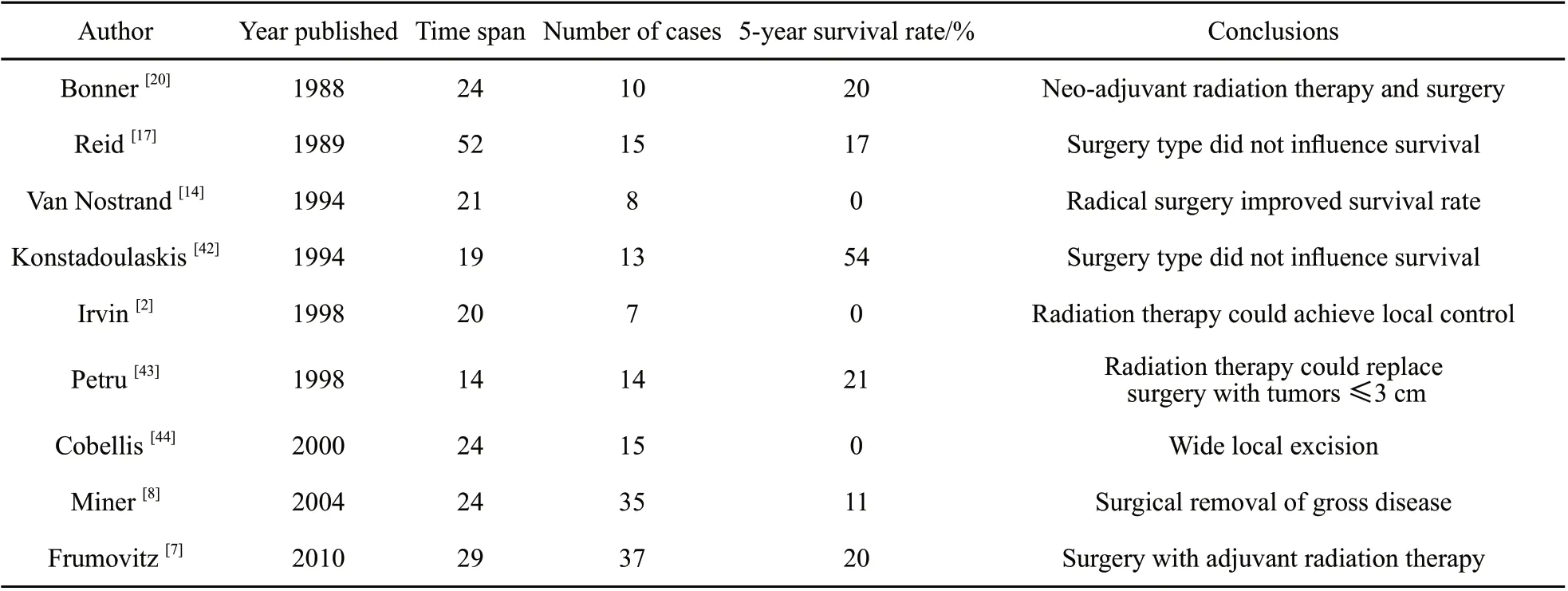
表1 阴道恶性黑色素瘤病例报道总结Tab.1 Case series of primary malignant melanoma of the vagina
4.1.2 区域性淋巴结清扫术
区域性淋巴结清扫术的价值仍存在着争议。支持者认为该术式是一个重要的分期手段,而且在微转移发展为临床肿大的淋巴结之前切除可以减少远处转移。反对者认为目前尚无随机临床试验表明预防性区域性淋巴结清扫对预后有意义,反而可能会增加并发症。Miner等[8]报道35例患者中26例行盆腔淋巴结切除术,只有2例(8%)患者发现淋巴结转移。由此,不必做常规区域性淋巴结切除活检。
Frumovitz等[7]报道,24例患者行区域性淋巴结切除,6例发现转移,其中5例在手术时已发现淋巴结肿大,认为预防性清扫淋 巴结的作用不确定。对复旦大学附属肿瘤医院收治的43例阴道恶性黑色素瘤患者回顾性分析结果显示,行盆腔淋巴结清扫的20例患者中4例发现转移,其中3例术中发现淋巴结肿大。单因素分析显示,盆腔淋巴结转移患者的总生存率显著低于未转移者。因此,如术中发现有可疑的转移淋巴结,应该 术中切除。
4.1.3 前哨淋巴结活检
前哨淋巴结活检不仅提高了分期的准确性,同时为手术时区域淋巴结切除范围提供依据。它准确易行,同时可减少不必要的区域淋巴结清扫导致的并发症[18]。但前哨淋巴结活检存在15%的假阴性率,因而当结果为阴性时应谨慎对待[19]。
4.2 放射治疗
既往认为恶性黑色素瘤是一种对放射抵抗的肿瘤,但随后发现,与以往常规分割放疗(分次剂量180 cGy)相比,采用 单次大剂量低分割放疗(>400 cGy/次)可获得更高的缓解率[20]。放疗适用于内科疾病不适宜手术的患者,手术切缘阳性者的辅助治疗或晚期患者的姑息性治疗[2,8,20]。
手术联合术后辅助放疗是一种有效的综合治疗方法。Frumovitz等[7]报道了20例患者行手术联合术后辅助放疗的结果,较对照组的13例单纯手术者,中位生存期延长了1 3个月。Irvin等[2]报道4例行单纯局部扩大切除术或单纯放疗患者均发生阴道复发,而另2例行局部扩大切除术联合放疗患者发生肺部转移,认为局部扩大切除术联合高剂量阴道放疗能提高局部控制率。
4.3 化学药物治疗
恶性黑色素瘤是一种高度恶性、易远处转移的肿瘤[21],有必要在初始治疗时采用手术联合化疗及生物治疗[22]。化疗及生物治疗也可用于发生复发或远处转移的晚期患者。
氮烯咪胺(dacarbazine,DTIC)是FDA批准用于治疗转移性黑色素瘤的有效化疗药物。DTIC与口服制剂替莫唑胺的有效率为15%,且作用持续时间不长,患者中位缓解期及生存期很少超过6和10个月[23]。其他可能有效的化疗药物包括亚硝基脲、长春碱类、博来霉素、铂类及紫杉醇类。目前尚无随机临床试验证实化疗在阴道恶性黑色素瘤治疗中的作用。临床常用的化疗方案包括CVD方案(氮烯咪胺+顺铂+长春碱类),DBD方案(氮烯咪胺+顺铂+亚硝基脲)及TP方案(紫杉醇联合铂类)[24-25]。2012年,NCCN治疗指南推荐用于治疗黑色素瘤化疗方案包括DTIC或替莫唑胺单药治疗,CVD方案,紫杉醇单药治疗或联合铂类治疗[26]。
4.4 免疫治疗
4.4.1 非特异性免疫治疗
干扰素(interferon,IFN)α2b是首个在随机临床试验中证实对进展期恶性黑色素瘤患者生存有益的药物。美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)在E1684试验中发现,在皮肤恶性黑色素瘤术后患者中,使用大剂量IFN-α2b 20 MIU/ m2,每日静脉注射治疗1个月后,改为每周3次皮下注射10 MIU/m2,治疗48周后与观察组比较,总生存期明显延长[27]。Meta分析显示,无论用药剂量、时间长短及剂型如何,IFN-α治疗均能延长术后患者的总生存期及无瘤生存期[24,28]。但在干扰素的使用方法上还存在着争议[29-30],有学者主张采用大剂量治疗并缩短治疗时间[31]。目前我们多采用干扰素300万单 位,隔日使用或1周2次,连续使用半年6个月以上。
白介素(interlukin,IL)IL-2是第1个在转移性黑色素瘤患者中能使部分患者获得长期临床缓解的免疫治疗药物。1998年,FDA批准高剂量重组IL-2用于转移性黑色素瘤的治疗,但目前尚未发现其能提高总生存率,且无Ⅲ期随机临床试验证实其作用。此外,还可采用IL-6、IL-10等细胞因子治疗,但均未发现能延长生存期[32]。目前肿瘤疫苗尤其是肽疫苗、抗原提呈树突状细胞,以及多种免疫药物的联合治疗等方面也正在研究中,疗效有待进一步证实[33]。
一系列在转移性黑色素瘤患者中采用化疗联合免疫治疗的研究表明:联合治疗与单纯化疗相比可提高缓解率,但未能延长生存期[34]。
4.4.2 特异性抑制性免疫受体阻断剂
细胞毒性T淋巴细胞抗原-4(cytotoxic T lymphocyte antigen,CTLA-4) 是调节T细胞抗肿瘤免疫应答的重要分子。T细胞活化后一过性表达CTLA-4, 其通过与抗原提呈细胞上的B7受体结合, 抑制淋巴细胞分泌IL-2,下调IL-2受体表达, 造成免疫耐受。
Ipilimumab是一种CTLA-4的人源化单克隆抗体,可竞争性抑制CTLA-4与B7结合, 提高T细胞调节下的抗肿瘤效应。2011年3月FDA批准其用于治疗无法手术的黑色素瘤患者。目前,有两个Ⅲ期临床试验被报道,第一个试验包括676例无法手术切除的初治失败的Ⅲ/Ⅳ期黑色素瘤患者,分为3组:Ipilimumab加gp100肽抗原治疗组、Ipilimumab加对照剂组及肽抗原加对照剂组。Ipi limumab剂量为3 mg/kg,4个疗程约10个月。研究显示Ipilimumab加gp100肽抗原治疗组患者及Ipilimumab加对照剂组患者中位总生存期分别为10及10.1个月,较肽抗原加对照剂组患者延长6.4个月。Ipilimumab加gp100肽抗原治疗组及Ipilimumab加对照剂组1年总生存率为44%~46%,而肽抗原加对照剂组1年总生存率为25%[35]。第二个试验采用Ipilimumab联合DTIC(Ipilimumab组)或DTIC联合对照剂(对照组)治疗502例初治的进展期黑色素瘤患者,Ipilimumab治疗剂量为10 mg/kg,采用4个周期的诱导剂量后改用维持剂量治疗。尽管局部缓解率两组差异无统计学意义(P>0.05),但Ipilimumab组较对照组总生存期延长(11.2 vs 9.1个月)[36]。目前FDA批准Ipilimumab用于治疗黑色素瘤剂量为3 mg/kg,每3周1个疗程,共4个疗程。
4.5 靶向治疗
用于治疗黑色素瘤的靶向治疗药物主要包括致癌途径抑制剂和抗凋亡蛋白抑制剂等。
丝裂原激活蛋白激酶通路途径(mitogenactivated protein kinase,MAPK)激活后在黑色素瘤发生发展过程中起重要作用。MAPK通路下游效应因子BRAF突变在黑色素瘤患者中很常见,针对BRAF的特异性抑制剂Vemurafenib (RG7204/PLX4032)在黑色素瘤的靶向治疗中有效。Ⅰ期临床试验表明,PLX4032在发生BRAF V600E突变的患者中能获得81%的缓解率[37]。Ⅲ期临床试验中,在初始未治疗的发生BRAF V600E突变的进展性黑色素瘤患者中采用Vemurafenib或DTIC治疗。结果显示,Vemurafenib组缓解率为48%,DTIC组缓解率为5%[38]。在2011年国际黑色素瘤会议上,此试验研究结果表明Vemurafenib组6个月总生存率为83%,DTIC组为63%[39]。2011年,FDA批准了Vemurafenib用于治疗进展期黑色素瘤。
GSK2118436(GSK436)是另一个研究较多的BRAF抑制剂。2011年国际黑色素瘤会议中的报道表明,GSK436在BRAF V600E突变患者中缓解率为59%,V600K突变中缓解率为13%,6个月总生存期分别为75%及69%[40]。GSK436在V600E、K、G突变中均可发挥作用,较Vemurafenib拥有更广泛的适应证。其余针对MAPK途径中MEK等效应因子的抑制剂,如AZD6244、GSK1120212 (GSK212)也正在研究中[41]。
值得注意的是,黏膜黑色素瘤患者中BRAF突变并不常见,而发生KIT突变者较多。KIT是一种Ⅲ型酪氨酸激酶受体,其激活后可导致多种信号通路的激活(如MAPK/MEK、PI3K/AKT、JAK/STAT等)。伊马替尼是一种KIT的小分子抑制剂,在发生KIT突变或KIT表达增加的进展性黑色素瘤患者中有效[6]。伊马替尼推荐使用剂量为每日400 mg。
5 预后及相关因素
阴道恶性黑色素瘤5年生存率约为25%[15]。肿瘤大小、淋巴结转移、镜下有丝分裂细胞数量等是重要预后因素。Buchanan等[16]报道的Meta分析结果表明,肿瘤最大径<3 cm者中位生存期(41个月)明显长于>3 cm者(12个月),当肿瘤厚度<6 mm时,无瘤生存期明显延长,但总生存期无延长。未发现年龄、肿瘤位置、细胞类型、有无色素、溃疡等与预后相关。
6 总结
阴道恶性黑色素瘤是预后极差的一种罕见的高度恶性的肿瘤。影响预后的因素包括肿瘤大小及厚度、是否行手术治疗、淋巴结转移情况、镜下有丝分裂细胞数量等。
综合治疗在改善患者预后中发挥着重要作用。手术是早期患者首选治疗方法,术后可联合放疗、化疗、免疫或靶向治疗;免疫及靶向治疗在晚期患者中的前景值得期待。个体化靶向治疗的高效低毒为治疗提供了新的思路,最佳的治疗方案有待进一步的临床研究证实。
[1]曹泽毅, 主编.中华妇产科学(下册)[M]2版.1999:2069.
[2]IRVIN W P, BLISS S A, RICE L W, et al.Malignant melanoma of the vagina and locoregional control: Radical surgery revisited[J].Gynecol Oncol, 1998,71(3):476-480.
[3]GOKASLAN H, SISMANOGLU A, PEKIN T, et al.Primary malignant melanoma of the vagina: a case report and review of the current treatment options[J].Eur J Obstet Gynecol Reprod Biol, 2005,121(2):243-248.
[4]CURTIN J A, FRIDLYAND J, KAGESHITA T, et al.Distinct sets of genetic alterations in melanoma[J].N Engl J Med, 2005,353(20):2135-2147.
[5]RUBINSTEIN J C, SZNOL M, PAVLICK A C, et al.Incidence of the V600K mutation among melanoma patients with BRAF mutations, and potential therapeutic response to the specific BRAF inhibitor PLX4032[J].J Transl Med, 2010,8:67.
[6]CARVAJAL R D, ANTONESCU C R, WOLCHOK J D, et al.KIT as a therapeutic target in metastatic melanoma[J].JAMA, 2011,305(22):2327-2334.
[7]FRUMOVITZ M, ETCHEPAREBORDA M, SUN C C, et al.Primary malignant melanoma of the vagina[J].Obstet Gynecol, 2010,116(6):1358-1365.
[8]MINER T J, DELGADO R, ZEISLER J, et al.Primary vaginal melanoma: A critical analysis of therapy[J].Ann Surg Oncol, 2004,11(1):34-39.
[9]BONG J L, HERD R M, HUNTER J A A.Incisional biopsy and melanoma prognosis[J].J Am Acad Dermatol, 2002,46(5):690-694.
[10]张梅芳, 向锦, 符珈, 等.女性原发性生殖道恶性黑色素瘤的临床病理特征及预后分析[J].中华肿瘤防治杂志, 2010(14):1119-1122.
[11]CARLSON J A, ROSS J S, SLOMINSKI A, et al.Molecular diagnostics in melanoma[J].J Am Acad Dermatol, 2005,52(5):743-775.
[12]PIURA B.Management of primary melanoma of the female urogenital tract[J].Lancet Oncol, 2008,9(10):973-981.
[13]GEISLER J P, LOOK K Y, MOORE D A, et al.Pelvic exenteration for malignant melanomas of the vagina or urethra with over 3 mm of Invasion[J].Gynecol Oncol, 1995,59(3):338-341.
[14]VAN NOSTRAND K M, LUCCI J R, SCHELL M, et al.Primary vaginal melanoma: improved survival with radical pelvic surgery[J].Gynecol Oncol, 1994,55(2):234-237.
[15]TCHEUNG W J, SELIM M A, HERNDON J N, et al.Clinicopathologic study of 85 cases of melanoma of the female genitalia[J].J Am Acad Dermatol, 2012: epub ahead of print.
[16]BUCHANAN D J, SCHLAERTH J, KUROSAKI T.Primary vaginal melanoma: Thirteen-year disease-free survival after wide local excision and review of recent literature[J].Am J Obstet Gynecol, 1998,178(6):1177-1183.
[17]REID G C, SCHMIDT R W, ROBERTS J A, et al.Primary melanoma of the vagina - a clinicopathologic analysis[J].Obstet Gynecol, 1989,74(2):190-199.
[18]PHAN G Q, MESSINA J L, SONDAK V K, et al.Sentinel lymph node biopsy for melanoma: indications and rationale[J].Cancer Control, 2009,16(3):234-239.
[19]DHAR K K, DAS N, BRINKMAN D A, et al.Utility of sentinel node biopsy in vulvar and vaginal melanoma: report of two cases and review of the literature[J].Int J Gynecol Cancer, 2007,17(3):720-723.
[20]BONNER J A, PEREZTAMAYO C, REID G C, et al.The management of vaginal melanoma.[J].Cancer, 1988,62(9):2066-2072.
[21]LIN L T, LIU C B, CHEN S N, et al.Primary malignant melanoma of the vagina with repeated local recurrences and brain metastasis[J].J Chin Med Assoc, 2011,74(8):376-379.
[22]安菊生, 吴令英, 李宁, 等.生殖系统原发性恶性黑色素瘤42例临床分析[J].中华妇产科杂志, 2007,42(5):320-324.
[23]GARBE C, PERIS K, HAUSCHILD A, et al.Diagnosis and treatment of melanoma: European consensusbased interdisciplinary guideline[J].Eur J Cancer, 2010,46(2):270-283.
[24]GARBE C, EIGENTLER T K, KEILHOLZ U, et al.Systematic review of medical treatment in melanoma: current status and future prospects[J].Oncologist, 2011,16(1):5-24.
[25]YI J H, YI S Y, LEE H R, et al.Dacarbazine-based chemotherapy as first-line treatment in noncutaneous metastatic melanoma: multicenter, retrospective analysis in Asia[J].Melanoma Res, 2011,21(3):223-227.
[26]NCCN.The NCCN melanoma clinical practice guidelines in oncology (version 2.2012)[EB/OL].http://www.nccn.org/professionals/physician_gls/f_guidelines.asp#melanoma.
[27]KIRKWOOD J M, STRAWDERMAN M H, ERNSTOFF M S, et al.Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684[J].J Clin Oncol, 1996,14(1):7-17.
[28]MOCELLIN S, PASQUALI S, ROSSI C R, et al.Interferon alpha adjuvant therapy in patients with high-risk melanoma: a systematic review and meta-analysis[J].J Natl Cancer Inst, 2010,102(7):493-501.
[29]GARBE C, RADNY P, LINSE R, et al.Adjuvant low-dose interferon {alpha}2a with or without dacarbazine compared with surgery alone: a prospective-randomized phase Ⅲ DeCOG trial in melanoma patients with regional lymph node metastasis[J].Ann Oncol, 2008,19(6):1195-1201.
[30]EGGERMONT A M, GORE M.Randomized adjuvant therapy trials in melanoma: surgical and systemic[J].Semin Oncol, 2007,34(6):509-515.
[31]PECTASIDES D, DAFNI U, BAFALOUKOS D, et al.Randomized phase Ⅲ study of 1 month versus 1 year of adjuvant high-dose interferon alfa-2b in patients with resected high-risk melanoma[J].J Clin Oncol, 2009,27(6):939-944.
[32]ALEXANDRESCU D T, ICHIM T E, RIORDAN N H, et al.Immunotherapy for melanoma: current status and perspectives[J].J Immunother, 2010,33(6):570-590.
[33]SCHWARTZENTRUBER D J, LAWSON D H, RICHARDS J M, et al.gp100 peptide vaccine and interleukin-2 in patients with advanced melanoma[J].N Engl J Med, 2011,364(22):2119-2127.
[34]BAJETTA E, DEL V M, NOVA P, et al.Multicenter phase Ⅲ randomized trial of polychemotherapy (CVD regimen) versus the same chemotherapy (CT) plus subcutaneous interleukin-2 and interferon-alpha2b in metastatic melanoma[J].Ann Oncol, 2006,17(4):571-577.
[35]HODI F S, O’DAY S J, MCDERMOTT D F, et al.Improved survival with ipilimumab in patients with metastatic melanoma[J].N Engl J Med, 2010,363(8):711-723.
[36]ROBERT C, THOMAS L, BONDARENKO I, et al.Ipilimumab plus dacarbazine for previously untreated metastatic melanoma[J].N Engl J Med, 2011,364(26):2517-2526.
[37]FLAHERTY K T, PUZANOV I, KIM K B, et al.Inhibition of mutated, activated BRAF in metastatic melanoma[J].N Engl J Med, 2010,363(9):809-819.
[38]CHAPMAN P B, HAUSCHILD A, ROBERT C, et al.Improved survival with vemurafenib in melanoma with BRAF V600E mutation[J].N Engl J Med, 2011,364(26):2507-2516.
[39]HAUSCHILD A, MCARTHUR G A, ROBERT C.Vemurafenib improves overall survival compared to dacarbazine in advanced BRAFV600E-mutated melanoma: An update from the Phase Ⅲ randomized, open-label, multicenter BRIM3 trial[Z].2011 International Melanoma Congress.Pigment Cell Melanoma Res, 2011: 24, 1021.
[40]TREFZER U, MINOR D, RIBAS A.BREAK-2: a Phase IIA trial of the selective BRAF kinase inhibitor GSK2118436 in patients with BRAF mutation-positive (V600E/K) metastatic melanoma[Z].2011 International Melanoma Congress.Pigment Cell Melanoma Res, 2011: 24, 1020.
[41]KIRKWOOD J M, BASTHOLT L, ROBERT C, et al.Phase II, open-label, randomized trial of the MEK1/2 inhibitor selumetinib as monotherapy versus temozolomide in patients with advanced melanoma[J].Clin Cancer Res, 2012,18(2): 555-567.
[42]KONSTADOULAKIS M M, RICANIADIS N, DRISCOLL D L, et al.Malignant melanoma of the female genital system[J].Eur J Surg Oncol, 1994, 20(2): 141-145.
[43]PETRU E, NAGELE F, CZERWENKA K, et al.Primary malignant melanoma of the vagina: Long-term remission following radiation therapy[J].Gynecol Oncol, 1998, 70(1): 23-26.
[44]COBELLIS L, CALABRESE E, STEFANON B, et al.Malignant melanoma of the vagina.A report of 15 cases[J].Eur J Gynaecol Oncol, 2000, 21(3): 295-297.

