DhHP-6延长秀丽线虫寿命的作用机制
王丽萍, 金 鑫, 黄 磊, 李鹏飞, 王立成
(1. 吉林大学 生命科学学院, 长春 130012; 2. 吉林大学 化学学院, 长春 130012)
DAF-16(abnormal dauer formation-16)是叉头转录因子FOXO在秀丽线虫体内的同源蛋白, 可调节秀丽线虫寿命[1-2]. DAF-16蛋白在正常情况下位于细胞质中, 可在不同胁迫条件下被信号蛋白激活, 从细胞质转移至细胞核中, 提高秀丽线虫的应激能力, 延长秀丽线虫在胁迫环境下的寿命[3]. DAF-16下游的sod-3以活性氧自由基(reactive oxygen species, ROS)为底物, 将对细胞产生损伤的物质转化为更安全的化合物, 其活性与秀丽线虫过氧化损伤引起的衰老情况相关[4].sod-3转录受DAF-16调控, 因此可将SOD-3表达量作为DAF-16转录活性的检测指标.
次血红素六肽(deuterohaemin-Ala-His-Thr-Val-Glu-Lys, DhHP-6)为吉林大学生物大分子研究室设计合成的一种抗坏血酸过氧化物酶(APX)的新型模拟酶[5]. DhHP-6可延长野生型秀丽隐杆线虫平均寿命, 提高秀丽线虫的耐热和抗氧化损伤等应激能力[6-7]. 本文通过上调秀丽线虫体内某些信号通路中一系列抗胁迫基因的表达量, 清除了自由基, 从而延长了秀丽线虫寿命.
1 实验材料与方法
野生型秀丽线虫(N2)、 TJ356(DAF-16∷GFP)突变体秀丽线虫、 CF1038(daf-16缺失)突变体秀丽线虫、 CF1553(SOD-3∷GFP)突变体秀丽线虫和大肠杆菌OP50.
DhHP-6由吉林大学生物大分子研究室自主固相肽合成; DCFH-DA为美国SIGMA公司产品; 胰蛋白胨、 琼脂和粉酵母抽提物均为北京鼎国生物工程公司产品; 胆固醇、 氯化钠、 硫酸镁、 氯化钙、 无水乙醇和氢氧化钠等试剂均为国产分析纯.
1.1 秀丽线虫的培养方法 秀丽线虫以一种特殊的尿嘧啶缺陷型大肠杆菌OP50(E.coliOP50)为食, 该菌株在秀丽线虫NGM培养基上生长缓慢, 可保证秀丽线虫有稳定的食物供给.
在细菌培养板(LB)上挑取单菌落至5 mL的LB液体培养基中, 于37 ℃ 170 r/min振荡培养8~12 h, OD600=0.4~0.6. 吸取适量的菌液(350 μL/90 mm平板)滴于NGM培养基上, 用灭菌的涂布棒均匀涂抹于NGM培养基的中间部位. 涂抹面积约占总表面积的20%~50%, 以防止秀丽线虫爬到器壁边缘而不易操作和观察. 涂抹完毕后室温放置至菌液被NGM完全吸收, 转到20 ℃的无菌培养箱中培养48 h, 使菌长成薄薄的一层, 供秀丽线虫食用.
1.2 秀丽线虫寿命的测定方法 使用固体培养基培养秀丽线虫. 挑取单个同期化培养至L4期雌雄同体的秀丽线虫至涂有OP50菌液的NGM培养基上, 20 ℃培养. 在产卵期内, 需每日将秀丽线虫挑取到新的培养基以防止幼虫过多影响成虫的生长; 产卵期过后改为每2~3 d换一次. 以秀丽线虫卵孵化为起始, 以末端刺激无生命活动记为秀丽线虫死亡, 秀丽线虫寿命期记为从起始到死亡的时间, 分别记录各实验组秀丽线虫寿命情况.
1.3 DAF-16的GFP荧光显微检测及SOD-3的荧光定量检测 分别挑取30只产卵期的TJ356和CF1553秀丽线虫至直径90 mm涂有OP50的NGM平板上, 产卵3 h, 将成虫移走, 完成秀丽线虫的同期化. 产完卵的平板于20 ℃培养4 d. 分别挑取TJ356和CF1553秀丽线虫成虫(表现为扭曲或滚筒性爬动)进行分组, 并用DhHP-6进行给药处理, 将处理生长时间为6 d的秀丽线虫进行压片观察.
先分别将DAF-16∷GFP和SOD-3∷GFP秀丽线虫模型用左旋咪唑麻醉, 再分别用质量分数为1%的琼脂制片, 挑到载片上, 每片15~20只, 滴加M9缓冲溶液20~50 μL, 加盖玻片, 压片. 用共聚焦激光扫描荧光显微镜检测TJ356秀丽线虫DAF-16的GFP荧光; 用荧光酶标仪检测CF1553秀丽线虫的GFP绿色荧光强度.
1.4 DCF法检测ROS 同期培养至L4期的野生型N2秀丽线虫, 挑取单个雌雄同体的秀丽线虫至涂有OP50菌液的NGM培养基上, 于20 ℃培养4 d, 进行分组, 并用DhHP-6进行给药处理, 将处理培养时间分别为4,6,8 d的秀丽线虫进行荧光强度检测.
将5 mg DCFH-DA用DMSO配置为1 mmol/L的储液, 并于-20 ℃分装避光储存, 备用. 向96孔酶标板每孔加入200 μL的M9缓冲溶液, 将成年秀丽线虫挑入96孔酶标板, 每孔30只, 每组平行3孔, 加入DCF使其浓度为10 μmol/L, 在室温避光条件下培养30 min后, 使用荧光酶标法测定DCF的荧光强度, 进而确定ROS的浓度.
1.5 数据分析 使用Graphpad Prism 5.0及Origin 6.0数据处理软件对实验数据进行分析处理.
2 结果与讨论
2.1 DhHP-6对秀丽线虫寿命的影响 挑取单个同期培养至L4期雌雄同体的秀丽线虫至涂有OP50菌液的NGM培养基上, 于20 ℃培养4 d, 将秀丽线虫分为对照组和100 μmol/L浓度DhHP-6给药组继续培养. 以秀丽线虫卵孵化为起始, 以末端刺激无生命活动记为秀丽线虫死亡, 秀丽线虫寿命期为起始到死亡的时间. 选择N2野生型秀丽线虫及CF1038缺陷型秀丽线虫进行研究.
表1列出了20 ℃下DhHP-6对秀丽线虫寿命的影响. 由表1可见, 100 μmol/L DhHP-6可延长野生型秀丽线虫寿命, 野生型平均寿命为(16.2±0.53)d, 最大寿命为26 d. 给药后, 秀丽线虫平均寿命为(19.7±0.26)d, 最大寿命为27 d, 延长秀丽线虫平均寿命为21%. DAF-16缺陷的CF1038型秀丽线虫平均寿命为(12.8±0.51)d, 给药后, CF1038秀丽线虫平均寿命为(11.2±0.49)d.

表1 20 ℃下DhHP-6对秀丽线虫寿命的影响
*与对照组相比存在显著差异,p<0.001; **与对照组相比存在显著差异,p<0.01.
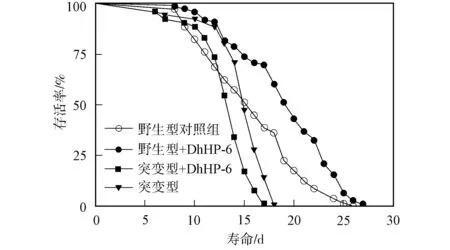
图1 DhHP-6对秀丽线虫寿命的影响Fig.1 Effect of DhHP-6 on C.elegans lifespan
DhHP-6对秀丽线虫寿命的影响如图1所示. 由图1可见, 野生型秀丽线虫给药前后的生存曲线不同, 表明100 μmol/L的DhHP-6可延长野生型秀丽线虫的寿命, 但未影响CF1038缺陷性秀丽线虫的寿命, 即DhHP-6延长秀丽线虫寿命的机制与DAF-16有关.
2.2 DAF-16细胞核定位 DAF-16正常情况下位于细胞质中, 在胁迫环境下被不同的蛋白激活, 进入细胞核行使转录因子功能, 启动下游基因表达, 从而提高秀丽线虫应激能力, 延长秀丽线虫在胁迫环境下的寿命. 绿色荧光蛋白(GFP)在特定波长激发下可产生绿色荧光, 本文通过DAF-16与GFP融合表达的TJ356缺陷性秀丽线虫进行DAF-16细胞核定位实验, 研究DhHP-6调节DAF-16延长秀丽线虫寿命的分子机制. DAF-16细胞核定位实验结果如图2所示. 由图2可见, DhHP-6给药组秀丽线虫体内出现了明显的DAF-16入核现象, 对照组并无明显入核现象. 表明DHhP-6可促进DAF-16入核, 即DhHP-6延长秀丽线虫寿命的作用机制与DAF-16密切相关.
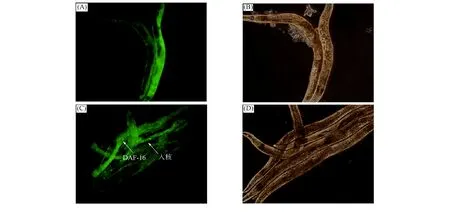
(A) 对照组秀丽线虫暗场荧光; (B) 对照组秀丽线虫明场荧光;(C) DhHP-6给药组秀丽线虫暗场荧光; (D) DhHP-6给药组秀丽线虫明场荧光.图2 DAF-16细胞核定位Fig.2 DAF-16 nucleic translocation
2.3 DAF-16的转录活性测定 通过SOD-3与GFP绿色荧光蛋白融合表达的突变体秀丽线虫CF1553对SOD-3表达荧光强度进行测定.sod-3作为daf-16下游基因, 其转录受DAF-16调控, 可以用sod-3表达量作为DAF-16转录活性检测指标, 确定DhHP-6对DAF-16转录活性的影响, 如图3所示. 由图3可见, DhHP-6给药组CF1553秀丽线虫体内绿色荧光强度显著增高, SOD-3表达量显著上调. 表明DhHP-6通过激活DAF-16入核, 提高了DAF-16转录活性, 促进了DAF-16下游基因sod-3表达, 提高了SOD-3表达量, 从而引发秀丽线虫体内一系列的生理生化反应, 延长了秀丽线虫寿命.
2.4 秀丽线虫体内ROS的测定 使用DCF法测定秀丽线虫体内ROS浓度的变化情况, 结果如图4所示. 由图4可见, 秀丽线虫体内的ROS随培养时间的增加而增加; 与对照组秀丽线虫相比, DhHP-6给药组秀丽线虫ROS上升幅度明显减慢; DhHP-6给药喂食培养6,10,14 d的秀丽线虫与对照组相比体内ROS水平明显降低. DhHP-6通过启动DAF-16, 促进了SOD-3表达, 有效清除了秀丽线虫体内ROS, 从而延长了秀丽线虫寿命.

图3 SOD-3表达荧光强度测定Fig.3 Fluorescence measurement of SOD-3 fused with GFP
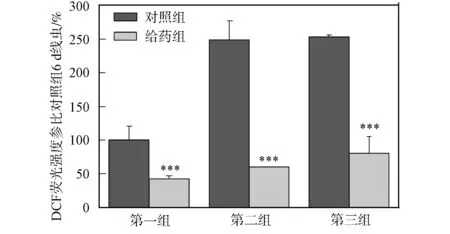
第一组培养6 d; 第二组培养10 d; 第三组培养14 d.图4 秀丽线虫体内ROS水平测定Fig.4 Measurement of ROS level in vivo of C.elegans
综上所述, 本文以秀丽线虫为模型生物, 考察了DhHP-6给药前后对秀丽线虫寿命的影响及相关机制, 并测定了DAF-16相关的生理生化指标. 结果表明: DhHP-6给药可延长秀丽线虫寿命, 平均可延长寿命21%, 该寿命延长作用机制与DAF-16因子相关, DhHP-6不影响daf-16缺失型秀丽线虫寿命; DhHP-6可促进DAF-16进入细胞核, 发挥转录活性; DhHP-6给药可提高DAF-16转录活性, 促进下游基因sod-3表达量增加; DhHP-6给药组秀丽线虫体内ROS水平显著降低且ROS积累速度减慢.
[1] Berdichevsky A, Guarente L. A Stress Response Pathway Involving Sirtuins, Forkheads and 14-3-3 Proteins [J]. Cell Cycle, 2006, 5(22): 2588-2591.
[2] Berdichevsky A, Viswanathan M, Horvitz H, et al.C.elegansSIR-2.1 Interacts with 14-3-3 Proteins to Activate DAF-16 and Extend Lifespan [J]. Cell, 2006, 125(6): 1165-1177.
[3] Murphy C T. The Search for DAF-16/FOXO Transcriptional Targets: Approaches and Discoveries [J]. Experimental Gerontology, 2006, 41(10): 910-921.
[4] Honda Y, Honda S. Thedaf-2 Gene Network for Longevity Regulates Oxidative Stress Resistance and Mn-Superoxide Dismutase Gene Expression inCaenorhabditiselegans[J]. The FASEB Journal, 1999, 13(11): 1385-1393.
[5] GUAN Shu-wen, LI Peng-fei, LUO Jing, et al. A Deuterohemin Peptide Extends Lifespan and Increases Stress Resistance inCaenorhabditiselegans[J]. Free Radic Res, 2010, 44(7): 813-820.
[6] GUAN Shu-wen. Study on the Molecular Mechanisms of Peroxidase Mimetic DhHP-6 on Extending Lifespan inCaenorhabditiselegans[D]: [Ph D Thesis]. Changchun: Jilin University, 2007. (关树文. 过氧化物酶模拟物DhHP-6在秀丽线虫中的抗衰老作用机制的研究 [D]: [博士学位论文]. 长春: 吉林大学, 2007.)
[7] WANG Li-ping, LIU Ya-li, YANG Hui, et al. Synthesis and Anti-cataract Activity of a Novel Peroxidase Mimetics [J]. Chemical Journal of Chinese Universities, 2004, 25(11): 2171-2173. (王丽萍, 刘亚丽, 杨卉, 等. 一个新的过氧化物酶模拟物的合成及抗白内障活性研究 [J]. 高等学校化学学报, 2004, 25(11): 2171-2173.)

