甘草次酸长循环固体脂质纳米粒的制备与体外性能研究
王 炯,周小菊,胡先明(.武汉大学药学院,武汉 43007;2.武汉远大弘元股份有限公司,武汉430070)
甘草次酸(Glycyrrhetinic acid,GA)系甘草的主要成分甘草酸加水分解而来,也是甘草酸体内的活性代谢产物[1],是一种五环三萜类化合物。GA又称甘草亭酸,分子式为C30H46O4,白色针状晶体,熔点289~291℃。现代研究表明,GA除具有抗炎、抗溃疡、抗过敏、抗病毒、降血脂、止咳、平喘、止痛等作用外,还具有抗肿瘤增生的作用[2,3]。近几年研究发现,GA对鼠肝细胞癌、艾氏腹水癌、皮肤癌、恶性黑色素瘤、人乳腺癌细胞、人肝癌细胞、人白血病细胞、艾滋病病毒等均有显著的抑制作用[4~7]。由于GA为水不溶性化合物,口服后体内吸收差,生物利用度低,且个体差异性大,故开发GA的靶向制剂用于癌症的治疗已引起了广大医药工作者的广泛关注。
固体脂质纳米粒(Solid lipid nanoparticles,SLN)是20世纪90年代初发展起来的一类新型给药系统,它是将药物包载于类脂核中形成的粒径在50~1000nm之间的胶体给药系统。SLN具有稳定性好、药物载药量高,同时又具有脂质体的毒性低,能大规模生产等优点[8]。为了延长纳米粒在体内的作用时间,通常可以对纳米粒进行聚乙二醇(PEG)修饰,增加其表面亲水性,形成立体位阻,使纳米粒躲过单核巨噬细胞系(MPS)的识别,使其在血液循环中滞留时间延长[9]。长循环固体脂质纳米粒(Long circulating solid lipid nanoparticles,LSLN)可起到缓释、靶向、提高GA生物利用度等作用。本研究选用甲氧基聚乙二醇-磷脂酰乙醇胺(mPEG-DSPE)对SLN进行PEG修饰,制备GA的长循环固体脂质纳米粒(GA-LSLN),并对其理化性质、体外释放性能和细胞毒性进行考察。
1 仪器与材料
1.1 仪器
AR2130型电子天平(沈阳杰龙仪器有限公司);DF-101 S型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);RE-52型旋转蒸发仪(上海亚荣生化仪器厂);AH110 D型高压匀质机(加拿大ATS工业系统公司);高效液相色谱(HPLC)仪(大连江申分离科学技术公司);BI-200 SM型动态光散射粒径分布/Zeta电位测定仪(美国Brookhaven公司);Sunrise型酶标仪(澳大利亚Tecan公司)。
1.2 试药
GA原料药(上海融禾医药科技发展有限公司);GA对照品(中国食品药品检定研究院,批号:110723-200612);地塞米松注射液(DEXA,上海抚生实业有限公司,批号:101109);硬脂酸(西安悦来医药科技有限公司);大豆磷脂(上海太伟药业有限公司);泊络沙姆188(德国BASF公司);mPEG-DSPE(日本油脂株式会社);水(二次重蒸水,笔者自制);epharose CL-4 B凝胶柱(英国GE healthcare集团);甲醇、乙腈、乙酸乙酯和N,N-二甲基甲酰胺为色谱纯,其余试剂均为分析纯。
1.3 细胞
肝癌SK-Hep-1细胞系和急性髓细胞白血病MV 4-11细胞系,用含10%胎牛血清RPMI 1640培养液,置于37℃、5%CO2饱和湿度培养箱中培养。
2 方法与结果
2.1 GA-LSLN的制备
称取适量大豆磷脂、硬脂酸、mPEG-DSPE和GA,加入少量乙醇使其溶解,在搅拌状态下将有机相注入至60℃水相中,充分搅拌30 min,置于旋转蒸发仪中进一步挥发有机溶剂,经过高压匀质机循环匀质3~5次后,室温放冷,过0.45µm滤膜,即得GA-LSLN胶体溶液,该胶体溶液呈半透明状、有蓝色乳光;同时按相同方法制备空白LSLN胶体溶液。
2.2 GA-LSLN形态、粒径、表面电位的测定
取少量GA-LSLN胶体溶液,以蒸馏水稀释至适宜浓度,吸取2滴,用2%磷钨酸钠负染,以透射电镜观察其形态及分布;用粒度测定仪测定纳米粒粒径大小,用Zeta电位测定仪测定其Zeta电位。结果显示,GA-LSLN粒径大小均匀,平均粒径为130.1 nm,Zeta电位为-36.2 mV。GA-LSLN透射电镜见图1;GA-LSLN粒径分布见图2。
2.3 含量测定方法的建立
2.3.1 GA含量测定方法
参考有关文献[10],选用HPLC法测定GA含量。色谱条件:色谱柱为ODS C18柱(250mm×4.6mm,5µm),流动相为甲醇-水-冰醋酸(89∶10∶1),流速为1 mL·min-1,检测波长为250 nm,柱温25℃,进样量为20µL。
2.3.2 专属性试验 分别取处方量配比的空白LSLN、GA-LSLN和GA对照品适量,用流动相溶解后按“2.3.1”项下色谱条件进样测定。结果表明,SLN辅料对GA含量测定无干扰。色谱见图3。

图1 GA-LSLN透射电镜图Fig 1TEM of GA-LSLN

图2 GA-LSLN粒径分布图Fig 2 Distribution of particle size of GA-LSLN
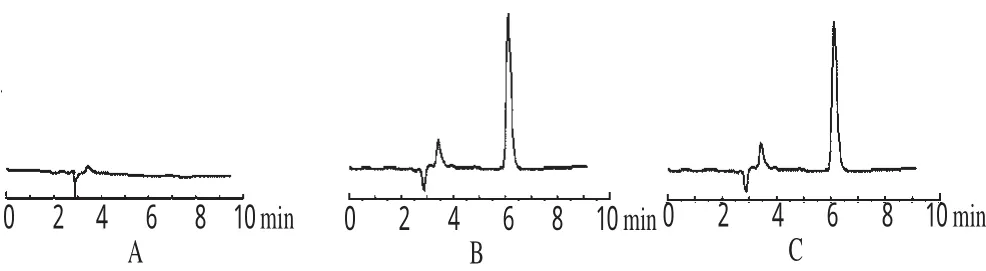
图3 高效液相色谱图Fig 3 HPLC chromatograms
2.3.3 标准曲线的制备 精密称取GA对照品适量,以1.0%NH3·H2O-甲醛(2∶8)溶液先制备成1 mg·mL-1的GA贮备液。精密吸取GA贮备液,以1.0%NH3·H2O-甲醛(2∶8)溶液制备成浓度为1、2、10、20、40、80µg·mL-1的溶液,按“2.3.1”项下色谱条件测定各浓度下溶液的峰面积。以GA浓度(c)为横坐标,峰面积积分值(Y)为纵坐标,进行线性回归,得回归方程为Y=67006c+7762.7(r=0.9996)。结果表明,GA浓度在1~80µg·mL-1范围内与峰面积积分值呈良好线性关系。检测限(信号S和噪声N的比值(S/N)=3)为0.01µg·mL-1。
2.3.4 精密度试验 精密量取GA贮备液2、40、80 μL,分别置于10 mL量瓶中,加流动相稀释至刻度,摇匀,制备成2、40、80 μg·mL-1的低、中、高浓度溶液,每个浓度分别进样5次。按“2.3.1”项下色谱条件测定,计算日内精密度和日间精密度(5 d)。结果,日内RSD分别为1.07%、0.59%、0.41%(n均为5),日间RSD分别为2.51%、0.74%、0.54%(n均为5),表明仪器精密度良好。
2.3.5 重复性试验 精密量取自制同一批GA-LSLN适量,共6份,分别置于100mL容量瓶中,加流动相至刻度,摇匀,按“2.3.1”项下色谱条件测定。结果,RSD为0.25%(n=6),表明方法重复性良好。
2.3.6 稳定性试验 精密量取自制同一批GA-LSLN适量,共3份,置100 mL容量瓶中,加流动相至刻度,摇匀,制备成2、40、80 μg·mL-1的低、中、高浓度溶液,于4℃贮藏。按“2.3.1”项下色谱条件分别测定1、2、4、6、10、14、22、30d后的峰面积。结果,低、中、高浓度的RSD分别为1.03%、0.78%、0.81%(n均为8),表明GA-LSLN在4℃下30 d内稳定。
2.3.7 加样回收率试验 精密量取空白LSLN溶液1 mL,共9份,分别置于10 mL量瓶中,分别精密加入浓度为1 mg·mL-1的贮备液,加流动相稀释至刻度。按“2.3.1”项下色谱条件测定,计算加样回收率。结果,平均回收率为(99.72±0.24)%(n=9)。
2.4 包封率、载药量与体外释放度的测定
2.4.1 包封率与载药量的测定 取适量GA-LSLN胶体溶液,过sepharose CL-4 B凝胶柱,以蒸馏水为洗脱液,分离出GA-LSLN和游离GA,用试管收集不同时间段的洗脱液,每管1 mL,收集15份,洗脱液用适量的乙醇稀释后,测定每份洗脱液中GA的峰面积积分值。以洗脱体积为横坐标,峰面积积分值为纵坐标,绘制洗脱曲线。包封率按下式计算:包封率=AUCGA-LSLN/(AUCGA-LSLN+AUCfree-GA)×100%(式中,AUCGA-LSLN为洗脱曲线中GA-LSLN中GA曲线下面积;AUCfree-GA为洗脱曲线中游离GA的曲线下面积)。另精密量取1 mL的GA-LSLN胶体溶液,用甲醇破乳并稀释,测定GA含量,按下式计算载药量:载药量=MGA/Mlipid×100%(式中,MGA为GA-LSLN中GA的量;Mlipid为GA-LSLN中脂质的量)。结果,GA-LSLN的包封率为94.6%,载药量为11.3%。GA-LSLN和游离GA的洗脱曲线见图4(在第8 mL收集液中GA含量为零,即8 mL为分界点,前为GA-LSLN峰,后为游离GA峰)。
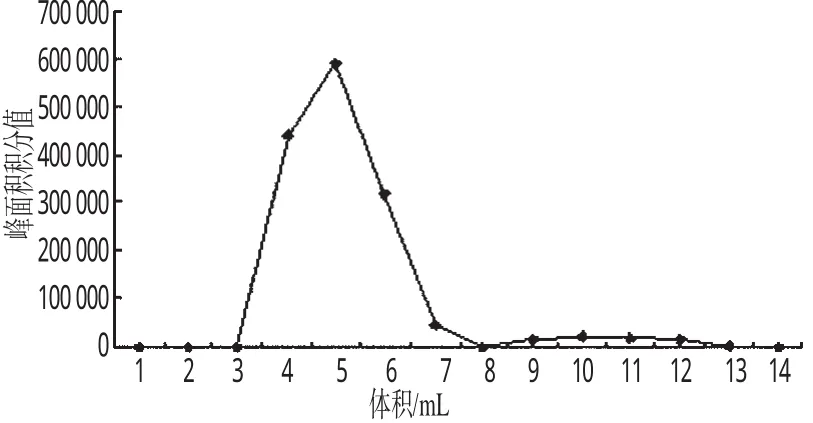
图4 GA-LSLN和游离GA的洗脱曲线Fig 4 Separation curves of GA-LSLN and free GA
2.4.2 体外释放度的测定 以200 mL含0.5%的十二烷基硫酸钠和30%乙醇的pH 7.4的PBS溶液为介质[11],精密移取2 mL GA-LSLN胶体溶液,置于透析袋中(截留分子量8000),磁力搅拌。分别于0.5、1.0、2.0、3.0、4.0、6.0、8.0、10.0、12.0、24.0、48.0 h取释放液0.5 mL,过0.45µm的微孔滤膜,进行HPLC分析,同时补充同温度的溶出介质1 mL。测定GA浓度,按下式计算累积释放百分率(Q):Q(%)=Ct/C0×100%(式中,Ct为释放的药物量;C0为脂质体中初始药物量)。以时间(t)为横坐标,Q为纵坐标,绘制体外释药曲线。将所得数据与一级、Higuchi、Weibull方程进行拟合。结果表明,其释放规律更符合一级速率过程。GA-LSLN体外释药曲线见图5;体外释药曲线回归方程拟合见表1。
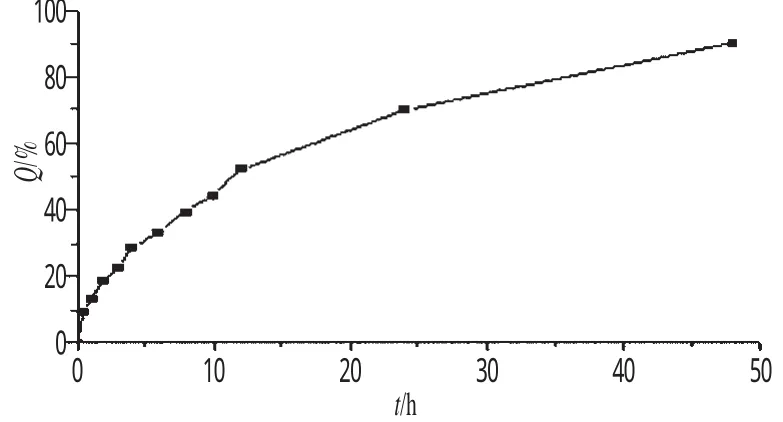
图5 GA-LSLN体外释药曲线Fig 5 Drug release curves of GA-LSLN in ritro

表1 体外释药曲线回归方程拟合Tab 1 Fitted regression equation of drug release curves
2.5 体外细胞毒性试验
取对数生长的SK-Hep-1肝癌细胞,以0.5×104个/L种植于96孔板;白血病细胞MV4-11,以1×105个/L种植于96孔板,选用游离药物DEXA为阳性对照,将DEXA、GA和GA-LSLN按1∶4的倍数稀释成一系列浓度,加入种植了癌细胞的96孔板中,各种条件平行做5孔,于37℃、5%CO2饱和湿度的培养箱中培养48 h,每孔加入20µL 5 mg·mL-1的MTT溶液,继续培养4 h,吸去培养液,每孔加入二甲基亚砜200µL,振荡,充分溶解,置于酶标仪上570 nm波长处测定吸光度,以浓度对数值对细胞存活率作图,计算各样品对肝癌细胞SK-HEP-1和白血病细胞MV4-11的半数抑制浓度(IC50)。GA-LSLN、游离GA和DEXA对SK-Hep-1和MV4-11细胞的IC50值见表2。
3 讨论

表2 GA-SLN、游离GA和DEXA对SK-Hep-1和MV4-11细胞的IC50值(μmol·L-1,n=5)Tab 2 IC50of GA-SLN,free GA and DEX to SK-Hep-1 and MV 4-11(μmol·L-1,n=5)
因文献报道在肝实质细胞上存在GA受体,GA的趋肝性和肝靶向性引起了医药工作者的高度关注,人们将目光纷纷转向于以GA修饰的脂质体和纳米粒作为肝靶向载体材料的研究[12]。GA本身作为一种抗肿瘤药物,在中药复方制剂中一直被广泛应用于临床,但开发新型GA靶向制剂,在抗癌药物制剂领域仍然具有诱人的前景。
本研究采用乳化溶剂挥发-高压匀质法制备GA-LSLN,该工艺简单、可行,所制得的SLN粒径适宜且大小均匀。本处方中加入mPEG-DSPE,不仅可以增加纳米粒的稳定性,而且因纳米粒表面具有PEG链,使其更具有长循环功能。
GA为脂溶性药物,在pH7.4的PBS中溶解度较小,因此在选择透析介质时使用了0.5%的十二烷基硫酸钠和30%乙醇,以保证一个处方量的GA能完全溶解,同时又不会造成GA在平衡时间内从SLN中渗漏。体外释放曲线符合一级速率过程,说明药物主要以被动扩散的形式从SLN中释放到溶出介质。
细胞毒性试验选用DEXA作为阳性对照药物,是因为GA的化学结构与甾体激素类药物DEXA相似,同时DEXA也被用于肝癌和急性白血病的治疗[13,14]。研究表明,GA和GA-LSLN对肝癌细胞SK-Hep-1和急性髓细胞白血病MV 4-11具有较强的细胞毒性,而GA-LSLN对这2种细胞的IC50均比游离GA大,说明其细胞毒性比游离药物小,其主要原因是因为GA从GA-LSLN中缓慢释放,在相同时间内,GA-LSLN中与细胞接触的游离GA浓度低。该制剂对肝癌和急性白血病的治疗作用有待进一步进行体内活性研究。
[1]胡志厚.甘草酸类药物的研制及应用[J].药学学报,1988,23(7):553.
[2]金 敏,吴红金.甘草次酸药理作用的研究进展[J].医学综述,2009,15(11):1712.
[3]谢世荣,赵 洁,刘 琳,等.甘草次酸的研究与展望[J].大连大学学报,2005,26(5):85.
[4]黄 炜,黄济群,张东方,等.全反式维甲酸、18 β-甘草次酸和甘草酸诱导人肝癌细胞分化和凋亡的研究[J].中西医结合肝病杂志,2009,9(2):92.
[5]柯文娟,刘新月,陈 燕,等.甘草次酸对K562细胞增殖抑制作用及其机制研究[J].中草药,2008,39(5):714.
[6]Liu D,Song D,Guo G,et al.The synthesis of 18 β glycyrrhetinic acid derivatives which have increased antiproliferative and apoptotic effects in leukemia cells[J].Bioorg Med Chem,2007,15(16):5432.
[7]Decio A,Davide N,Francesco FP,et al.Glycyrrhetinic acid,the active principle of licorice,can reduce the thickness of subcutaneous thigh fat through topical appli-cation[J].Steroids,2005,70(8):538.
[8]Muller RH,Mader K,Gohla S.Solid lipid nanoparticles(SLN)for controlled drug delivery a review of the state of the art[J].Eur J Pharm Biopharm,2000,50(1):161.
[9]Gref R,Luck M,Quellec P,et al.“Stealth”corona-core nanoparticles surface modified by polyethylene glycol(PEG):influences of the corona(PEG chain length and surface density)and of the core composition on phagocyt ic uptake and plasma protein adsorption[J].Colloid Surf B:Biointerfaces,2000,18(3-4):301.
[10]郭波红,程 怡,林绿萍.甘草次酸脂质体的制备及其药剂学性质的研究 [J].中草药,2010,42(3):380.
[11]Sun H,Zhang XH,Wang S,et al.Preparation and characterization of oleanolic acid-loaded solid lipid nanoparticles for oral administration[J].J Chin Pharm Sci(online),2011,20(3):259.
[12]吴 超,郭伟英,张 磊.甘草次酸衍生物修饰去甲斑蝥素脂质体的制备及其小鼠肝靶向性实验研究[J].中国药房,2009,20(28):2184.
[13]章雄文.诱导肝癌分化药物的研究进展[J].中国肿瘤临床,1999,26(5):389.
[14]Laane E,Tamme KP,Buentke E,et al.Cell death induced by dexamethasone in lymphoid leukemia is mediated through initiation of autophagy[J].Cell Death Differ,2009,16(7):1018.

