蛋白质相互作用研究的常用方法进展及比较
涂占晗 林 旭
福建医科大学基础医学院,福建福州 350008
蛋白质相互作用研究的常用方法进展及比较
涂占晗 林 旭▲
福建医科大学基础医学院,福建福州 350008
如今蛋白质间的相互作用已成为生命科学领域研究的重点,而各种蛋白质间相互作用的研究方法的飞速发展成为蛋白质研究的重点。本综述中将着眼于酵母双杂交方法新进发展与Sos系统、噬菌体展示、GST-pull down、免疫共沉淀、串联亲和纯化等蛋白质相互作用研究方法做一比较分析。以便在未来的研究中,根据不同方法的优缺点选择合适的研究技术。
酵母双杂交;Sos系统;噬菌体展示;GST pull-down;免疫共沉淀;串联亲和纯化
蛋白质作为生命活动的承载体已及功能的执行者,了解蛋白质的功能特性被视为理解生命活动的重要步骤。蛋白组学技术的不断发展,使得发现新蛋白质以及研究其功能和机制成为如今生命科学界的热门课题。由于极大多数蛋白质不能单独行使其功能,而是通过与其他蛋白相结合形成复合体参与到细胞或机体的各种生理活动中。在对一种蛋白质的功能进行研究的过程中发现,直接对感兴趣蛋白进行研究是非常困难的,通常利用蛋白与蛋白相互作用的特性,利用已知蛋白的功能对与其相互作用的未知蛋白的功能特性做出推断及验证[1]。到目前为止,已涌现出多种蛋白与蛋白相互作用的检测技术,但各自的适用情况和优缺点各有不同。本文将着眼于酵母双杂交方法新进发展与Sos系统、噬菌体展示、GST-pull down、免疫共沉淀、串联亲和纯化等蛋白质相互作用研究方法做一比较分析进行综述。
1 酵母双杂交系统及Sos恢复系统
1989年,在研究真核基因转录调控的过程中,Fields和Song初步建立的酵母双杂交系统[2]是近年来用于研究蛋白相互作用经典有效的方法。酵母双杂交系统是依据GAL4转录激活因子的特性进行设计的。GAL4转录激活因子是一种由两个彼此分离但功能必需的结构域组合而成的,即DNA结合结构域(DNA-BD)和转录激活结构域(AD),DNA-BD 能够识别并结合位于GAL4反应元件的上游激活序列(UAS),但必需与AD结合后才能激活UAS下游的启动子,从而表达出GAL4完整的转录因子活性,使启动子下游的报告基因 (如ADE2、HIS3、LacZ、MEL1)得到转录表达[3]。 见图 1。
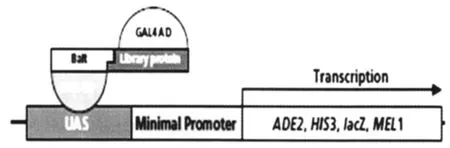
图1 酵母双杂交检测蛋白质相互作用机理
酵母双杂交技术在蛋白质相互作用的研究方面具有敏感、高效、简捷、真实、广泛等诸多优点[4],但它并非适用于所有蛋白质。因其原理决定,酵母双杂交只能检测定位于胞核内的蛋白,对发生在胞质和胞膜的相互作用或诱饵蛋白自身具有转录活性时,则不能将与其相互作用的蛋白质筛选出来[5]。
最近几年,Sos恢复系统对经典的酵母双杂交系统进行了弥补。Sos系统是应用一种突变菌株-cdc25H进行构建的。该菌株是一种在基因1328位置上有一个氨基酸残基点突变,即CDC25基因。这种菌株不依赖转录激活机制但是对温度敏感。在酵母菌株中的CDC25基因是人Sos(hSos)基因的同源基因,该基因可编码一个能够结合并激活Ras的脒基核苷酸交换因子,从而可启动Ras信号转导通路。该系统的特性是,在37℃的条件下生长的为CDC25基因不表达的cdc25突变体抑制菌株,但是25℃这个特定的温度下却允许突变菌株-cdc25H生长。经证实,人Sos(hSos)蛋白能够补充cdc25菌株这种缺陷,并且具有激活酵母中Ras信号通路的功能,通过与其相互作用的蛋白可将表达出的hSos蛋白固定于细胞膜上,使得cdc25H酵母菌能够在37℃生长。在该系统中,通过将诱饵蛋白基因构建到pSos载体上,而目的蛋白基因则构建到pMyr载体上可分别形成hSos和诱饵蛋白的融合蛋白,十四烷基化信号序列和目的蛋白的融合蛋白。由于十四烷基化信号序列的作用,目的蛋白可被固定于细胞膜上。继而hSos蛋白能与诱饵蛋白作用,被固定在细胞膜上并激活Ras信号传导通路,最终在37℃cdc25H菌株可得以生长。见图2。
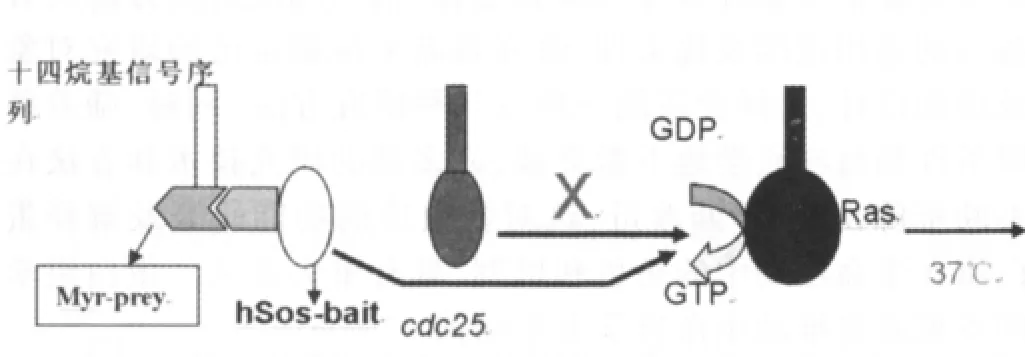
图2 Sos系统原理示意图
遗憾的是,该系统具有高背景假阳性等局限性,而应用GST-pull down和Co-IP实验方法对初筛结果进行进一步筛查验证即成研究的重要方法和关键性步骤。
2 噬菌体展示(PDT)
1985年 George P.Smith[6]在丝状噬菌体(filamentous bacteriophage,fd)的外壳蛋白基因III中克隆入RI核酸内切酶基因片段获得的噬菌体粒子可以在外壳蛋白中融合表达的酶分子。在之后的验证中证实EcoR I内切酶抗体可以有效中和外壳蛋白表达有这种酶分子的噬菌体,此结果说明该酶分子的构象和活性与天然酶分子相同或极为相似。该实验的成功标志着噬菌体展示技术的开始。该技术的基本原理是:噬菌体外壳蛋白与外源蛋白质或多肽的基因表达产物融合,并可展示于噬菌体表面,从而使得展示于噬菌体表面的外源多肽有较独立的空间结构和生物活性,通过筛选表达有特异性多肽或蛋白的噬菌体而得到大量富集,然后进行DNA测序。该技术是将展示肽的表型与基因型通过丝状噬菌体直接地联系起来[7],再利用其配体的特异性亲和力,将有需要的蛋白质或多肽筛选出来[8]。Scott JK等[9]于1990年运用该技术构建了随机多肽文库,此文库包含特定长度的随机段肽,理论上涵盖了某一长度短肽的所有氨基酸的排列组合序列。因依靠特定的氨基酸或特异性的肽段,可使蛋白质间相互识别和作用。据该原理所述,用受体蛋白对随机肽库进行筛查,以获得与之结合的短肽序列,由筛得的短肽序列便可得到与目的蛋白相互作用所依靠的氨基酸残基序列[10],即可进一步研究蛋白间的分子识别和结合等等。
这一研究技术也证明了无需了解蛋白的详尽结构也能够对其相互作用进行检测。迄今为止,已构建成功的噬菌体表达载体f1、M13、T4等,成为蛋白质组学研究中的重要工具。2004年,通过噬菌体展示技术的运用,Jespers L等[11]运用热变性的原理发展了一种方法选择和鉴定抗凝集蛋白,从而防止或促进蛋白的凝集反应,且在诊断凝集蛋白引起的疾病方面有重大意义。
3 GST-pull-down
Smith DB和其研究团队[12]于1988年利用谷胱甘肽-s-转移酶 (GST)融合标签纯化出GST融合蛋白,GST-pulldown开始成为一种热门研究方法。GST-pull-down这一研究方法是将诱饵蛋白的编码基因与GST标签整合后表达,表达的融合蛋白经纯化后与有目的蛋白质的溶液孵育。经一定时间的孵育后即会形成GST-融合蛋白-目的蛋白复合物,并用谷胱甘肽-Sepharose将其沉淀下来。最后通过聚丙烯酞胺凝胶电泳(SDS—PAGE)方法鉴定猎物蛋白。GST-pull down主要有两方面用途:(1)鉴定能与已知融合蛋白质相互作用的未知蛋白质;(2)验证两已知蛋白质之间是否存在相互作用。
该方法特异性较强,也较简便,能减少一定的假阳性率,也不需要使用同位素等危险物质,在研究蛋白质相互作用中应用广泛。但该方法不适用于大规模筛查相互作用的蛋白,除此之外,活性融合蛋白的量及避免内源性诱饵蛋白干扰是该方法成功的关键。
4 免疫共沉淀(Co-IP)
免疫共沉淀是一种研究蛋白质之间相互作用的特异性强的研究方法。该技术运用特异性抗体与蛋白特异性结合的原理,通常是蛋白或其复合物与带有标签蛋白的特异性抗体的融合蛋白相互结合,形成蛋白复合体。用试剂将蛋白质复合体进行溶解,再利用通过亲和色谱柱对标签蛋白具有特异吸附作用的特性将蛋白复合体分离纯化出来,最后运用SDSPAGE、双向电泳或质谱等技术对分离所获的蛋白进行鉴定。
此方法同样不适用于相互作用蛋白的大规模筛查,但其优势在于能用于确定在生理条件下在细胞或组织内是否存在与目的蛋白能够结合并作用的蛋白质,亦可运用该方法验证蛋白间的相互作用。见图3。
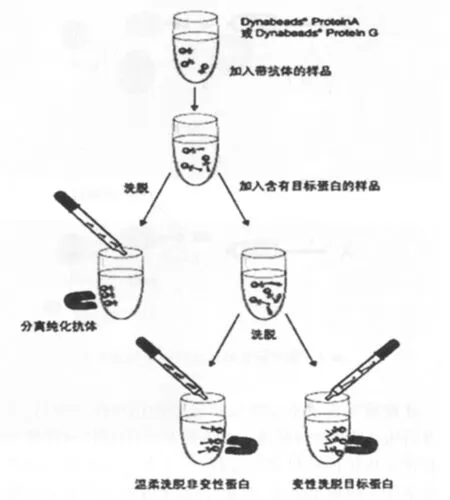
图3 免疫共沉淀原理图
5 串联亲和纯化(TAP)
Rigaut G等[13-14]在1999年一同提出了一套称为串联亲和纯化(TAP)的研究方法,用于分离复合蛋白,该技术兼备了免疫共沉淀和标准亲和纯化的优点,成为鉴定和分离蛋白质复合体新途径[15]。该研究方法首先将TAP标签整合于该蛋白质的一端,标签由一个钙调蛋白结合多肽(CBP)与蛋白标签组成,并将TEV蛋白酶切位点插入二者之间,之后用带有TAP标签的基因置换内源的蛋白基因并表达,且可与特定蛋白进行识别和结合裂解细胞,提取细胞总蛋白,并将所获总蛋白加入IgG亲和柱。亲和柱上的IgG可与TAP标签的ProA端特异性结合,之后用洗脱液洗脱大多数非特异性结合蛋白,依次在洗脱液(含TEV蛋白酶)洗脱和钙离子的协助下,获得高纯度的目的蛋白复合体(见图4)。经上述步骤所得的蛋白质复合体再进行SDS-PAGE电泳分离及质谱分析,进而可发现其中的新组分或新蛋白复合物。
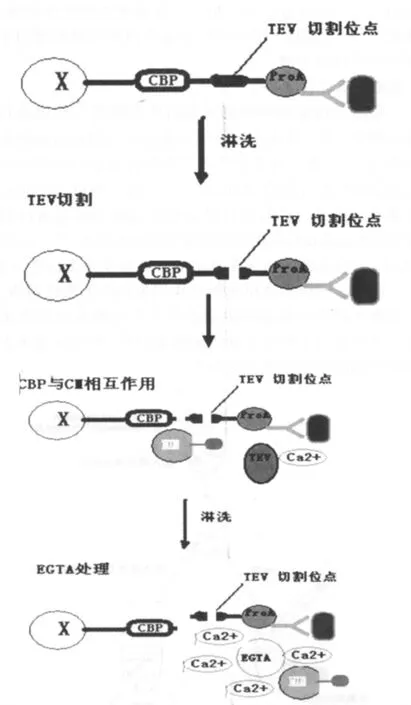
图4 重组标签融合蛋白的结构示意图
此种研究方法不仅能保持复合物结构的完整性,并且能够得到纯度较高的特异性。因该技术的灵敏性、可靠性和特异性都优于传统的酵母双杂交技术,尤其适用于研究蛋白质在生理条件下的相互作用。但是,该技术在对高等真核细胞进行研究时却因原位蛋白标记难在真核细胞内进行,且易受内源蛋白的干扰等因素而具局限性。Foler D及其科研团队[16]将RNAi技术与TAP方法结合(iTAP技术),内源基因可通过此技术发生沉默,减少内源性基因的竞争性干扰作用。
6 对未来蛋白与蛋白相互作用研究的展望
机体内蛋白之间的结合和相互作用是机体生理活动的基础。通过不同的蛋白质研究技术可了解和阐明蛋白相互作用及新蛋白的发现和作用机制等重要问题。蛋白组学研究的兴盛标志着后基因组时代的到来,蛋白功能的研究成为重中之重。以近期国内外该领域的趋势,现阶段蛋白质研究的热点已锁定于研究蛋白质之间的相互作用关系的揭示及其网络图的建立。多样化的蛋白质相互作用的研究方法,给科研工作者提供了多种多样的研究途径,但不同的研究方法具有各自的适用范围及优劣性,研究者需要根据自己的研究对象及课题设计,选择合适的一种或几种研究方法。同时,随着科研条件和材料科学地不断突破,许多新的研究技术和方法在不断推陈出新,不断改进,这对蛋白质的功能研究及解释蛋白质在生命活动中的角色和机制,具有重大意义。蛋白组学的发展必将推动生命科学大步向前。
[1]Oliver S.Guilt-by-association goes global[J].Nature,2000,403(6770):601-603.
[2]Fields S,Song O.A novel genetic system to detect protein-protein interactions[J].Nature,1989,40(6230):245-246.
[3]Fields S,Sternglanz R.The two-hybrid system:assay for protein-protein interactions[J].Trends Genet,1994,10(8):286-292.
[4]YangM,WuZ,FieldsS.Protein-peptideinteractionsanalyzedwiththeyeast two-hybrid system[J].Nucleic Acids Res,1995,23(7):1152-1156.
[5]Aronheim A.Improved efficiency sos recruitment system:expression of the mammalian GAP reduces isolation of Ras GTPase false positives[J].Nucleic Acids Res,1997,25(16):3373-3374.
[6] Smith GP.Filamentous fusion phage:novel expression vectors that display cloned antigens on the virion surface[J].Science,1985,228(4705):1315-1317.
[7]Perham RN,Terry TD,Willis AE,et al.Engineering apeptide epitope display system on filamentous bacteriophage[J].FEMS Microbiol Rev,1995,17(122):25-31.
[8]McCarrey JR,Williarns SA.Construction of cDNA Libraries from Limiting Amounts of Materia[J].Cum Opin Biotechnol,1994,5(1):34-39.
[9]Scott JK,Smith GP.Searching for peptide ligands with an epitope library[J].Science,1990,249(4967):386-390.
[10]Hoess RH.Bacteriophage Lambda as a Vehicle for Peptide and Protein Display[J].Current Pharmaceutical Biotechnology,2002,3(1):23-28.
[11]Jespers L,Schon O,James LC,et al.Crystal structure of HEL4,a soluble,refoldable human VH single domain with a germ-line scaffold[J].J Mol Biol,2004,337:893-903.
[12]Smith DB,Johnson KS.Single-step purification of polypeptides expressed in Escherichia coli as fusions with glutathione S-transferase[J].Gene,1988,67(1):3l-40.
[13]Rigant G,Shevchenko A,Rutz B,et a1.A generic protein purification method for protein complex characterization and proteome exploration[J].Nat Biotechnol,1999,17:1030-1032.
[14]Puig O,Caspary F,Rigaut G,et al.The Tandem Affinity Purification(TAP) method:a general procedure of protein complex purification[J].Method,2001,24:218-229.
[15]王海波,安学丽,张艳贞,等.蛋白质相互作用研究方法及其应用[J].生物技术通报,2006,(z1):167-170.
[16] Forler D,Kocher T,Rode M,et al.An efficient protein complex purification method for functional proteomics in higher eukaryotes[J].Nat Biotechnol,2003,21(1):89-92.
The advance and comparison in common research methods for protein-protein interactions
TU Zhanhan LIN Xu
Preclinical Medicine of Fujian Medical University,Fuzhou 350008,China
Protein-protein interaction has become a significant subject in life science research.With the rapid development,there are various research approaches have created for studies of protein-protein interaction.This review will make comparisons between the yeast two-hybrid,Sos,co-immunoprecipitation,GST pull-down,phage display,tandem affinity purification which are all the methods for this research.After that,it will analyze their own application characteristics.Finally,this review will discuss how to choose a suitable approach in different protein-protein interaction research based on different aims and requirements.
Yeast two-hybrid;Sos;Phage display;GST pull-down;Co-immunoprecipitation;Tandem affinity purification
R34
A
1674-4721(2012)05(b)-0018-03
▲通讯作者
2012-02-29本文编辑:陈 俊)
- 中国当代医药的其它文章
- 论文写作技巧——题名

