PGC-1α基因Gly482Ser多态性与2型糖尿病前期的相关性研究
邓德耀,袁文丽,冯 倩,刘春林,赵东岩,李显丽,高宗鹰,徐红云,方 芳,李奕平
(云南省第二人民医院1.检验科;2.内分泌科,云南 昆明650021)
过氧化物增殖激活受体协同激活子(PPAR-γ coactivator 1α,PGC-1α)是近年来发现的一种转录协同激活子,在多种糖尿病研究模型及部分人种中可见其多态性与2型糖尿病(type 2diabetes mellitus,T2DM)相关,认为PGC-1α可能参与了糖尿病发病[1-4]。糖尿病前期又 称糖调节受损(Impaired glucose regulation,IGR)是指血糖处于正常与糖尿病之间的时期,包括空腹血糖受损(Impaired free glucose,IFG)和糖耐量受损(Impaired glucose tolerance,IGT)以及两者合并存在三种状态[5]。在T2DM被确诊以前,患者都要经历糖尿病前期阶段。患者在这一阶段发展成为糖尿病的可能性明显提高,并且出现大血管和微血管并发症的危险明显升高,是糖尿病自然病程的重要阶段,也是预测糖尿病的临床标志。然而,大规模流行病学研究发现并非所有的糖尿病前期人群均进展为2型糖尿病。因此本研究首次应用高分辨率熔解曲线(high resolution melting,HRM)方法,完成了对云南省昆明地区361例糖尿病前期人群PGC-1α基因Gly482Se多态性位点(rs8192678)进行分析,在基因水平为预测糖尿病前期人群向糖尿病的转归提供了客观依据。
1 对象与方法
1.1 研究对象
本研究选择了云南省昆明地区的具有医疗记录的361例糖尿病前期人群(IGR)、430例2型糖尿病患者(T2DM)和446例性别和年龄相匹配的OGTT正常的健康志愿者(NGT)。糖尿病及糖尿病前期诊断标准采用WHO1999年诊断标准(内科学第7版)。正常对照系进行糖尿病普查和筛选的随机人群中确定的非糖尿病个体,无直接血缘关系且无糖尿病家族史。
1.2 主要试制和仪器
紫外分光光度计 (Becman公司),PCR扩增仪(Perkin-Elmer公司),DYY-10C型电泳仪(北京市六一仪器厂),凝胶成像系统(美国BIO-RED公司),LightCycler 480荧光定量分析仪(德国罗氏诊断有限公司),即用PCR扩增试剂盒(上海生工生物工程有限公司),LightCycler 480高分辨率熔解扩增试剂盒(德国罗氏诊断有限公司)。
1.3 实验方法
(1)临床资料收集:所有研究对象采用统一调查表进行调查,内容包括一般情况、个人史、家族史、吸烟饮酒史以及药物使用情况等。每个个体均测量身高、体重、腰围、臀围,根据如下公式计算体重指数(BMI):BMI=体重/身高2(kg/m2)。血糖、血脂、肝肾功等均使用日立7600全自动生化分析仪检测。
(2)基因组DNA制备:用2%EDTA+K2抗凝真空管采集外周静脉血2ml,经典酚-氯仿-异戊醇法提取基因组DNA,紫外分光光度计对DNA浓度进行测定,每个样本测定两次,取其平均值。如果两次误差超过10%,则进行第3次测定,然后取两个相近数值的平均值,最后将所有DNA样品稀释至终浓度20ng/μl。
(3)引物的合成:根据Primer3.0软件设计PGC-1α基因的引物。上游引物序列:5'-CAGTCAAGCTGTTTTTGACGAC-3';下游引物序列:5'-TCACTTTCATCTTCGCTGTCAT-3'。引物由上海生工生物工程有限公司合成,用HPLC纯化。
(4)PCR:在PCR扩增仪上进行普通PCR反应。PCR体系包括20ng的基因组DNA、1×PCR Master mix(已含MgCl2)、500nmol的正反向引物,并用PCR级别的水补足至20μl。反应条件为:94℃预变性4min;94℃变性1min,55℃退火1 min,72℃延伸1min,共30个循环;72℃在延伸7 min,并于4℃保存。PCR产物用2%琼脂糖凝胶电泳,然后用凝胶成像系统观察。
(5)高分辨率熔解曲线(high resolution melting,HRM)分析方法检测PGC-1α基因Gly482Ser G>A基因型:普通PCR反应扩增特异性条带成功后,在Light Cycler 480荧光定量分析仪上采用HRM方法进行PGC-1基因Gly482Ser G>A多态性分析。PCR和HRM分析均在Light Cycler 480上进行。PCR体系包括10ng的基因组DNA、1×PCR Master mix、2mmol/L MgCl2、200nmoL的正反向引物,并用PCR级别的水补足至20μl。PCR条件:95℃预变性10min后行触底PCR,即95℃10 s,65℃-55℃退火15s,72℃10s,55个循环,其中前十个循环65℃-55℃,每个循环退火温度降一度,后45个循环退火温度维持55℃。HRM分析条件:95℃1min,40℃1min,熔解曲线数据收集从65℃到95℃,温度上升率为1℃/s,且每升高l℃进行15次数据采集。最后40℃冷却10s。应用gene scanning软件进行实时数据检测和分析。随机选取不同熔解曲线的产物共20例测序验证基因型结果。以测序得到的野生纯合子GG、突变杂合子GA和突变纯合子AA分别作为标准品,分析其它DNA样本基因型。
1.4 统计学方法
计量资料用“均数±标准差”表示,如果方差不齐或者不符合正态分布均进行数值转换,应用独立样本t检验两两比较三组之间人口学和生化指标的差异;基因型等计数资料的比较以及Hardy-Weinberg平衡检验均使用χ2检验或Fisher’s检验。所有数据均利用SPSS17.0软件处理,双侧P<0.05为有统计学差异。
2 结果
361例IGR和430例T2DM的平均年龄分别为54.01±10.92岁和53.74±12.00岁(P=0.852)。和2型糖尿病组比较,IGR组人群仅有BMI明显降低(P=0.018),而 WBC、TG、TC、HDL-C和LDL-C均无显著性差异(表1)。
根据熔解曲线荧光和峰值的差异来有效区分不同标本PGC-1α基因482位点多态性,结果由Light Cycler 480gene scanning软件输出,该位点的基因型明显的分为GG、GA、AA三型,且与测序结果一致(图1、图2)。
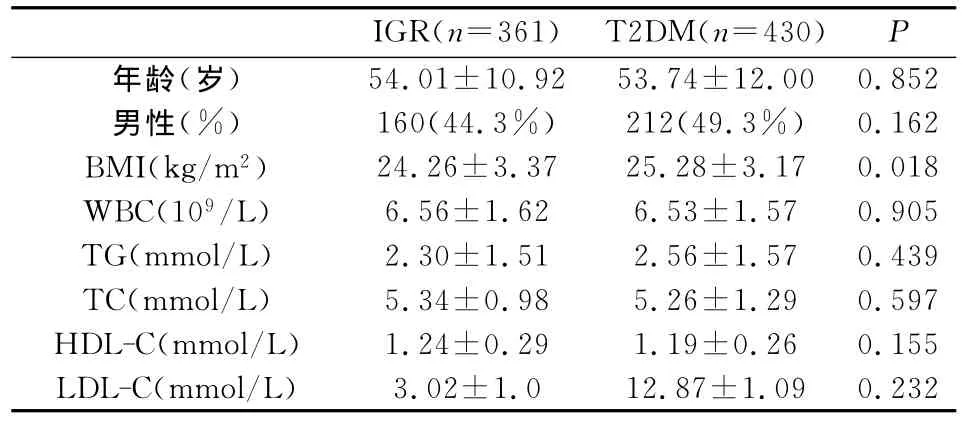
表1 IGR组和T2DM组个体一般情况比较

图1 Light Cycler 480高分辨率熔解曲线
PGC-1α基因482位点多态性的基因型经遗传平衡定律检验符合Hardly-Weinberg平衡法则,提示研究对象具有群体代表性。由表2可见,AA纯合子在T2DM组中的频率0.209,在IGR组中为0.152,前者频率高于后者,但差异无统计学意义(P>0.05);G等位基因和A等位基因频率在两组间比较,IGR组人群拥有较低的A等位基因频率,且差异具有显著性意义(表2、图3)。而IGR组与NGT组比较,基因型及等位基因分布频率均无显著性差异(表3、图4)。
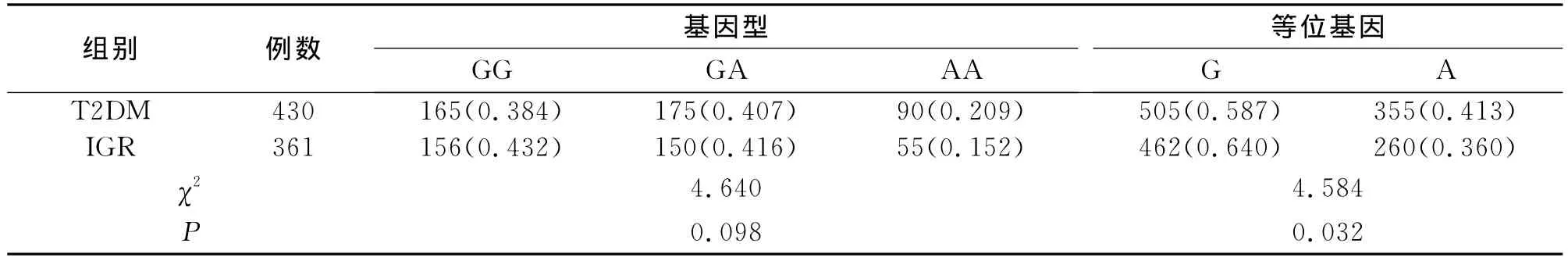
表2 T2DM组和IGR组PGC-1α基因型与等位基因分布频率

表3 NGT组和IGR组PGC-1α基因型与等位基因分布频率
IGR组PGC-1α基因482位点GG基因型和GA+AA基因型的表型间的BMI、TC、HDL-C和LDL-C比较,P均>0.05,差异无统计学意义(表4)。IGR包括了IFG、IGT以及两者合并存在三种状态,为减少影响因素,本研究在剔除了IFG和IGT合并存在的IGR人群后,分别对IFG人群和IGT人群进行PGC-1α基因Gly482Ser多态性与临床变量的深入分析。研究发现,IGR组IFG人群PGC-1α基因482位点多态性GG基因型和GA+AA基因型的临床变量差异均无统计学意义(P>0.05)。而在IGT人群中,含 A的基因型(GA+AA)则表现出更高的餐后2小时血糖 (PBG)水平,且具有统计学差异(P=0.027),而BMI、TC、HDLC和LDL-C水平在GA基因型和GA+AA基因型之间均无显著性差异(表5)。
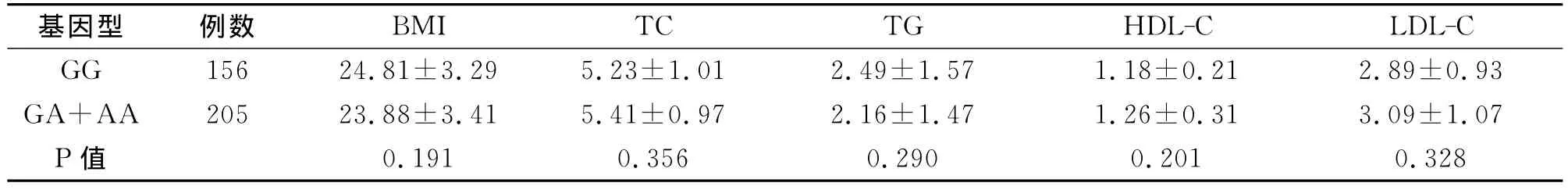
表4 IGR组PGC-1α基因Gly482Ser多态性与临床变量

表5 IGR组IFG人群和IGT人群PGC-1α基因Gly482Ser多态性与临床变量
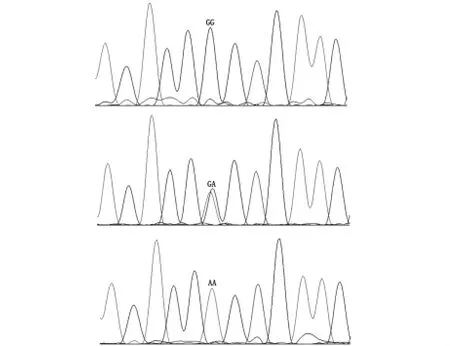
图2 PGC-1α基因482位点测序图

图3 等位基因在NGT、IGR及T2DM三组间分布频率图
3 讨论
T2DM是多基因遗传病,至今尚未从基因角度完全阐明其发病机制。随着疾病基因组学研究的深入,作为第3代遗传标记的单核苷酸多态性(single nucleotide polymorphisms,SNP)筛查及其与疾病相关性分析近年倍受关注。SNP是指在基因组水平上,因单个核苷酸的转换、颠换、插入或缺失而形成的一种与疾病群体易感性和个体表型差异相关,甚至参与某些疾病发病过程的DNA序列改变。PGC-la是PGC-1家族的第一个成员。PGC-1α可辅助激活核受体PPAR-α和PPAR-γ及肌肉增强因子2C(muscle enhance factor 2C,MEF2C)等一系列与糖脂代谢有关的基因转录,是机体能量代谢的重要调控者。MEF2C是骨骼肌葡萄糖转运子(glucose transporter,GLUT4)的上游调控子,经 PGC-1α辅助激活后调节骨骼肌对葡萄糖的摄取过程。PGC-1α基因中部403-570区域(称为“MEF2C结构域”)可以与MEF2C多肽链的第93-174aa区域特异结合,482位点恰好位于该结构域的中心,此位点的错义突变有可能影响PGC-1α与MEF2C的结合,进而影响MEF2C对下游基因GLUT4表达的调控[6]。国内也有学者研究发现,PGC-1α基因Gly482Ser多态性与T2DM相关,他们认为PGC-1α基因可能参与了糖尿病发病[7-8]。然而,在糖尿病前期人群中却少见Gly482Ser多态性的相关研究。鉴于此,本课题首次应用HRM方法对云南省昆明地区361例糖尿病前期人群进行PGC-1α基因Gly482Ser多态性进行分析。
传统用于检测SNP的方法是限制性片段长度多态性聚合酶链反应(PCR-RFLP)技术,但其操作繁琐、耗时长、容易交叉污染、达不到高通量的要求,而且溴化乙锭致癌性强。其它用于检测SNP的方法也都有一定的局限性,如Taqman探针技术则价格昂贵,直接测序法虽然是目前检测基因型的金标准,但其步骤多而分散、工作量大、周期长、成本较高,不适合临床和实验室常规检测。HRM技术操作简便、快速,可实现高通量的闭管操作、避免污染,且成本低、灵敏度高、结果准确可靠,具有极强的可操作性,已成为遗传学、方法学研究和应用的热点,有望成为分子诊断的常规方法[9-10]。本实验通过HRM方法对PGC-1α基因Gly482Ser多态性进行检测,其结果与直接测序一致,为今后HRM检测方法的广泛应用提供参考依据。我们测定1237例受试者,结果显示,rs8192678位点AA纯合子在云南省昆明地区430例T2DM中的频率为0.209,在361例糖尿病前期人群中为0.152,两组间无显著性差异;G等位基因和A等位基因频率在两组间比较,IGR组人群拥有较低的A等位基因频率,且差异具有显著性意义。而IGR组与NGT组比较,基因型及等位基因分布频率均无显著性差异。本研究观察到PGC-1α基因482位点A等位基因(包括GA和AA型)更易出现在2型糖尿病人群,且A等位基因频率与2型糖尿病的发生呈正相关。可以推测,PGC-1α基因482位点A等位基因可能是糖尿病前期人群疾病进展的一个分子标记。也就是说,含有A等位基因的糖尿病前期人群更易进展为2型糖尿病。
IGR组PGC-1α基因482位点GG基因型和GA+AA基因型的表型差异无统计学意义。此结果提示除PGC-1α基因482位点A等位基因外,还可能存在其它的未知因素共同影响糖尿病前期人群血脂的代谢水平。PGC-1α基因482位点A等位基因,作为糖尿病前期人群疾病进展的分子标记之一,也许并未对糖尿病前期人群可能出现的血脂紊乱做出重要的贡献,而仅是其发生的因素之一。本研究还发现,在IGT人群中,含A的基因型(GA+AA)表现出更高的PBG水平,且具有统计学差异,而BMI、TC、HDL-C和 LDL-C水平在野生型(GA)和突变型(GA+AA)之间均无显著性差异。这说明PGC-1α基因482位点A等位基因(包括GA和AA型)更易合并餐后高血糖,且A等位基因频率与餐后血糖值呈正相关。这可能与PGC-1αA等位基因易引起胰岛β细胞葡萄糖刺激的胰岛素分泌障碍有关,其可能机制为PGC-1α可通过上调胰岛β细胞解偶联蛋白2表达,使线粒体呼吸链解偶联,ATP/ADP比率下降,通过影响钾离子通道,进而抑制葡萄糖刺激的胰岛素分泌[11]。
随着生活方式的改变,T2DM发病率逐年升高,其后备军即糖尿病前期人群数量亦是与日俱增,作为一个多基因遗传性疾病,基因在其发病中的作用至关重要。随着对PGc-1a基因研究的深入,其在调节能量代谢和诸多基因转录中具有重要作用。鉴于此,我们仍然迫切需要寻找一些分子标记,从而对糖尿病前期人群疾病的转归进行预测,以期达到早期诊断和治疗的目的。本课题只是在应用HRM方法的基础上对较小样本糖尿病前期人群PGC-1α基因Gly482Ser进行了多态性分析,并推测含有A等位基因的糖尿病前期人群更易合并餐后高血糖,更易进展为2型糖尿病。当然,精确的评估尚需通过大规模临床试验和流行病学研究予以证实。
[1]Hsieh MC,Lin KD,Tien KJ,et al.Common polymorphisms of the peroxisome proliferator-activated receptor-gamma(Pro12Ala)and peroxisome proliferator-activated receptor-gamma coactivator-1(Gly482Ser)and the response to pioglitazone in Chinese patients with type 2diabetes mellitus[J].Metabolism,2010,59(8):1139.
[2]Olsson AH,Rönn T,Elgzyri T,Hansson O,et al.The expression of myosin heavy chain(MHC)genes in human skeletal muscle is related to metabolic characteristics involved in the pathogenesis of type 2diabetes[J].Mol Genet Metab,2011,103(3):275.
[3]Maciejewska A,Sawczuk M,Cieszczyk P,et al.The PPARGC1A gene Gly482Ser in Polish and Russian athletes[J].J Sports Sci,2012,30(1):101.
[4]Prior SL,Clark AR,Jones DA,et al.Association of the PGC-1α rs8192678variant with microalbuminuria in subjects with type 2 diabetes mellitus[J].Dis Markers,2012,32(6):363.
[5]高 鑫.糖尿病前期筛查的分歧与共识[J].国际内分泌代谢杂志,2008,28(2):83.
[6]Castillo-Quan JI.From white to brown fat through the PGC-1αdependent myokine irisin:implications for diabetes and obesity[J].Dis Model Mech,2012,5(3):293.
[7]Kagkli DM,Folloni S,Barbau-Piednoir E,et al.Towards a Pathogenic Escherichia coli Detection Platform Using Multiplex SYBR?Green Real-Time PCR Methods and High Resolution Melting A-nalysis[J].PLoS One,2012,7(6):e39287.
[8]Nechifor-BoilăA,Decaussin-Petrucci M,Gazzo S,et al.Detection of BRAF V600Emutation in thyroid fine-needle aspiration specimens by High Resolution Melting (HRM)analysis[J].Rom J Morphol Embryol,2012,53(2):263.
[9]路文盛,颜晓东,黄 勤.PGC-la基因 MEF2C结构域482G/A变异参与2型糖尿病发病的机制研究[J].中华医学遗传学杂志,2008,25(6):616.
[10]路文盛,黄勤颜,晓 东.PGC-la基因多态性与2型糖尿病的相关性[J].中华内分泌代谢杂志,2008,24(4):404.
[11]Andrulionyte L,Kuulasmaa T,Chiasson JL,et al.Single nucleotide polymorphisms of the peroxisome proliferator-activated receptor-alpha gene (PPARA)influence the conversion from impaired glucose tolerance to type 2diabetes:the STOP-NIDDM trial[J].Diabetes,2007,56(4):1181.

