山羊痘病毒抗凋亡蛋白基因的表达与细胞凋亡的相关性
关会敏,冉雪琴,姬志林,王嘉福,3
(1.贵州大学动物科学学院,贵州 贵阳550025;2.楚雄医药高等专科学校医学检验系,云南 楚雄675000;3.贵州大学农业生物工程省重点实验室,贵州 贵阳550025)
山羊痘病毒(goat pox virus,GPV)为DNA病毒,属痘病毒科(Poxviridae)、脊索动物痘病毒亚科(Chordopoxrinae)、羊痘病毒属(Capripoxvirus),是引起山羊痘的直接病原,羔羊易感,接触感染率可达100%。山羊痘为急性、热性传染病,临床症状以皮肤、呼吸道及消化道等黏膜处出现痘疹为主[1],发病率和死亡率均较高,严重影响了山羊养殖业的发展。痘病毒是惟一可以在感染细胞的胞质中独立复制的病毒[1]。在痘病毒侵入宿主细胞的初期,需在活细胞内完成病毒粒子的复制和组装等过程,因此病毒进化出特殊的机制在感染的早期,阻碍宿主细胞过快地发生细胞凋亡或死亡。多数痘病毒家族可产生抗细胞凋亡因子,目前已知的痘病毒抗凋亡蛋白主要有:牛痘病毒编码的CrmA蛋白,人传染性软疣病毒蛋白 MC159/160,黏液瘤病毒编码的M11L蛋白。但GPV是否产生抗凋亡蛋白还不清楚。本文着重研究GPV编码的抗凋亡蛋白基因结构及其致病机制。
1 材料与试剂
1.1 材料 山羊痘病毒株(LD株)由贵州大学动物科学学院分离[2],Vero细胞,购自中国典型培养物保藏中心,大肠杆菌DH5α和载体pBluscript.SK由本实验室保藏。
1.2 试剂 RM1640/M199干粉为Gibco公司产品,胎牛血清由HyClone公司生产,PCR相关试剂,购自天根生化科技(北京)有限公司,RNA fast200总RNA极速抽提试剂盒,购自上海飞捷生物公司,引物和碱基序列的测定由上海捷瑞生物科技有限公司完成。
2 方法
2.1 细胞及病毒的培养 Vero细胞接种于含10%胎牛血清的RM1640培养基中37℃培养成单层。接毒GPV(MOI=50),吸附1~1.5h,加入含2%胎牛血清的RM1640培养基,37℃培养,当70%~80%细胞脱落时,胰蛋白酶消化收集细胞,反复冻融,4 000 r/min离心20min,取上清-20℃保存备用。
2.2 细胞病变及凋亡检测 取GPV感染0、12、18、24、36、48h的 Vero细胞,观察细胞的形态变化;0.4%台盼蓝染色,计数死亡细胞数并计算细胞的死亡率(死细胞/总细胞数×100%);吖啶橙(AO)/溴乙锭(EB)混合染色[3],计数细胞凋亡数并计算细胞的凋亡率(凋亡细胞/总细胞数×100%)。
2.3 病毒基因组的提取[4]病毒液经SDS和蛋白酶K,56℃水浴消化1h,加入等体积的酚-氯仿-异戊醇(25∶24∶1)溶液抽提,离心,取上清,3mol/L醋酸钠(pH 值5.2)和无水乙醇,-20℃沉淀30 min,于4℃ 12 000r/min离心15min,取沉淀用70%乙醇洗涤2次,离心,自然干燥,溶于TE溶液。2.4 基因的扩增及克隆
2.4.1 引物设计 据已知序列设计P1/P2、P3/P4两对特异性引物,其中P1/P2用于山羊痘病毒抗凋亡蛋白基因的克隆,P3/P4用于基因表达的检测。引物碱基序列为:P1:5′-GTGCTCTTCCAACATGGATAACTATAACTACAACA-TAG-3′,P2:5′-CCTCTGCAGTTACTTCCATCGTA TCCTACC-3′,下划线部分为SapⅠ和PstⅠ酶切位点;P3:5′-GAATGTGTACTTGCGAGACT-3′,P4:5′-CTTCC ATCGTATCCTACCAAT-3′,另设计一对引物P5/P6,分析β-actin基因的表达量作为内参照,P5:5′-GGCTACA GCTTCACCACCAC-3′,P6:5′-TACTCCTGCTT GCTGATCCAC-3′。
2.4.2 基因的扩增及克隆 以1μg山羊痘病毒基因组DNA为模板,P1/P2为引物,扩增山羊痘病毒抗凋亡蛋白基因,扩增条件:94℃变性8min;94℃40s,55℃30s,72℃30s,30个循环;72℃ 5min。扩增产物经1%琼脂糖凝胶电泳,染色,观察,回收目的片段,SapⅠ和PstⅠ双酶切,与pBluscript.SK质粒连接,转化感受态细胞DH5α,涂布LB平板(含氨苄西林),37℃培养过夜,挑取阳性克隆。经质粒大小、菌落PCR和质粒PCR鉴定为阳性的重组子测定碱基序列。
2.5 GPV抗凋亡蛋白基因的RT-PCR分析 提取细胞和病毒总RNA,经甲醛变性琼脂糖凝胶电泳检测RNA质量,合格样本经反转录,以引物P3/P4扩增山羊痘病毒抗凋亡蛋白基因片段,同期以引物P5/P6检测β-actin基因的表达量为内参。1%琼脂糖凝胶电泳检测,Gene tools软件(Gene co.)分析基因的相对表达量。
3 结果
3.1 细胞凋亡率及死亡率 与对照组(图1A)相比,GPV感染Vero细胞24h之前,细胞的形态没有明显的变化,24h之后出现明显的形态学改变:细胞变圆,聚集成堆、拉丝、脱落(图1B),48h时,细胞大量脱落、裂解。台盼蓝染色结果显示,随着病毒感染时间的延长,Vero细胞的死亡率逐渐增加:36h约为80%,48h接近100%(图2)。经AO/EB染色,随机计数200个细胞,计算细胞的凋亡率。与对照组相比,至24h时没有明显的细胞凋亡,36h时检测到凋亡细胞,以早期凋亡为主,48h细胞凋亡率明显增加至13%,且以晚期凋亡为主,同时坏死细胞也随之快速递增,达到87%(图3)。
3.2 山羊痘病毒抗凋亡蛋白基因的克隆 以P1/P2为引物PCR扩增,获得1条约530bp的条带(图4,5),经克隆测序(图6),证实重组子中含有插入片段531bp,经NCBI核酸库在线比对,确认本文克隆到的531bp DNA片段确为山羊痘病毒抗凋亡蛋白基因(goat pox virus antiapoptosis protein),命名为GGPVAP基因,作为一个独立的基因登录到Gen-Bank上(EF536858)。


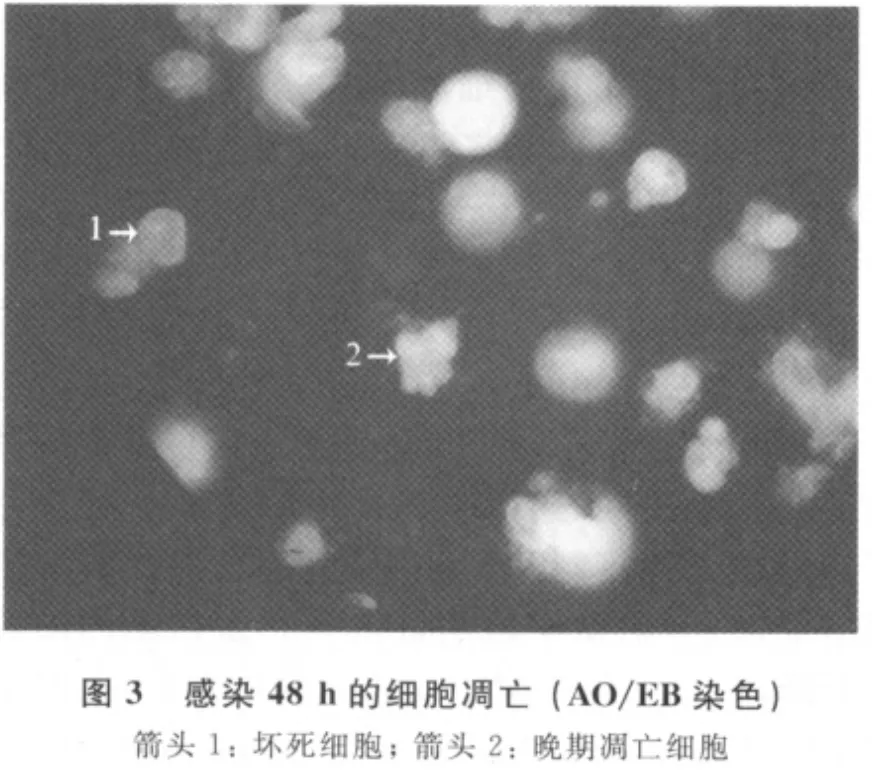
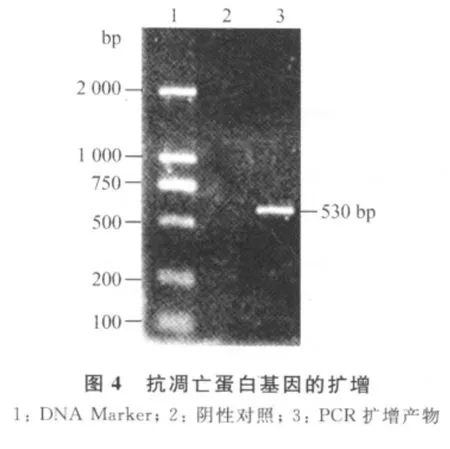

图5 重组质粒的酶切鉴定
在GGPVAP序列中,(A+T)对的含量为77.97%,基因编码完整的抗凋亡蛋白,由176个氨基酸组成,分子量20.76kD,等电点(PI)7.58。经NCBI蛋白库在线分析,与GTPV_gp014相似性100%,与LSDV017相似性为96%,与SPPV-14的相似性为95%,均属于抗凋亡膜蛋白PHA02855超家族,具有固定的结构域,且与M11L蛋白家族固定结构域类似。
以DSA软件(www.expasy.org)进行在线分析,GGPVAP蛋白的C端有一显著跨膜域,含有22个氨基酸,位于146~167位氨基酸区段,而M11L蛋白的C端也有类似的跨膜域,且均是由外向内。在跨膜域内,154、155、158三个位点的氨基酸高度保守,分别是缬氨酸、苯丙氨酸、甘氨酸,均为疏水性氨基酸,推测其在跨膜结构中起着重要的作用。
3.3 GGPVAP基因的表达变化 以提取细胞和病毒总RNA为模板,以β-actin为内参照,经RT-PCR对GGPVAP基因的表达量进行分析,结果显示,随着感染时间的延长,GGPVAP基因的表达量逐渐上升,至24h时达到最大(P<0.05),之后转而下降,36h时降到12h时的水平(P>0.05)(图7)。
4 讨论
以本地分离的山羊痘病毒(GPV)感染敏感的Vero细胞,至24h时之前未检测到Vero细胞的凋亡,GPV作用48h时才检测到Vero细胞凋亡,凋亡率13%,同时以台盼蓝染色检测到Vero细胞的大量坏死。大肠杆菌志贺样毒素Stx2(2μg/mL)作用Vero细胞24h细胞的凋亡率就达到了90%[5]。相比之下,山羊痘病毒感染Vero细胞的凋亡率明显偏低,提示本地分离的山羊痘病毒作用于Vero细胞后凋亡发生的时间被推迟。进一步研究GPV感染Vero细胞过程中GGPVAP基因的表达量变化,结果显示,GGPVAP基因的表达量24h时出现峰值,之后转而下降,与Vero细胞凋亡率的变化呈反变关系。
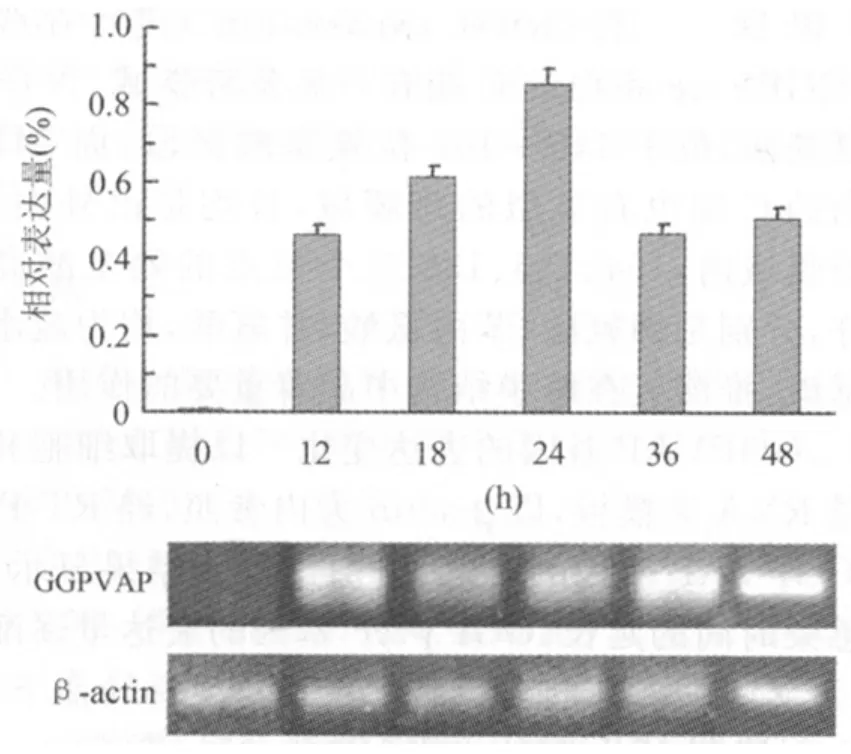
图7 GGPVAP基因的表达变化
牛痘病毒编码的CrmA蛋白是抗凋亡蛋白因子之一,可直接作用于IL-1β转化酶,抑制caspase的活化,阻断细胞凋亡的信号传递,抑制细胞凋亡[6];人传染性软疣病毒的 MC159/160蛋白,阻止caspase 8的活化,阻断Fas和TNFR1介导的细胞凋亡[7];黏液瘤病毒编码的 M11L蛋白定位于线粒体膜上,通过与Bak和Bax作用阻止线粒体凋亡途径的发生[8]。从贵州山羊痘病毒基因组中分离出山羊痘病毒的抗凋亡蛋白,与同属病毒凋亡蛋白的相似性95%~100%,M11L家族蛋白相似性为31%~36%,由此明确克隆到的基因GGPVAP确为山羊痘病毒抗凋亡蛋白基因。同时,GGPVAP蛋白的C-端含有与痘病毒家族抗凋亡蛋白类似的跨膜域,提示该跨膜域可能作为细胞内膜性受体或离子通道,抑制细胞凋亡信号的传导,起到延缓或抑制Vero细胞凋亡的作用。细胞凋亡是宿主细胞对病毒感染的主动防御机制之一,是免疫监控的一部分。被感染的细胞以凋亡方式阻止病毒繁殖,保护其他的组织细胞免遭病毒的侵害。GPV一旦进入宿主山羊的体内,就能迅速增殖,动物之间的传染率高、发病率也较高。由此推测GPV侵入后,表达的山羊痘病毒抗凋亡蛋白可以有效阻止宿主细胞的凋亡进程,至24h(可改为“至24h”),病毒已基本完成了病毒粒子的复制及其装配过程[1],结合本文的检测结果,24h后山羊痘病毒抗凋亡蛋白基因的表达量下降,宿主细胞的凋亡或坏死得以发生,此时细胞发生的坏死导致的破裂则有助于病毒的释放,进一步侵染其他的细胞。
[1]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:939-963.
[2]徐春志,周碧君,岳筠,等.感染细胞与痘疹样本中山羊痘病毒PCR检测方法的建立[J].中国兽医学报,2008,28(12):1387-1390.
[3]Ching J C Y,Jones N L,Ceponis P J M,etal.Escherichia coliShiga-Like Toxins Induce Apoptosis and Cleavage of Poly(ADP-Ribose)Polymerase via In Vitro Activation of Caspases[J].Infection and Immunity,2002,46-70.
[4]罗阿东,岳筠,程振涛,等.山羊痘病毒基因组DNA的提取及酶切分析[J].动物医学进展,2008,29(8):1-4.
[5]李灿,冉雪琴,王嘉福.猪水肿病毒素Stx2e的致Vero细胞凋亡作用[J].微生物学报,2009,49(5):658-663.
[6]DobóJ,Swanson R,Salvesen G S,etal.Cytokine Response Modifier A Inhibition of Initiator Caspases Results in Covalent Complex Formation and Dissociation oftheCaspaseTetramer[J].The Journal of Biological Chemistry,2006,281(50):38781-38790.
[7]Nichols D B,Shisler J L.Poxvirus MC160Protein Utilizes Multiple Mechanisms To Inhibit NF-B Activation Mediated via Components of the Tumor Necrosis Factor Receptor 1Signal Transduction Pathway[J].Journal of Virology,2009,83(7):3162-3174.
[8]Su J,Wang G,Barrett J W,etal.Myxoma Virus M11L Blocks Apoptosis through Inhibition of Conformational Activation of Bax at the Mitochondria [J].Journal of Virology,2006,80(3):1140-1151.

