人孕中期羊水干细胞体外转化为神经细胞的实验研究
李 欢,高 垚,王欢欢,常 颖*
(1.吉林大学中日联谊医院 神经内一科,吉林 长春130033;2.长春市中心医院 神经内科,吉林 长春130051)
羊水干细胞是近几年来备受关注的一类具有多向分化潜能的组织干细胞,在体外不同的诱导条件下,可以向神经细胞、肌细胞、内皮细胞等分化[1]。本实验探讨了在体外特定的诱导条件下,成人羊水干细 胞 (human amniotic fluid-derived stem cells,hFSCs)向神经元细胞转化的规律,为羊水干细胞应用于临床提供可靠的实验数据。
1 材料与方法
1.1 AmnioMAX-Ⅱ培养基
α-MEM(Gibco公司);胎牛血清、HEPES缓冲液、bFGF(Hyclo ne公司;胰蛋白酶、β-巯基乙醇(Sigma公司);荧光素标记小鼠抗人CD44、CD45抗体(eBioscience公司);鼠抗人的 NSE、GFAP(福州迈新生物技术开发公司);倒置相差显微镜(Olympus);YJ-2操净台 (苏州净化设备厂);CO2孵箱(SANYO日本)
1.2 方法
1.2.1 hAFC的原代培养 羊水标本来自怀孕16-22周行产前检查或自愿引产的孕妇,在超声引导下行羊膜腔穿刺取得20ml羊水。取标本前均征得孕妇本人同意,并得到医院伦理委员会批准。羊水标本在室温下1000/min离心5min,弃上清,加入AmnioMAX-Ⅱ培养基,置37℃、5%CO2饱和湿度培养箱,出现梭形细胞为主、类成纤维细胞的细胞集落且达70%汇合后,0.25%胰蛋白酶1mmol·L-1EDTA消化后,改用α-MEM+10%胎牛血清+4 μg/LbFGF培养基,接种培养,记为第1代(P1)。细胞生长达到80%融合时按1∶4的比例传代。
1.2.2 hAFC的传代培养 原代培养一旦铺满整个培养板的底部,即可用0.25%胰蛋白酶1mmo l·L-1EDTA液消化、分离,然后按3×104/cm2密度传代接种于6孔培养板中,并记为P1;传代培养直至贴壁细胞彼此融合,铺满整个培养板的底面;再重复以上操作,并记为P2,以此类推,传代培养直至细胞出现衰老征相。传代培养的接种密度严格控制在与原代培养接种密度相同的水平以便于对照。
1.2.3 hAFC细胞表面分子测定 第10代细胞80%~90%融合后,用0.25%胰酶1mmol·L-1EDTA液消化细胞,制成2×105/mL的单细胞悬液,分别加入3个Eppendof管中。A管为标准对照,加入5μL IgG1-FITC的单克隆抗体;B管加入5μLCD44-FITC单克隆抗体;C管加入5μL CD45-FITC单克隆抗体,室温反应30min,流式细胞仪检测。
1.2.4 羊水细胞核型分析 取生长良好的细胞第10代、20代羊水干细胞进行核型分析。细胞培养液中加入秋水仙素,培养4h后胰蛋白酶消化收集细胞,然后固定、制片、Gimsa染色后镜下观察并分析结果。
1.2.5 实验分两组 实验组及对照组,实验组又分:NSE组、GFAP组和尼氏染色组,每组包括18个细胞爬片。将第10代的hFSCs按3×103/cm2接种于24孔培养板中(预先放置经赖氨酸处理的盖玻片。细胞80%~90% 融合后,弃去培养液,细胞用含20%FCS、10ng/ml bFGF的α-MEM 预诱导24h,更换培养液,PBS洗涤3次,再加入含5 mmol/Lβ-巯基已醇的无血清α-MEM进行诱导,诱导5h,然后进行尼氏体及免疫组织化学染色。实验对照组用未诱导的hFSCs爬片直接进行NSE、GFAP染色。诱导后的细胞染色后随机取10个非重叠视野(×100),计算阳性细胞占细胞总数的比例,结果用均数±标准差(±s)表示。
2 结果
2.1 hAFC的分离、纯化、扩增 原代培养4d可见有细胞贴壁,平均7d左右散在的梭形细胞为主、类成纤维细胞的细胞集落。平均14天左右可达80%融合。传代培养后,12h即可贴壁,细胞呈较均一的长梭形,7d左右细胞可铺满整个培养瓶底面,可继续传代扩增。传代后的细胞形态无明显变化,性质稳定。
2.2 hAFC表型 hFSC均一表达CD44,但CD45阴性。
2.3 第10代、20代羊水干细胞检测干细胞核型正常,为46XX和46XY。
2.4 hFSC向神经细胞转化过程中细胞形态变化诱导30min,即发现原来大而扁平的hMFSCs胞体发生收缩;诱导2h后,细胞进一步收缩,胞体由长梭形逐渐变成圆形或类圆形,立体感增强,有许多细的指状突起(见图1a)。5h后细胞形态基本不再发生变化,有80%以上的细胞呈典型的神经元样形态,多个神经样细胞的突起可相互延伸形成网状(见图1b)。6h以后,大部分细胞从培养板上脱落,死亡。对照组细胞仍然保持宽大扁平的状态。
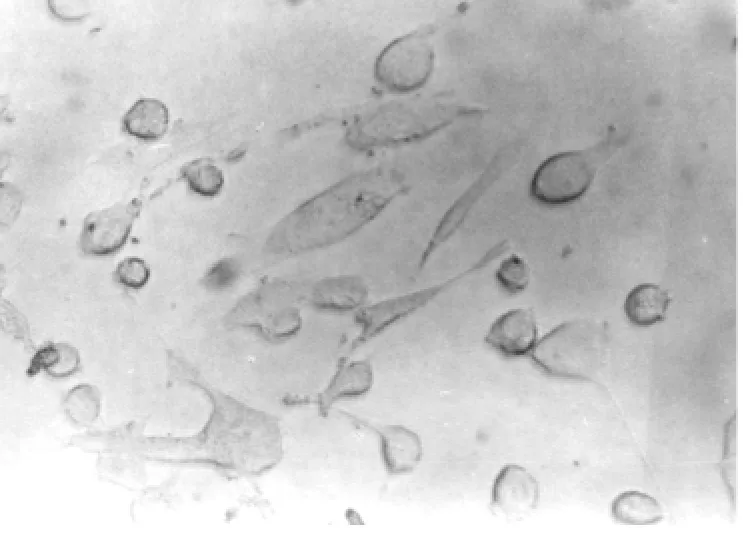
图1a 诱导2h细胞形态的改变×200
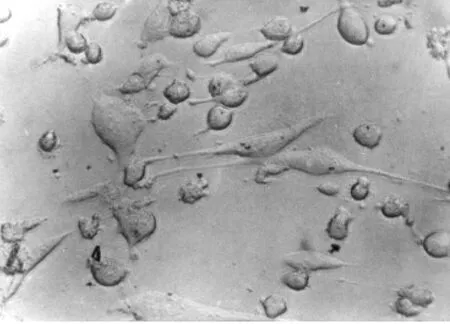
图1b 诱导5h细胞形态改变×200
2.5 尼氏染色 第10代hFSCs诱导2h后,神经元细胞胞质中未见深蓝色的尼氏体;在诱导5h后的胞浆中均可见深蓝色的颗粒状尼氏体,未诱导的hFSCs胞浆中未见明显的深蓝色尼氏体结构。
2.6 免疫组织化学染色 未诱导的hFSCs不表达NSE、GFAP。诱导5h后的细胞表达NSE,不表达GFAP(见图2a);NSE阳性细胞表现为弥漫性胞浆棕褐色着色(见图2b),诱导5hNSE阳性细胞数为(79.8±1.9)%。
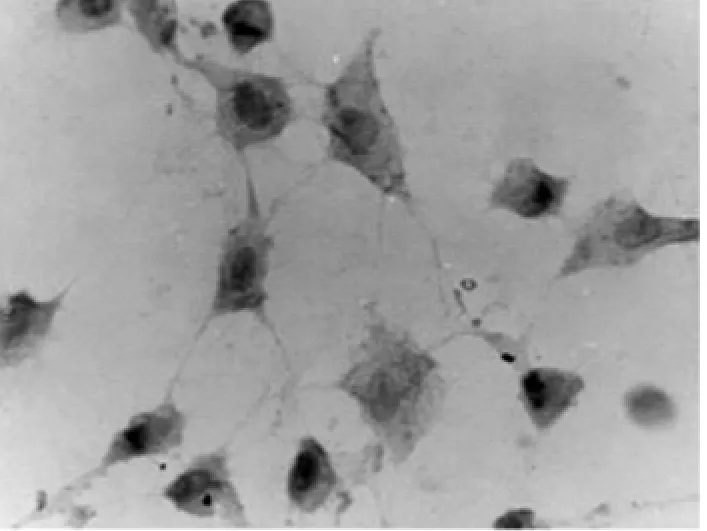
图2 a 向神经细胞诱导5hNSE染色×200
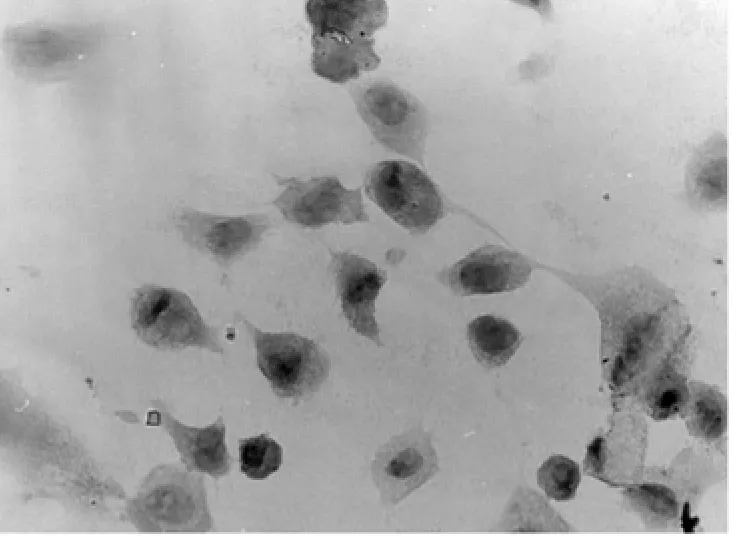
图2 b 向神经细胞诱导5hGFAP染色×200
3 讨论
随着组织工程的兴起和发展,细胞替代治疗将成为攻克一些疑难病症的新途径。目前,科学家们真在尝试通过组织工程技术将组织干细胞体外扩增和定向诱导为所需细胞,然后植入患者体内,用以修复损伤、替代退行性组织以及改善遗传性缺陷组织的功能。羊水干细胞最早是在2003年被Prusa[2]等发现;2007年,Paolo[3]等将由羊水中分离获得的干细胞命名为羊水干细胞(AFC),这种细胞表达MSC(Mesenchymal stem cell)、不表达造血细胞系标记,90%的细胞表达Oct-4;这一发现引发了羊水干细胞研究的热潮,羊水干细胞有望成为新的干细胞种子来源,应用于细胞及基因治疗。
FSCs在羊水中的峰度并不高[4],因此在体外条件下进行分离、纯化并实行体外扩增就显得尤为重要。本实验采用羊水专用培养基(美国Hyclone公司AminioMAX-Ⅱcomplete培养基),结合机械分离方法从羊水中分离出间充质干细胞,并成功的在体外扩增。虽然目前国内外的科学家都致力于羊水干细胞的研究,但尚未发现AFC特征性的表面标记。AFC在细胞表型上类似于胚胎干细胞和成人骨髓间充质干细胞,即SH2、CD44和CD90阳性,CD34、CD45 和 CD117HLADR 阴 性[5];在 AFSC表面标记中引人注意的是POU转录因子4(Oct-4)等胚胎特异性标记的表达[6],提示羊水中存在比间充质干细胞发育更原始、增殖和分化能力更强、更接近于胚胎干细胞的细胞。本实验流式细胞仪检测其表达MSC细胞表面标记CD44,不表达造血干细胞标记CD45,因此证明我们培养的羊水细胞是具有MSC特性的干细胞。
本实验依据 Tsai[7]和Paolo[8]及王晗[9]的方法,取扩增第10代的hMFSC,先用含细胞用含20%FCS、10ng/ml bFGF的α-MEM 预诱导24h,更换培养液,再用含5mmol/Lβ-巯基乙醇的无血清DMEM培养液向神经细胞方向进行诱导,结果显示诱导5h后的hMFSCs均一表达NSE,胞质中可见深蓝色的神经元细胞特有的尼氏体结构。
NSE和GFAP均为一种胞浆蛋白,NSE主要表达于神经元;GFAP主要表达于星形胶质细胞。本实验hFSCs诱导后,免疫组织化学鉴定结果显示,诱导后的细胞均表达NSE,而不表达GFAP。组织化学实验结果显示,诱导后的细胞具有神经元的特有结构尼氏体形成。说明BME的诱导具有定向性,主要是向神经元细胞分化,而不是向星形胶质细胞分化。
体外诱导间充质干细胞分化为神经细胞目前主要有两种方法,抗氧化剂[10]和生长因子诱导[11],抗氧化剂快速、分化率较高,但细胞不能长期存活;生长因子诱导,诱导后的细胞存活时间较长,但分化率较低。BME作为一种强的抗氧化剂,它的这种定向诱导作用可能与其能将细胞从氧化状态中释放出来有关,但具体的作用机理还不十分清楚;而且做为强氧化剂,BME对细胞有一定的毒性,因此在体外诱导实验中,细胞在BME诱导液中不能长期存活,在6h后,大部分细胞从培养板中脱落下来,死亡。一些实验表明:在一定的神经生长因子存在的情况下,hFSCs可以向多巴胺能神经元定向分化5。这表明,hFSCs向不同的方向分化需要不同的环境条件,细胞的定向分化性是受周围环境因素影响和决定的,因此对这些分化机理的深入研究,将最终使我们更广泛地应用组织工程进行细胞替代治疗。
从实验中我们可以看到,hFSCs在BME诱导下,可定向分化为神经元样细胞,细胞表达NSE,但诱导后的细胞不能长期存活,体外存活时间短;但文献报道的采用神经营养因子作为诱导剂的实验中,虽诱导后的类神经元细胞可存活时间较长,但诱导分化的阳性率较低。hMFSCs作为细胞替代治疗的种子细胞,如何找到诱导后既能长期存活,又能有较高诱导转化率的适宜体外诱导条件,是值得我们进一步研究、探索的问题。
[1]Coppi PD,Bartsch G,Siddiqui MM,et al.Isolation of amniotic stem cell lines with potential for therapy[J].Nat Biotech,2007,25(1):100.
[2]Prusa AR,Marton E,Rosner M,et al.Oct-4expressing cells in human amniotic fluid:a new source for stem cell research[J]?Hum Reprud,2003,18(7):1489.
[3]Paolo DC,Georg B,Minhaj S,Tao X,et al.Isolation of amniotic stem cell lines with potential for therapy[J].Nature Biotechnology,2007,25(1):100.
[4]Kolambkar YM,Peister A,Soker S,et al.Chondrogenic differentiation of amniotic fluid-derived stem cells[J].J Mol Histol,2007,38(5):405.
[5]Sartore S,Maddalena L,Annalisa A,et al.Amniotic mesenchymal cells autotransplanted in a porcine model of cardiac ischemia do not differentiate to cardiogenic phenotypes[J].Europ J Card Surg 2005,28:677.
[6]Bossolasco P,Montemurro T,Cova L.et al.Molecular and phenotypic characterization of human amniotic fluid cells and their differentiation potential[J].Cell Res,2006,16(4):329.
[7]Tsai MS,Hwang SM,Tsai YL,et al.Clonal amniotic fl uid-derived stem cells express characteristics of both mesenchymal and neural stem cells[J].Biol Reprod,2006,74:545.
[8]Paola DG,Cristina L,Matteo B,et al.A real-time PCR approach to evaluate adipogenic potential of amniotic fluid-derived human mesenchymal stem cells[J].Stem Cells Dev,2006,15(5):719.
[9]王 晗.人源羊水干细胞分离、培养、生物学特性检测机诱导分化的研究(博士论文),2008.
[10]Woodbury D,Schwarz EJ,Prockop DJ,Black IB.Adult rat and human bone marrow stromal cells differentiate into neurons[J].J Neurosci Res,2000,61:364.
[11]Sanchez-Ramos J,Song S,Cardozo-Pelaez F,Hazzi C,Stedeford T,Willing A,Freeman TB,Saporta S,Janssen W,Patel N,Cooper DR,Sanberg PR.Adult bone marrow stromal cells differentiate into neural cells in vitro[J].Exp Neurol,2000,164:247.

