鼠曲草多糖的提取及抗氧化性的研究
陈文燕,欧晓素,郑诗漫,林燕如
(韩山师范学院化学系,广东潮州 521041)
潮汕民间有一传统小食“鼠曲粿”,它的原料之一为鼠曲草.鼠曲草(Gnaphlium affine D.Don)别名为鼠耳、鼠耳草、香茅、黄花白艾等,系菊科鼠曲草属植物.鼠曲草分布在我国大部分地区,来源广泛,原料易得,具有降血脂、降血糖、降血压、抗衰老、消炎抑菌、增强免疫力等多种功效[1-2].为此,笔者开展了鼠曲草多糖的提取工艺和抗氧化活性的研究,从而为鼠曲草的全面开发利用提供参考.
1 材料与方法
1.1 试验材料与仪器
鼠曲草采自潮州湘桥区桥东郊区,将鼠曲草洗净,去杂质,置于50℃烘箱中烘干,粉碎,用石油醚回流脱脂,再用80%乙醇回流,除去单糖和低聚糖,抽滤,将其烘干装瓶,置于干燥器中备用.
1.2 试验方法
1.2.1 多糖的提取
多糖的提取工艺流程[3-6],将鼠曲草粉末按比例加水混合→超声波浸提→抽滤→浓缩溶液→用高岭土脱色→抽滤→醇沉→离心→洗涤沉淀→将沉淀配制成50 mL的溶液→用Seveage法除蛋白质→过滤→配制成100 mL待测.选取超声波功率、超声波时间、浸提温度、料液比做单因素试验[5,7].在单因素实验的基础上对超声波功率、料液比、浸提温度、超声波时间等因素进行正交试验,因素水平如表1所示.
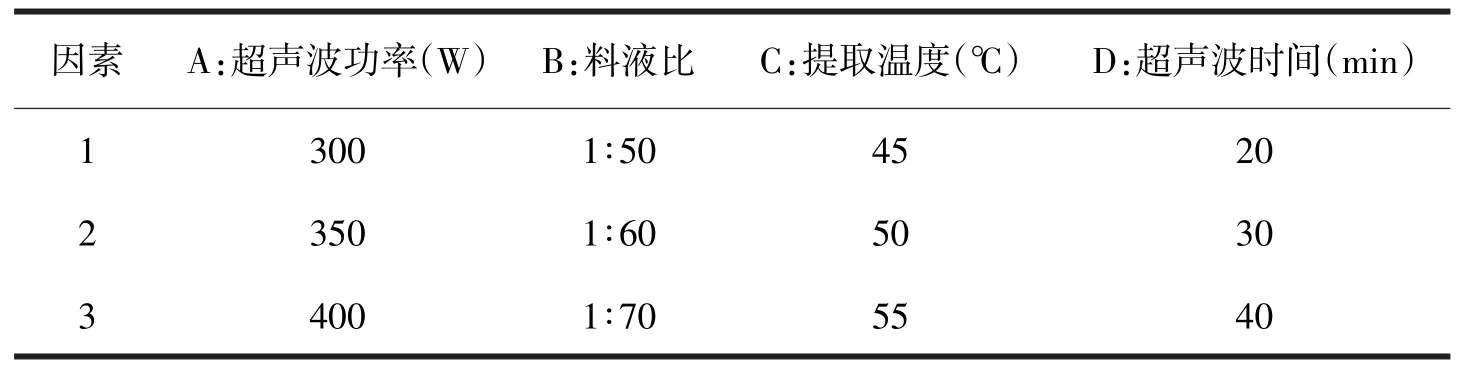
表1 正交设计因素水平
1.2.2 多糖的测定
多糖标准曲线的制备[8,9]:以葡萄糖为标样绘制标准曲线,最大吸收波长为490 nm,标准曲线方程:y=5.13x+0.1533,R2=0.9999,式中x为葡萄糖浓度,y为吸光度.
多糖含量的测定[10]:量取2 mL样品置于比色管中,以空白液作为对照,用硫酸-苯酚法于波长为490 nm处测定吸光度,根据标准曲线方程计算多糖的含量(多糖含量的计算公式:W=VCD/2000m,式中:V:浸提液体积,mL;C:从葡萄糖线性方程中求得的2 mL稀释液中葡萄糖的浓度,mg/mL;D:稀释倍数;m:鼠曲草的质量,g).
1.2.3 鼠曲草多糖的抗氧化性试验
羟自由基的清除,方法参照李婕姝[11]和李玲[12]并加以改进.在10 mL比色管中依次加入0.75 mmol/L的FeSO4溶液3 mL,9 mmol/L的水杨酸溶液3 mL,1 mmol/L的H2O2溶液3 mL,加蒸馏水定容至10 mL.摇匀,放入37℃恒温水浴槽中恒温15 min后取出,在510 nm波长下测其吸光度为A0.按上述体系,分别加入待测液为2 mg/mL的鼠曲草多糖溶液0.20、0.40、0.60、0.80、1.00 mL,蒸馏水定容至10 mL,摇匀,37℃水浴中继续恒温15 min,取出测其吸光度为AX.在10 ml比色管中依次加入0.75 mmol/L的FeSO4溶液3 mL,9 mmol/L的水杨酸溶液3 mL,1 mmol/L的H2O2溶液3 ml,再分别加入2 mg/mL的柠檬酸溶液、抗坏血酸溶液和鼠曲草多糖溶液各为0.2 mL,用蒸馏水定容至10 mL,混匀,37℃水浴加热15 min后测其吸光度,比较柠檬酸、抗坏血酸和鼠曲草多糖溶液对·OH的清除能力.待测液对羟自由基·OH清除率计算公式为:·OH清除率(%)=(A0-Ax)/A0×100%.式中A0是不加多糖溶液的吸光度;Ax是加入多糖溶液后的吸光度.
超氧阴离子的清除,具体方法参照李婕姝[11]和李玲[12]并加以改进.往10 mL比色管中加入pH8.20的磷酸缓冲液5 mL,分别加入2 mg/mL的鼠曲草多糖溶液0.00、0.20、0.40、0.60、0.80、1.00 mL(不加待测液为空白对照).再各加入2 mmol/mL的邻苯三酚1 mL和缓冲溶液使其总体积达到9 mL,并以蒸馏水作参比,然后立即混匀,再在325 nm下测定吸光值A325,每隔30 s测一次直反应启动后的第6 min,把所得的数据以时间为横坐标,A322值为纵坐标进行线性回归,得到直线斜率为反应速率V空、V样.参照上述体系,往10 mL比色管中加入pH为8.20的磷酸缓冲液5 mL,加入浓度为2 mg/mL的柠檬酸溶液和鼠曲草多糖溶液,加入2 mmol/mL的邻苯三酚1 mL,加入缓冲溶液使体系总体积达到9 mL,并以蒸馏水作参比,然后立即混匀,在325 nm下测定吸光值A325,每隔30 s测一次直到反应启动后的第6 min,把所得的数据以时间为横坐标,A322值为纵坐标进行线性回归,得到直线斜率为反应速率V空、V样.以柠檬酸对·的清除作对比分析.超氧阴离子的清除率按下式计算:O-2·清除率(%)=(V空-V样)/V空×100%.式中:V空是不加多糖溶液的反应速率;V样是加入多糖溶液的反应速率.
其中:rj为第j个反应的反应速率,mol/(m3·s);ε为空隙率系数;C为气体浓度,mol/m3;t为时间,s;k0,j为指前因子,mol(1-a)/(m3(1-a)·s),a为动力学方程中甲烷浓度的指数,数值由试验确定;Ej为第j个反应的活化能,J/mol;R为气体常数,J/(mol·K);T为温度,K;aj为浓度项的指数。图3a、图3b的反应气体为CH4,图3c的反应气体为CO。根据试验预估的动力学参数见表1。
2 结果与分析
2.1 不同提取条件下鼠曲草多糖的提取
2.1.1 超声波功率
超声波功率不同,其他条件相同(料液比1∶40,温度50℃,超声波时间20 min,浸提1次).由图1可知,鼠曲草多糖的提取效率先是随着超声波功率的增加而增大,当功率为350 W时多糖含量达到最大值.但当功率大于350 W后,多糖提取率开始降低,这可能是由于超声波功率过高引起多糖结构的变化,甚至使多糖降解,导致多糖提取量减少.因此,鼠曲草多糖提取时最佳超声波功率应该是300~400 W之间.
2.1.2 超声波时间
超声波时间不同,其他条件相同(料液比1∶40,温度50℃,超声波功率350 W,浸提1次).由图2可知,当超声波浸提30 min时多糖的提取效率是最高的.浸提时间小于30 min时,多糖提取不充分,而浸提时间大于30 min,则出现随着浸提时间延长效率减低的趋势.因此,超声波时间选在20~40 min之间效果最好.
2.1.3 浸提温度
浸提温度不同,其他条件相同(料液比1∶40,超声波时间30 min,超声波功率350 W,浸提1次).由图3可知,当温度为50℃时,多糖含量最高.当温度小于50℃时,因为其温度较低,多糖未能充分析出,所以随着温度的升高提取液中多糖含量逐渐增加.当提取温度超过55℃时,随着温度上升,多糖提取效率反而下降,这可能是因为温度过高导致多糖被降解或破坏,故温度选在45~55℃之间效果最好.
2.1.4 料液比
料液比不同,其他条件相同(温度50℃,超声波功率350 W,超声波浸提时间30 min,浸提1次).鼠曲草质量为1 g,由图4可知,当料液比为1∶60时,多糖含量达到最高.在料液比为1∶40至1∶60时,鼠曲草的多糖含量增长比较快,从1∶60至1∶80,多糖含量下降较大,到了1∶80时,多糖含量变为1.31 mg/g.提取多糖时料液比太小,提取不完全,料液比太大,浓缩时间过久,多糖溶液受热时间过长,导致多糖大部分损失,多糖含量降低.因此,鼠曲草多糖提取的最佳料液比应该在1∶50~1∶70之间效果最好.
2.1.5 提取条件的正交优化

图1 不同超声波功率对多糖含量的影响
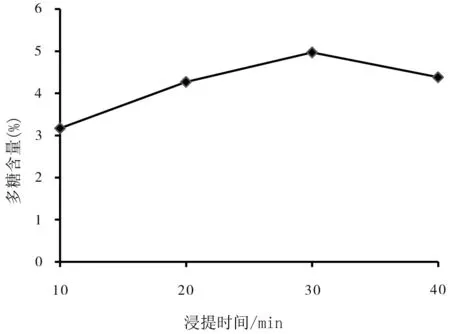
图2 不同超声波时间对多糖含量的影响

图3 不同浸提温度对多糖含量的影响
选择超声波功率、料液比、浸提温度、超声波时间这四个因素,选用L9(34)正交表安排试验,以多糖含量为指标,优选最佳工艺.因时间和浓缩成本的关系,各只浸提一次.由表2可知,根据极差R分析,多糖提取条件因素的主次顺序分别是料液比>超声波时间>超声波功率>浸提温度,超声波提取鼠曲草多糖的最佳条件是A3B3C3D2,即料液比1∶70、超声波时间为30 min、超声波功率为400 W、浸提温度为55℃.由于该组合未出现在试验中,需要测定该条件下鼠曲草多糖的含量.经测定,鼠曲草在该条件下的多糖含量达到11.67 mg/g,高于正交试验表中任一组合的多糖含量,说明正交试验确定的最佳超声波萃取条件是合理的.
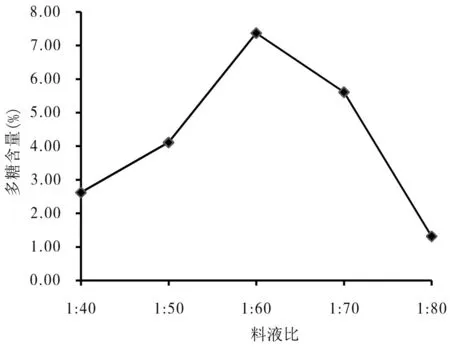
图4 料液比不同对多糖含量的影响
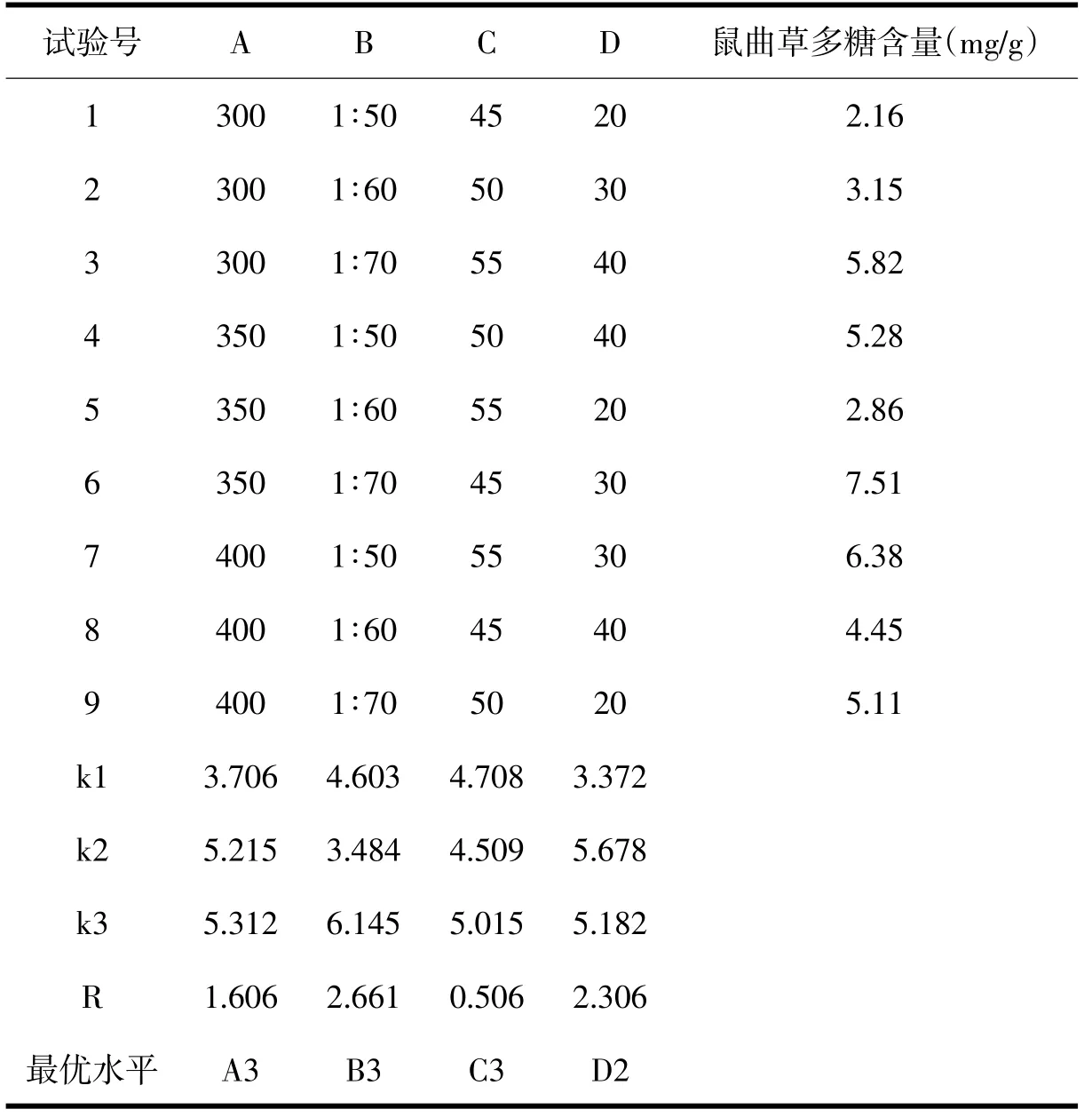
表2 L9(34)正交试验结果
2.2 鼠曲草多糖的抗氧化性
2.2.1 对羟自由基的清除能力
由图5可知,在鼠曲草多糖添加量为0.4~2.0 mg范围内,随着鼠曲草多糖添加量的增加,清除羟自由基的能力逐渐增强.当鼠曲草多糖添加量为2.0 mg时,其清除率为42.59%,说明适当增加鼠曲草多糖的量有利于提高对羟自由基的清除效果.由图6可知,在相同鼠曲草多糖添加量下,几种抗氧化剂对羟自由基的清除效果为柠檬酸(52.81%)>抗坏血酸(33.94%)>鼠曲草多糖(32.30%).鼠曲草多糖的清除效果与抗坏血酸的相近,说明鼠曲草多糖对羟自由基的清除有一定的效果.
2.2.2 对超氧阴离子的清除能力
由图7可知,在鼠曲草多糖添加量为0.4-2.0 mg范围内,随着鼠曲草多糖添加量的增加,清除超氧阴离子的作用逐渐增强.当添加量为2.0 mg时,其清除率为28.76%,说明适当增加鼠曲草多糖添加量有利于提高对超氧阴离子的清除效果.由图7可知,在相同添加量下,柠檬酸对超氧阴离子的清除率小于鼠曲草多糖.鼠曲草多糖对超氧阴离子的清除率为31.71%,柠檬酸的清除率为20.54%,说明鼠曲草多糖对超氧阴离子的清除效果明显.
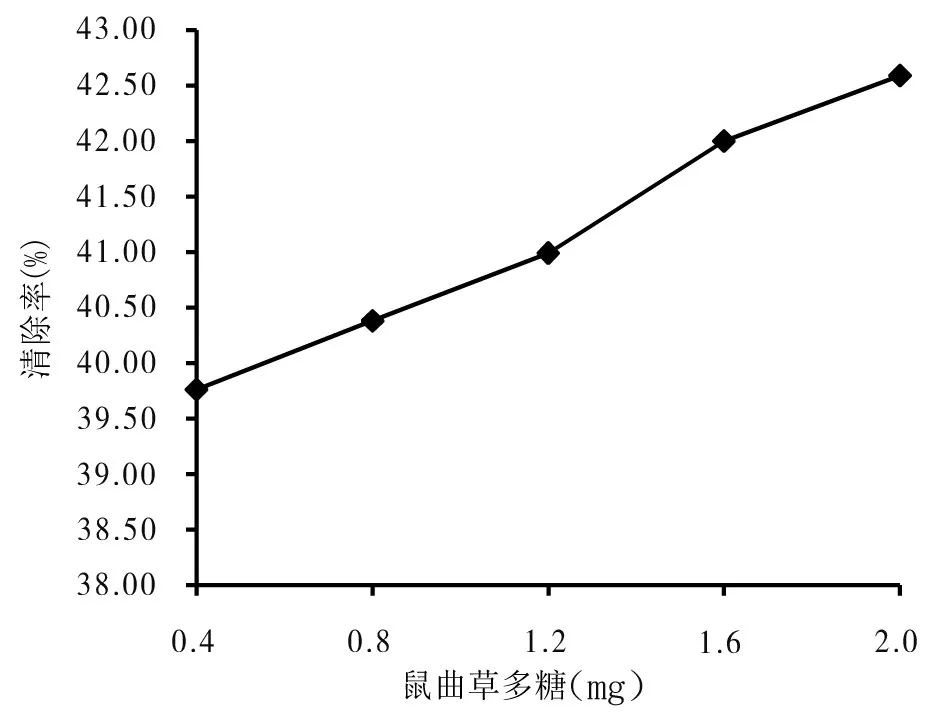
图5 鼠曲草多糖对羟自由基的清除作用
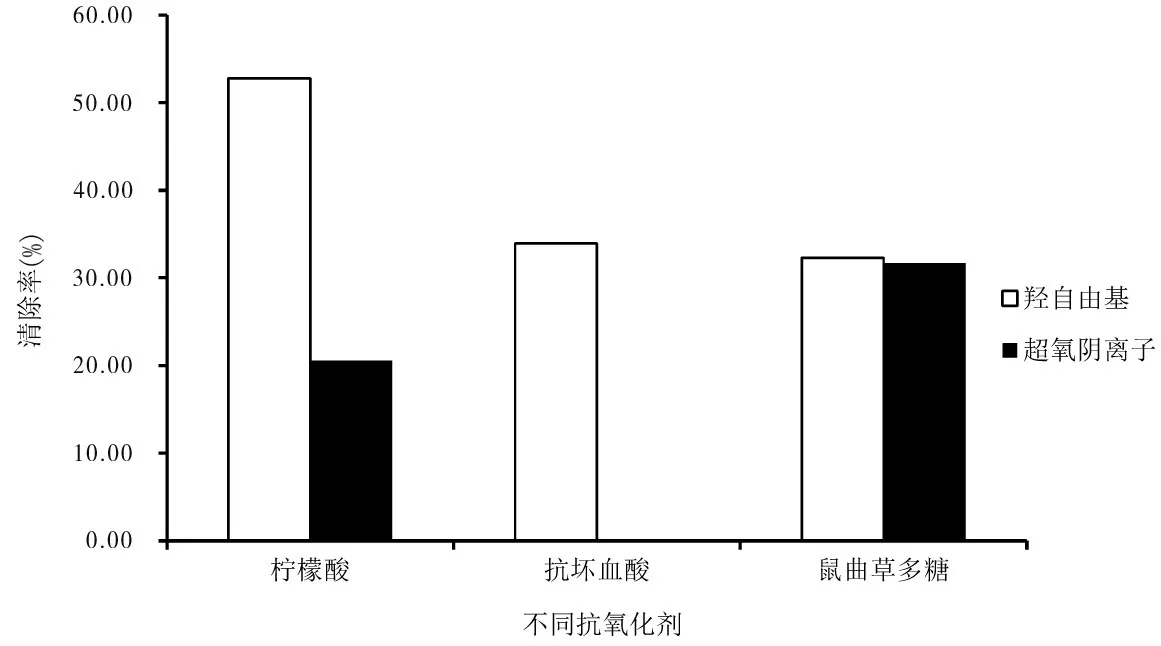
图6 不同抗氧化剂对羟自由基及超氧阴离子的清除效果
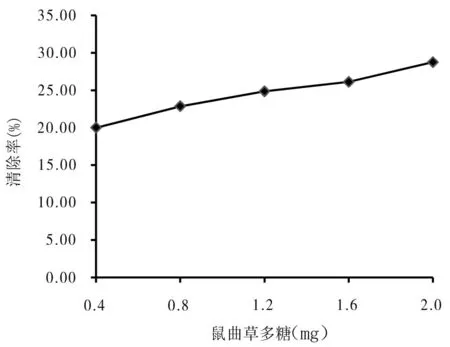
图7 鼠曲草多糖对超氧阴离子的清除作用
3 结论
本研究通过单因素以及正交试验设计对影响鼠曲草多糖提取效率的超声波功率、料液比、浸提温度、超声波时间等因素进行研究,结果表明料液比1∶70,超声波功率400 W,超声波时间30 min,浸提温度55℃为鼠曲草多糖的最佳提取工艺.在此条件下,鼠曲草的多糖含量是11.67 mg/g.同时,此次实验还对鼠曲草多糖的抗氧化性进行研究,结果表明鼠曲草多糖具有较好的清除羟自由基以及超氧阴离子的能力.该研究为鼠曲草这一植物资源的进一步开发和利用奠定了基础.
[1]陆英,李洁,邱文敏,等.大孔树脂分离纯化鼠曲草中黄酮类化合物研究[J].湖南农业大学学报:自然科学版,2009,35(5):497-500.
[2]徐玉婷,吴丹慧.鼠曲草的研究进展[J].医药导报,2012,31(2):192-194.
[3]张桂,赵国群.超声波萃取植物多糖的研究[J].食品科技,2005,26(9):302-305.
[4]刘宝岩.淫羊藿多糖提取方法的优化[J].广西轻工业,2009,25(12):7-8.
[5]张永军,刘晓宇,黄惠华.响应面法优化葛根多糖提取工艺的研究[J].现代食品科技,2008,24(7):678-682.
[6]韩淑琴,扬洋,黄涛,等.超声波法提取仙人掌多糖的工艺研究[J].中国食品添加剂,2006(6):72-75.
[7]沈晓丽,吴娜,蒋新月,等,若羌红枣多糖超声波提取条件的探索[J].现代食品科技,2008,24(8):798-802.
[8]勾建刚,刘春红.白茅根多糖超声提取的优化[J].时珍国医国药,2007,18(11):2749-2750.
[9]郭守军,杨永利,施楚彬,等.超声波辅助提取龙须菜多糖的工艺优化[J].食品研究与开发,2006,27(10):14-17.
[10]方升平,王维香,雒小龙.川芎多糖除蛋白方法研究[J].时珍国医国药,2009,20(9):2176-2177.
[11]李婕姝,贾冬英,姚开,等.荸荠皮多糖体外清除自由基活性的研究[J].氨基酸和生物资源,2008,30(4):7-9.
[12]李玲,陈常秀.大枣多糖的分离及抗氧化性研究[J].食品研究与开发,2009,30(9):49-51,64.

