Rap1 gAP蛋白表达与卵巢癌之间的关系
付海燕 孙立新
卵巢癌是妇女常见的三大恶性肿瘤之一,而肿瘤的发生发展是多种基因改变和多阶段致癌的复杂过程,原癌基因的激活和抑癌基因的失活是其发生的主要机制。Rap1是Ras家族GTP酶中的一员,在调节细胞增殖、黏附中起着重要作用[1]。Rap1 gAP是新近发现一种肿瘤相关的抑制基因,通过调控Rap1的活性,参与细胞增殖、分化及整合蛋白介导的细胞基质粘附和钙调蛋白介导的细胞间的粘附等生命活动的调节。本文比较了卵巢癌、卵巢良性肿瘤及正常卵巢组织中的Rap1 gAP蛋白表达情况,研究其与卵巢癌发病之间的关系。
1 资料与方法
1.1 一般资料 2010年2月至2010年12月之间于我院因多发子宫肌瘤或子宫肌腺症行全子宫及双附件切除患者10例(A组),年龄为50~55岁,平均(52.3±1.767);卵巢良性肿瘤切除患侧卵巢者10例(B组),年龄50~60岁,平均(54.4±3.239);行卵巢癌分期术20例年龄为50~60岁,平均(55.25±2.489)岁,术后按照FIGO的手术-病理分期分为Ⅰ-Ⅱ期10例(C组),年龄为50~60岁,平均(55.2±3.155)岁;Ⅲ-Ⅳ期10例(D组),年龄为53~58岁,平均(55.3±1.767)岁。切除正常卵巢组织的病例均为50岁以上、无生育要求、要求行子宫全切同时行双附件切除的多发子宫肌瘤或子宫肌腺症患者,无伦理学纠纷。
1.2 研究方法 使用免疫组织化学法检测Rap1 gAP蛋白在卵巢组织的表达。结果分为阳性、弱阳性及阴性。
1.3 统计学方法 使用SPSS 11.5软件进行统计学分析,计数资料使用用χ2检验。
2 结果
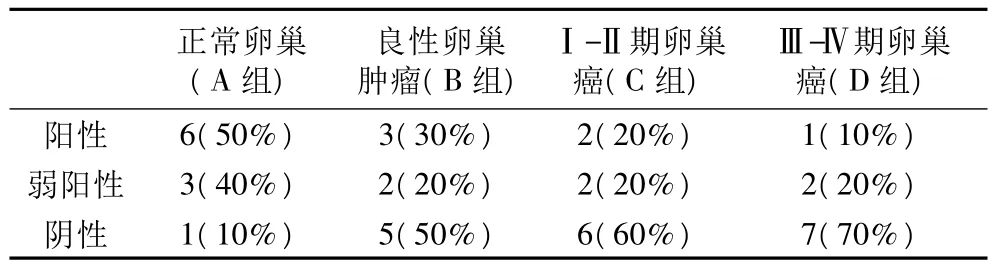
表1 Rap1 gAP蛋白在卵巢组织中的表达(例,%)
2.1 Rap1 gAP表达阳性率的比较:①A高于其他三组:A组与B组比较,P=0.178,χ2=1.818;A组与 C组比较,P=0.068,χ2=3.333;A 组与 D 组比较,P=0.019,χ2=5.495*(差异有统计学意义)。②B组高于C组和D组:B组与C组比较,P=0.606,χ2=0.207;B 组与 D 组比较,P=0.264,χ2=1.250;③C组高于 D组:C组与 D组比较,P=0.531,χ2=0.351。
2.2 Rap1 gAP表达弱阳性率的比较 A组高于其他三组,P=0.606,χ2=0.207;其余三组弱阳性率相同均为20%。
2.3 Rap1 gAP表达阴性率的比较 ①A组低于其余三组:A组与B组比较,P=0.051,χ2=3.810;A组与C组比较,P=0.019,χ2=5.495*(差异有统计学意义);A组与D组比较,P=0.006,χ2=7.500*(差异有统计学意义)。②B组低于C组和D组:B组与C组比较,P=0.653,χ2=0.202;B组与D组比较,P=0.361,χ2=0.833。③C组低于D组:C组与D组比较,P=0.639,χ2=0.220。
3 讨论
卵巢癌是妇女常见的三大恶性肿瘤之一,其中60%~90%是卵巢上皮性癌(ovarian epithelial carcinoma,简称卵巢癌)。早期症状不多,而且,由于其位置深居盆腔,缺乏早期症状和体征,易受临床忽视,因而75% ~80% 的患者确诊时已属晚期,失去手术根治的机会,治愈率不到20%,5年生存率低于30%,死亡率高居妇科恶性肿瘤之首[2]。因此,研究卵巢癌发生的相关机理,对于该病的防治有着非常重要的作用。
近数十年来,经全世界的妇科肿瘤学专家的不懈努力,成功地探索出在肿瘤细胞减灭术的基础上辅助化疗的治疗策略,一部分患者虽然已经达临床缓解,但仍然有70%左右最终还要复发,其主要原因就是卵巢上皮细胞癌手术及化疗后的复发率高所致。
卵巢恶性肿瘤转移率和治疗后复发率高是目前治疗卵巢癌的难点之一,其侵袭转移是一个多阶段多步骤的复杂过程,涉及到细胞之间粘附性的改变,细胞外基质的降解,肿瘤细胞的免疫逃逸等过程,侵袭转移的过程是极其复杂,但细胞与细胞,细胞与细胞外基质的相互作用致细胞之间粘附性的改变,却贯穿于肿瘤细胞浸润和转移过程的始终[3]。因此,在肿瘤细胞发生侵袭和转移的过程中,参与细胞间相互作用的细胞黏附分子是肿瘤细胞恶性行为的基础,也是许多致癌因素综合作用的最终靶位点,也是肿瘤复发和转移的关键步骤。
Rap1是Ras家族GTP酶中的一员,在调节细胞增殖、黏附中起着重要作用。一系列的研究表明活化形式的Rap1能够促进细胞间粘附连接的形成,Rapl缺失可以抑制内皮细胞由整合素介导的粘附、迁移功能。人脐静脉内皮细胞Rapl缺失后,酪氨酸激酶p125EAK磷酸化减低。而p125FAK是调节细胞局部的粘附形成、肌动蛋白重组、细胞迁移等功能过程中重要的效应因。Rapl有两种结合形式:GDP结合形式和GTP结合形式。Rapl和GTP结合的时候,处于活化状态,而和GDP结合以后,其活性丧失,Rap1 gAP是小分子G蛋白Rapl的GTP酶激活蛋白,它可以加速Rapl由与GTP结合的活化形式转变为与GDP结合的去活化形式的过程。
肿瘤的发生发展是多种基因改变和多阶段致癌的复杂过程,原癌基因的激活和抑癌基因的失活是其发生的主要机制。Rap1 gAP是新近发现一种肿瘤相关的抑制基因,通过调控Rap1的活性,参与细胞增殖、分化及整合蛋白介导的细胞基质粘附和钙调蛋白介导的细胞间的粘附等生命活动的调节。它在胰腺癌和口腔癌细胞中可以抑制肿瘤细胞的增殖、转移和侵润[4]。在胰腺癌中,Rap1 gAP表达明显下降,转入Rap1 gAP基因的细胞的迁移能力降低,侵润能力也明显降低,而且将转染Rap1 gAP基因的胰腺癌细胞和未转染Rap1 gAP基因的胰腺癌细胞分别注入SCID小鼠胰腺尾部,发现转染Rap1 gAP基因的胰腺癌细胞形成的肿瘤比未转染Rap1 gAP基因的胰腺癌细胞形成的肿瘤要小的多。在口腔癌中,Rap1 gAP下调Rap1的活性、ERK的活性和细胞增殖;在转染Rap1 gAP基因的SCC细胞中,cyclinD1、cdk4、cdk6等周期蛋白表达均下降;并且将转染Rap1 gAP基因的SCC细胞注入裸鼠体内,发现其引起的肿瘤比对照小的多。
Shuk-Mei Ho等人发现在卵巢癌细胞中,Rap1 gAP的表达下调[5]。然而,Rap1 gAP在卵巢癌患者发病、转移等方面的研究尚未见相关报道。为研究卵巢癌与 Rap1 gAP蛋白表达之间的关系,以期揭示卵巢癌发生发展的机制我们开展了此项研究。
本文资料显示:①正常卵巢组Rap1 gAP蛋白表达阳性率高于良性肿瘤组及两卵巢癌组,与Ⅲ-Ⅳ期卵巢癌组相比差异有统计学意义;弱阳性率也高于其余三组;阴性率低于其余三组;与两卵巢癌组相比差异有统计学意义。②良性肿瘤组该蛋白表达阳性率高于两卵巢癌组;弱阳性率与两卵巢癌组相同;阴性率低于两卵巢癌组。③Ⅰ-Ⅱ期卵巢癌组Rap1 gAP蛋白表达阳性率高于Ⅲ-Ⅳ期卵巢癌组。根据以上研究结果显示:卵巢癌患者中Rap1 gAP蛋白表达的下调和缺失率高于正常卵巢组织,差异有统计学意义;良性卵巢肿瘤患者的Rap1 gAP蛋白表达的下调和缺失率介于正常和卵巢癌患者之间,但由于病例数较少,尚不能证明其差异有统计学意义。
[1]Mammalian Rap1 controls telomere function and gene expression through binding to telomeric and extratelomeric sites.Teo H,Ghosh S,Luesch H.Nat Cell Biol,2010,12(8):758-67.Epub 2010 Jul 11.
[2]孔繁斗,等.宫颈癌组织中Rap1 gAP蛋白表达及其与HPV感染的相关性.大连医科大学学报,2010,32(2):142-45.
[3]Lymph node involvement in epithelial ovarian cancer:sites and risk factors in a series of 355 patients.Fournier M,Stoeckle E,Guyon F.Int J Gynecol Cancer,2009 Nov;19(8):1307-13.
[4]Nellore A,Pazianak,MaC,et al.oss of Rap1 gAP in Papillary thyroid cancer,J Clin Endocrinol Metab,2009,94(3):1026-32.
[5]Shuk-Mei Ho1,Kin-Mang Lau1,Samuel Chi-ho Mok and Viqar Syed.Profling follicle stimulating hormone-induced gene expression changes in normal and malignant human ovarian surface epithelial cells.Oncogene,2003,22,4243-4256.

