2009甲型H1N1流感流行期间北京急性呼吸道感染儿童常见呼吸道病毒的研究
王婷婷 朱汝南 钱 渊 孙 宇 王 芳 邓 洁 曲 东 李 颖 任晓旭 沙 莉袁 艺 王 菲 李 杰 张宝元
2009年4月,一种新型H1N1流感病毒引起的流感在墨西哥暴发,之后迅速在全球多个国家引起广泛流行,直至2010年春天。首都儿科研究所病毒研究室是国家和北京市流感监测的网络实验室之一,接受首都儿科研究所附属儿童医院送检标本进行甲型H1N1流感病毒的筛查。2009年6月至2010年2月,共接收急性呼吸道感染患儿咽拭子标本4363份。在统计分析中发现,这些标本中有近70%为流感病毒阴性,推测其中有很大一部分为常见呼吸道病毒感染。Lovato-Salas等[1]通过对2009年4月至2010年3月下呼吸道感染相关的住院患者进行了2009甲型H1N1流感病毒和呼吸道合胞病毒(RSV)的检测发现,新型流感病毒流行期间,RSV感染仍是住院患儿的主要病因。目前针对新型流感病毒及其他常见呼吸道病毒感染的关系,中国尚未见研究报道。故本研究选取2009甲型H1N1流感流行期间,H1N1流感病毒检测阴性的急性呼吸道感染患儿标本,采用多重RT-PCR的方法,检测RSVA/B亚型,副流感病毒(PIV)1、2、3型,腺病毒(ADV)和人博卡病毒(HBoV),以了解2009甲型H1N1流感流行期间,上述呼吸道病毒在北京地区儿童中的流行特征有否受到甲型H1N1流感病毒流行的影响。
1 方法
1.1 H1N1流感病毒标本采集和处理 对在首都儿科研究所附属儿童医院门诊和急诊就诊的有急性呼吸道感染症状、疑似感染2009甲型H1N1流感病毒的患儿(症状表现:①发热>37.5℃;②无明显发热,但伴有咽痛、咳嗽、咳痰、流涕、肌痛等症状;③发病7d内)使用病毒采样管(海南兴南峰医药器械有限公司生产)采集咽拭子标本。具体方法为:临床医生用专用咽拭子棉签在患儿咽部左右扁桃体处以适当力度旋转擦拭,迅速将棉签放入装有3mL病毒采样液的采集管内,棉签末端折断并封口,于4℃暂存。同时登记患儿基本情况(姓名、性别、年龄、家庭住址、联系电话、有无2009甲型H1N1流感接触史等)及主要症状(发病天数、有无发热及体温情况、有无咽痛、咳嗽、流涕、肌痛等),标本及登记表于12h内送至病毒研究室后统一编号,常规处理后吸取标本液150μL于1.5mLEP管中,采用
QIAampⓇViral RNA Mini Kit(Qiagen,Valencia,USA)试剂盒,具体操作按照说明书,提取病毒核酸。剩余标本液吸入2mL冻存管中,于-20℃暂存后,置-80℃长期保存。
1.2 RSV、PIV、ADV和HBoV标本选取原则 ①经RTPCR流感病毒检测示2009甲型H1N1流感病毒结果为阴性且内参探针信号为阳性者(内参探针信号阴性则认为临床标本不合格,予以排除);②患儿基本情况及主要症状登记相对完整;③登记的临床症状符合急性呼吸道感染;④符合上述①~③项,但由于不同月份间2009甲型H1N1流感病毒结果为阴性的标本数量不等且实验条件有限,为保证在不同月份标本数相当,随意选取每周20~25个标本。
1.3 RSV、PIV、ADV和HBoV引物、探针的设计及合成
RSV检测所用探针及引物参照文献[1]。PIV、ADV和HBoV通过分析GenBank中相应病毒的序列,应用DNAStar软件及Primer Premier 5软件设计适宜的引物及探针:①PIV:在HN基因处,具有PIV 1、2、3型型特异性;②ADV:在六邻体(Hexon)基因处,包含 ADV1、2、3、5、7、11、14、21型等主要引起呼吸道感染症状的常见ADV血清型;③HBoV:设计位点在 NS1基因处,型别包含human Bocavirus及human Bocavirus 2和3。RSV、PIV、ADV和HBoV引物及探针均经过BLAST(http://www.ncbi.nlm.nih.gov/BLAST)分析以确认其特异性。同一反应管中的多条探针通过标记不同的报告荧光基团以区别各病原。引物探针由上海英骏生物技术有限公司合成,具体序列见表1。
1.4 多重RT-PCR检测
1.4.1 多重RT-PCR检测系统的配液及反应条件 本研究采用的多重RT-PCR检测分别在3个系统中进行,各反应总体积均为25μL,配液及反应条件按照说明书操作。所有反应均在ABI 7500 Real time PCR仪中进行,实验结果用7500 System SDS Software 1.4进行分析。
1.4.2 多重RT-PCR检测的敏感度 针对实验检测中相应病毒靶基因区域设计引物,用该引物对本实验室中经直接免疫荧光法(DFA)(D3 Ultra DFA Respiratory Virus Screening& ID Kit,Diagnostic HYBRIDS,USA)、病毒分离或PCR及测序法检测为病毒阳性的相应标本进行目的片段PCR扩增,产物经纯化后链接入T4载体,转入DH5α感受态细胞中,摇匀后提取质粒,用分光光度法测定产物质粒的浓度。每种质粒取1μL,用 DEPC水作5倍倍比稀释(5-3~5-13),各稀释浓度以 5μL作为反应模板,按照1.4.1所述方法进行多重RT-PCR敏感度检测。
1.4.3 多重RT-PCR检测的特异度 选取用DFA法、病毒分离或PCR加测序法检测常见呼吸道病毒阳性的标本(包括季节性流感病毒H1及H3型、RSV A亚型、B亚型,PIV 1、2、3 型,ADV 1、2、3、7、14 型,HBoV,鼻病毒,人偏肺病毒),及用PCR法检测肠道感染病毒阳性的标本(包括轮状病毒、柯萨奇病毒A组16型、新型肠道病毒71型、诺如病毒),提取RNA(ADV、HBoV 提取 DNA),各取5μL作为模板(先将除ADV和HBoV外的各病毒RNA按照说明书用M-MLV酶进行反转录),分别加入3个多重检测系统中,按照1.4.1所述方法进行反应特异度检测。
1.4.4 标本的多重RT-PCR检测 将入选的标本核酸5μL作为模板,分别加入1.4.1所述反应系统中,进行标本的多重RT-PCR检测。
1.5 统计学方法 以Microsoft Excel 2003处理数据图表。计数资料以百分比表示。采用SAS 9.0软件进行统计分析(t检验或χ2检验等)。(P<0.05)为差异有统计学意义。

表1 RSV、PIV、ADV和HBoV引物及探针序列Tab 1 Primers and probes used for RSV,PIV,ADV and HBoV in the multiplex RT-PCR
2 结果
2.1 多重RT-PCR检测的敏感度及扩增效率 各反应的敏感度及扩增效率结果如表2所示,最低可检测目标基因含量在10~300拷贝数。
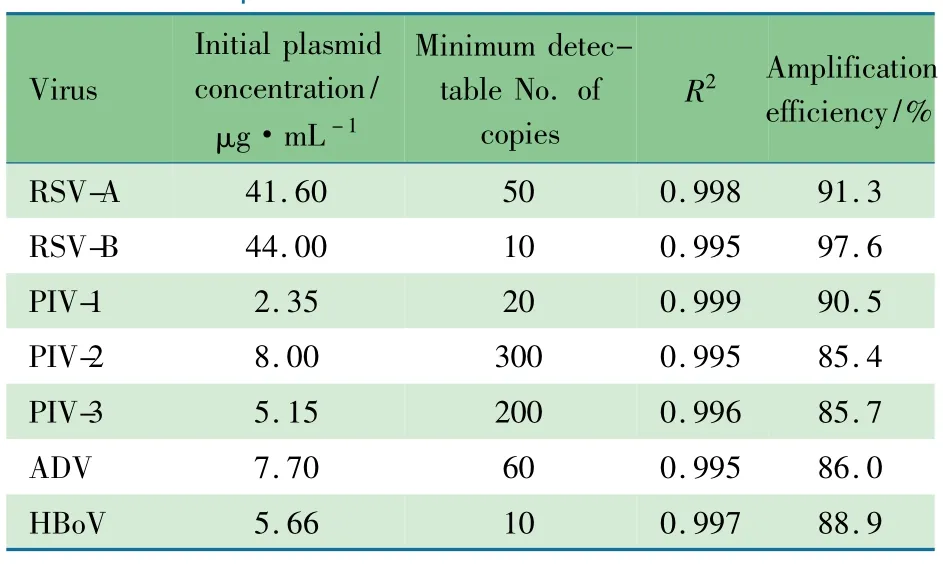
表2 多重RT-PCR的敏感度及扩增效率Tab 2 Sensitivity and amplification efficiency ofthe multiplex RT-PCR
2.2 多重RT-PCR检测的特异度 各反应均未见非特异性扩增曲线,显示本实验除了检测到目标病毒基因外,与其余常见病毒无交叉反应。
2.3 一般情况 依据本研究选取标本的原则选取2009年6月1日至2010年2月28日的标本849份,平均每月94份(其中2010年2月为中国春节,仅有41份)。男性497例,女性352例,男女比例为1.41∶1。北京地区患儿占96%(815例)。5岁及以下患儿650例(76.6%)。
2.4 总体检测情况RSV、PIV、ADV和HBoV检测总阳性率为39.0%(331/849份)。男性患儿检测阳性率为36.0%(179/497),女性患儿检测阳性率为43.2%(152/352),女性检测总体阳性率略高于男性(P=0.04)。5岁以下患儿占87.6%(290/331)。北京地区患儿阳性标本89.1%(295例)。849份标本中,RSV-A亚型阳性12份(1.4%),RSV-B亚型阳性71份(8.4%),PIV-1型阳性70份(8.2%),PIV-2型阳性4份(0.5%),PIV-3型阳性33份(3.9%),ADV阳性 118份(13.9%),HBoV阳性 23份(2.7%)。各月份检测阳性率不等(图1),以2009年11月最低(23.5%),2009年12月最高(64.6%)。

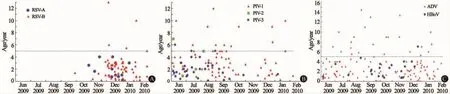
2.5 各病毒检测阳性病例与流行季节趋势 图2A显示,RSV高峰季节为冬季(2009年11月至2010年2月),流行高峰期间阳性检出率为22.3%(81/363例);RSV-B亚型为优势亚型,占85.5%(71/83例)。
图2B显示,PIV流行以PIV-1型和PIV-3型为主,其中PIV-1型的流行高峰主要在夏秋季(2009年7~10月),2009年12月时亦有一小高峰(检出率为8.8%);PIV-3型的流行高峰主要在夏季前后(2009年6~9月),PIV-2型主要为夏季散发。
图2C显示,ADV在观察期间均有较高检出率,平均为13.9%。2009年12月至2010年2月的冬季似有一小流行峰。HBoV的流行高峰在2009年9~12月。

2.6 各病毒检测阳性病例的检出时间及患儿年龄分布图3A显示RSV阳性患儿5岁以下比例为A亚型100%(12/12例),B亚型94.4%(67/71例);图3B显示,PIV阳性患儿5岁以下比例为 1型84.3%(59/70例),2型75.0%(3/4例),3型97.0%(32/33例);图3C显示,ADV阳性患儿5岁以下占82.2%(97/118例),进一步分析显示2009年6~11月ADV阳性患儿的平均年龄为3.6岁,12月至次年2月患儿的平均年龄降至2.7岁,呈显著下降趋势(P=0.037)。HBoV阳性患儿5岁以下比例为95.7%(22/23例),流行主要在秋季至初冬(2009年6~12月)。
31例患儿标本检测结果为2种病毒同时阳性,未检出3种及以上病毒同时阳性;双病毒阳性以RSV-B、PIV-1及ADV与其他病毒混合阳性的情况较为多见;2009年12月双病毒阳性情况检出最多(11例),2009年10月无双病毒阳性情况被检出。
3 讨论
RSV是全球各地引起儿童急性呼吸道感染的重要病原,北京地区2000至2006年的监测情况[3]显示,RSV一般从10月开始检出增多,在冬春季(11月至次年4月)有明显的流行高峰,而5~9月则检出率很低,感染对象95%以上为5岁以下的患儿(特别是1岁以内的婴儿)。本研究检测的RSV流行高峰和易感人群情况与既往报道[3]基本吻合。文献[3]报道的RSV流行高峰期检测阳性率为14.0%~42.3%,流行呈现隔年高峰,A、B亚型交替出现的趋势。本研究结果显示2009至2010年冬季在急性呼吸道感染患儿的咽拭子标本中,RSV的阳性检出率为22.3%,流行的优势亚型为 B亚型,这与文献报道[3]的2004至2005年冬春季的流行情况相近。从流行情况看,2009甲型H1N1流感流行期间RSV的流行与往年相比无明显差异,基本未受到2009甲型H1N1流感病毒流行的影响。
PIV亦是儿科重要的呼吸道病毒,在婴幼儿中感染率很高,PIV-1型主要引起儿童上呼吸道感染[4],而PIV-3型主要引起婴幼儿的下呼吸道感染[5,6],PIV-2型多为散发。北京地区2001至2003年[5]及2003至2006年[7]PIV 监测的资料显示北京地区在急性上呼吸道感染患儿中,PIV的检测阳性率为13.2%,其中以PIV-1型及PIV-3型为主,流行季节性不甚明显,多在每年形成1~2个较明显的高峰,PIV-3的流行高峰多在春夏季,PIV-1的流行高峰多在秋冬季,高峰期内两种型别PIV每年都有不同程度的混合流行。本研究显示PIV的检测阳性率为12.6%,在2009甲型H1N1流感流行期间形成了2个较明显的高峰,第1个高峰位于2009年6~9月的夏季,PIV-1型和PIV-3型的检出率均较高(分别为11.8%和7.7%),第2个小高峰基本位于2009年12月,以PIV-1型为主(检出率为8.8%),PIV-2型仅在夏季有4例散发。通过对比,2009甲型H1N1流感流行期间PIV的流行情况与2003年夏季至2004年春季相近。
邓洁等[8]在2003至2008年连续收集北京地区17 941份急性呼吸道感染患儿的标本,通过病毒分离和(或)间接免疫荧光法进行ADV检测,测得的ADV阳性率平均为1.69%,监测显示ADV的流行无明显季节差异,全年均可检出,偶有散在检出高峰,5岁以下患儿占84.9%,型别以3型及7型为主。本研究测得的ADV流行亦无明显季节规律性,在整个检测区间内均有较高检出率,平均为13.9%,高于邓洁等[8]报道的阳性率,此差异主要与检测方法不同有关(RT-PCR检测的敏感度普遍高于病毒分离及间接免疫荧光法)。本研究显示ADV阳性患儿5岁以下占82.2%,其中2009年6~11月5岁以下患儿占77.0%,12月至次年2月,5岁以下患儿占86.4%,提示ADV在低年龄组患儿中的流行有较明显的增加,此期间是否存在ADV流行型别的改变,及其在婴幼儿中是否存在小规模的暴发流行等有待进一步监测和研究检测印证。
HBoV是Allander等[9](2005)在人呼吸道标本中新检出的一种病毒,被认为主要引起儿童下呼吸道感染[10],Söderlund-Venermo等[11]研究显示,在毛细支气管炎患儿中,急性HBoV感染率 >25%。Lau等[12]研究认为HBoV也可引起上呼吸道感染及肠道感染。赵林清等[13]通过检测发现,北京地区婴幼儿急性呼吸道感染标本中HBoV的阳性检出率为4.1%,其中在急性上呼吸道感染患儿标本中的检出率为3.4%,患儿年龄主要集中在5月龄至5岁。本研究中在急性呼吸道感染患儿咽拭子标本中HBoV的阳性检出率为2.71%,患儿年龄在8月龄至7岁。有报道显示,HBoV的流行季节多为秋季或冬季,因地区范围而略有不同,目前尚无有关北京地区流行季节的资料,但严华杰等[14]通过对上海嘉定地区2006至2008年连续3年的监测研究显示,HBoV的感染高发季节为秋冬季(特别是秋季)。本研究结果显示2009年9~12月HBoV检出率升高,提示北京地区HBoV的高发季节亦可能为秋季至初冬。另外该文献显示HBoV感染患儿男女比例为2∶1(61/29例),本研究结果此比例约为2.28∶1(16/7例),均提示HBoV在男性患儿中的感染率可能更高。本研究未在<5月龄患儿标本中发现HBoV感染,与相关文献报道较为一致,此现象常提示母传抗体保护作用的存在。郑敏巧等[15]通过配对前瞻性研究认为,HBoV IgG抗体可从孕妇经胎盘传给新生儿。但赵林清等[16]通过分析北京地区人群中HBoV血清抗体IgG的情况发现,在<5月龄婴儿中,HBoV血清抗体IgG的阳性率普遍低于其他各年龄组。因此,低月龄婴儿中HBoV感染率低的原因及其免疫保护机制尚需深入研究。
病毒的核酸检测方法快捷方便,是目前病毒检测常用方法之一。本研究采用的RT-PCR方法是20世纪末由美国Applied Biosystems公司推出的一种新型PCR扩增检测技术,其原理是通过在PCR过程中引入荧光探针来实时监测产物扩增情况,不需后期处理便可直接对检测结果进行客观判读。此技术因敏感度高、特异度强、操作便捷、污染少等优点,已被越来越多的应用于病原检测领域。特别是近年多重RT-PCR检测技术的不断成熟[17,18],与单一反应相比更节省了操作时间和试剂原料,因此特别适用于大范围的标本筛查、流行病学监测及珍贵标本的多病原分析。在设计探针时,应尽量选择序列保守性高的片段,探针中过多的引用碱基兼并可能会影响扩增曲线的效率。病毒的核酸检测只是病原检测的一个方面,病毒分离培养和血清学诊断,特别是病毒特异性抗体的检测将有助于病原的进一步确认,上述常用的3种检测方法仅代表实验室检测的结果,应该与患儿的临床症状结合判定,才可进行病毒感染性疾病的确诊。
本研究应用多重RT-PCR的方法,通过对2009年6月至2010年2月,北京地区849例2009甲型H1N1流感病毒检测阴性的急性呼吸道感染患儿的咽拭子标本进行多病原检测,结果显示:2009甲型H1N1流感流行期间,在急性呼吸道感染患儿中,除新型流感病毒外,其他几种儿科常见的呼吸道病毒感染仍占40%以上,RSV-B亚型、PIV-1、PIV-3型和ADV是此期间引起儿童急性呼吸道感染的重要病原。通过分析,RSV、PIV、ADV及 HBoV在2009甲型 H1N1流感流行期间的流行特点与往年相比无明显差异,其流行的季节性基本未受到2009甲型H1N1流感病毒的影响,但各病毒是否存在基因变异则有待进一步分子生物学研究考证。
本研究结论也存在一定局限性:由于实验条件有限,仅选取了儿科4种最常见的呼吸道病毒进行研究,不能显示所有的病原谱;随意选取每周20~25个标本可能会造成结果的偏倚。
[1]Lovato-Salas F,Matienzo-Serment L,Monjarás-Ávila C,et al. Pandemic influenza A( H1N1 ) 2009 and respiratory syncytial virus associated hospitalizations. J Infect,2010,61 ( 5) : 382-390
[2]Sun Y(孙宇),Zhu RN,Deng J,et al.Detection of respiratory syncytial virus in nasopharyngeal aspirates of children by using real-time polymerase chain reaction.Chin J Pediatr(中华儿科杂志),2006,44(6):450-454
[3]Deng J(邓洁),Qian Y,Zhu RN,et al.Surveillance for respiratory syncytial virus subtypes A and B in children with acute respiratory infections in Beijing during 2000 to 2006 seasons.Chin J Pediatr(中华儿科杂志),2006,44(12):924-927
[4]Wang F(王芳),Zhao LQ,Deng J,et al.Parainfluenza virus infections in pediatric patients with acute respiratory infections in Beijingduring 2001-2003.Chin J Epidemiol(中华流行病学杂志),2006,27(1):44-46
[5]Henrickson KJ.Parainfluenza viruses.Clin Microbiol Rev,2003,16(2):242-264
[6]Li L(李莉),Mi R,Xu FS,et al.Clinical analysis of 55 cases of neonates and small infants with parainfluenza virusⅢpneumonia.J Appl Clin Pediatr(实用儿科临床杂志),2008,23(4):287-289
[7]Zhao LQ(赵 林 清),Qian Y,Wang F,et al.Human parainfluenza virus infections in infants and young children with acute respiratory infections in Beijing.Chin J Pediatr(中华儿科杂志),2007,45(2):91-95
[8]Deng J(邓洁),Qian Y,Zhao LQ,et al.Identification and typing of adenovirusesfrom pediatric patientswith acute respiratory infections in Beijing from 2003 to 2008.Chin J Pediatr(中华儿科杂志),2010,48(10):739-743
[9]Allander T,Tammi MT,Eriksson M,et al.Cloning of a human Parvivirus by molecular screening respiratory tract samples.Proc Natl Acad Sci USA.2005,102(36):12891-12896
[10]Zeng M(曾玫),Wang XH,Yu H,et al.Clinical relevance of human bocavirus with acute respiratory tract infection and diarrhea in children:a prospective case-control study.Chin J Pediatr(中华儿科杂志),2010,48(8):580-584
[11]Söderlund-Venermo M,Lahtinen A,Jartti T,et al.Clinical assessmentand improved diagnosis of bocavirus-induced wheezing in children,Finland.Emerg Infect Dis,2009,15(9):1423-1430
[12]Lau SK,Yip CC,Que TL,et al.Clinical and molecular epidemiology of human bocavirus in respiratory and fecal samples from children in Hong Kong.J Infect Dis,2007,196(7):986-993
[13]Zhao LQ(赵林清),Qian Y,Zhu RN,et al.Preliminary studies suggest that a novel parvovirus called human bocavirus(HBoV),is related to acute respiratory infections in pediatric patients in Beijing.Chin J Microbiol Immunol(中华微生物和免疫学杂志),2006,26(5):385-388
[14]Yan HJ(严华杰),Sheng J,Dong W,et al.Boca virus infection in children in Jiading region of Shanghai.J Clin Pediatr(临床儿科杂志),2010,28(6):549-551
[15]Zheng MQ(郑敏巧),Lin F,Zheng MY,et al.Clinical prospective studyon maternal-fetaltransmission ofhuman bocavirus.Chinese J Exp Clin Virol(中华实验和临床病毒学杂志),2007,21(4):331-333
[16]Zhao LQ(赵林清),Qian Y,Zhu RN,et al.Seroprevalence of antibody against human bocavirus in Beijing,China.Chin J Pediatr(中华儿科杂志),2008,46(2):111-114
[17]Dina J,Nguyen E,Gouarin S,et al.Development of duplex real-time PCR for detection of two DNA respiratory viruses.J Virol Methods,2009,162(1-2):119-125
[18]Brittain-Long R,Nord S,Olofsson S,et al.Multiplex real-time PCR for detection of respiratory tract infections.J Clin Virol,2008,41(1):53-56

