2株猪繁殖与呼吸综合征病毒的分离及其基因测序
张 枫
(长江大学生命科学学院,湖北荆州434025; 中国农业科学院哈尔滨兽医研究所兽医生物国家重点实验室/猪传染病研究室,黑龙江哈尔滨50001)
李江南,尹曼曼,郭东伟 刘琴芳,王朝,翁长江
(中国农业科学院哈尔滨兽医研究所兽医生物国家重点实验室/猪传染病研究室,黑龙江哈尔滨150001)
熊 涛
(长江大学生命科学学院,湖北 荆州 434025)
2株猪繁殖与呼吸综合征病毒的分离及其基因测序
张 枫
(长江大学生命科学学院,湖北荆州434025; 中国农业科学院哈尔滨兽医研究所兽医生物国家重点实验室/猪传染病研究室,黑龙江哈尔滨50001)
李江南,尹曼曼,郭东伟 刘琴芳,王朝,翁长江
(中国农业科学院哈尔滨兽医研究所兽医生物国家重点实验室/猪传染病研究室,黑龙江哈尔滨150001)
熊 涛
(长江大学生命科学学院,湖北 荆州 434025)
2006年,我国爆发了高致病性猪繁殖与呼吸综合征(HP-PRRSV),给养猪业造成了严重的经济损失,该HP-PRRSV在Nsp2区有30个氨基酸的不连续缺失。分子流行病学调查证实,目前我国流行的PRRSV毒株主要是HP-PRRSV毒株。2011年,从山东某猪场成功分离到2株PRRSV,分别命名为PRRSV-SDA2和PRRSV-SDA3;基因测序结果显示PRRSV-SDA2全长为15349bp,PRRSV-SDA3全长为15350bp。通过与涵盖欧洲型和北美型的24个毒株全基因比对,发现这2个毒株均属于北美型HP-PRRSV,与HuN4毒株的同源性最高,均高达99.5%,其NSP2蛋白的482和533~561位缺失了30个氨基酸。成功分离的SDA2和SDA3 2个HP-PRRSV及完成的基因测序,为构建HP-PRRSV毒株的感染性克隆奠定了基础。
猪繁殖与呼吸综合征病毒(PRRSV);高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV);分离与鉴定;基因测序;NSP2
猪繁殖与呼吸综合症(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合症病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的传染性疾病,主要特征是怀孕母猪出现繁殖障碍以及各年龄段猪的呼吸道症状[1-2]。PRRSV属于套式病毒目动脉炎病毒科动脉炎病毒属(Arterivirus),同一属的病毒还有猴出血热病毒(SHFV)、马动脉炎病毒(EAV)和小鼠乳酸脱氢酶升高症病毒(LDV)。
1987年美国首次出现PPRS[3],1991年荷兰首先分离到PRRS相关病原,并命名为Lelystad virus(LV)[4-5]。1992年美国分离到PRRS相关病原,命名为VR-2332[6]。分析发现,LV与VR-2332的同源性仅为50%~60%[7]。虽然后来许多国家都分离到PRRSV,但都是这2种PRRSV的变异型,因此病毒学上把LV和VR-2332作为PRRSV的2种原型株,其中LV代表的是欧州型(基因Ⅰ型),VR-2332代表的是北美型(基因Ⅱ型)。郭宝清等[8]1996年从4头流产胎儿中分离到PRRSV,首次证实中国也存在PRRSV。2006年,在我国南方一些省份爆发了一种以体温高、发病率高以及高死亡率的猪“高热综合症”,给我国养猪业造成了巨大的经济损失。后证实引起该病的病原为北美型PRRSV的变异株,称为高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV),该变异毒株在NSP2蛋白的482、533~561位共有30个氨基酸的缺失[10-11]。
目前,中国主要流行的是北美型毒株,偶尔也有分离到欧洲型毒株的报道。近几年国内许多研究人员对PRRSV进行了分子流行病学的跟踪分析和潜在演变分析,如安同庆等[9]对国内67株PRRSV基因序列进行了分析,发现我国PRRSV分为4个亚群,HP-PRRSV是其中的一个亚群,演化分析初步证明HP-PRRSV起源于CH-1a样PRRSV,且变异是渐进的。2011年,山东某猪场出现母猪大规模的流产症状,临床诊断疑似高致病性猪蓝耳病引起的疫情。本研究从采集到的血样中分离到2株病毒,通过间接免疫荧光和病毒的基因序列测定及病毒感染的临床症状、遗传进化分析,判断这2株PRRSV为HP-PRRSV。
1 材料与方法
1.1 实验病料、细胞和引物
实验病料为猪血液,来自山东某猪场。该猪场自2011年8月份来出现了典型“高热症”,发病率高且出现急性死亡,RT-PCR检测呈阳性,分离的2个毒株分别命名为PRRSV-SDA2和PRRSV-SDA3。Marc-145细胞由哈尔滨兽医研究所猪蓝耳病基础研究实验室保存;基因测序所用引物参考NCBI上HuN4基因序列设计(表1)。

表1 SDA2和SDA3基因扩增所用引物
1.2 主要试剂
DMEM培养基和胎牛血清(FBS)购自GIBICO公司;病毒RNA提取试剂盒、DNA凝胶回收试剂盒和质粒小提试剂盒购自QIANGEN公司;反转录试剂盒SuperScriptⅢ First-Strand购自Invitrogen公司;Phusion High-fidelity DNA Polymerase 购自NEW ENGLAND Biolabs公司;Peimix Ex Tag、DL15000和DL2000购自TaKaRa公司;RACE试剂盒购自Clontech公司;pGEM-T Easy载体购自Promega公司;抗PRRSV核衣壳蛋白(N蛋白)由哈尔滨兽医研究所李曦研究员馈赠;FITC标记羊抗鼠荧光二抗购自Sigma公司。
1.3 病毒分离、传代及细胞病变观察
猪血清用0.45μm滤膜除菌,将血清10倍稀释后接种到Marc-145细胞单层,孵育2h,换成2% FBS的DMEM。每天观察细胞,待出现明显细胞病变(CPE)后,反复冻融3次后收集上清,并接种到Marc-145细胞单层进行传代培养,同时拍照记录每代CPE。
1.4 间接免疫荧光(IFA)
将第5代病毒接种Marc-145细胞,感染48h后用4%多聚甲醛固定15min,PBS洗3次,用0.3% Triton X-100处理细胞15min,10%的FBS血清封闭30min,加入抗PRRSV N蛋白单抗(1∶200),室温孵育2h,PBS洗3次,再加入FITC标记的羊抗鼠二抗(1∶200),PBS洗3次,荧光显微镜观察并记录实验结果。
1.5 病毒基因测序
利用QIANGEN公司病毒RNA提取试剂盒提取第5代病毒RNA,然后用SuperScriptⅢ First-Strand试剂盒将RNA反转录成cDNA,以cDNA为模版,用表1中的引物将病毒基因组分9个片段扩增(除病毒5′和3′外),PCR产物送北京华大基因研究中心测序。实验重复3次。
病毒5′和3′UTR用Clontech公司的RACE试剂盒扩增,操作按照试剂盒说明进行。扩增片段回收后,连接pGEM-T Easy载体,然后送北京华大基因研究中心测序。实验重复3次。
1.6 基因序列拼接及遗传进化分析
利用DNAstar 5.0软件对9个片段及病毒两端测序结果进行拼接,并对这2个分离株的基因进行分析。利用MEGA4软件统计分析SDA2和SDA3与其他PRRSV毒株的基因及氨基酸同源性,并用基因序列进行遗传进化分析。实验所用到的参考毒株全部来自于Genbank(表2)。
2 结果与分析
2.1 病毒的分离
临床样品接种Marc-145细胞,72h开始出现CPE,而对照细胞生长良好。收集细胞冻存上清进行传代培养,细胞在接种病毒48h后开始出现CPE,随后细胞变圆,最后从壁上脱落(图1)。

A:SDA2在Marc-145细胞上的病变;B:SDA3在Marc-145细胞上的病变;C:对照图1 SDA2和SDA3感染Marc-145细胞上产生的CPE

A:SDA2的IFA结果;B:SDA3的IFA结果;C:对照图2 SDA2和SDA3在Marc-145细胞上的的间接免疫荧光结果
2.2 间接免疫荧光(IFA)鉴定
利用抗PRRSV N蛋白单克隆抗体作间接免疫荧光染色,结果显示,接种PRRSV-SDA2和PRRSV-SDA3的Marc-145细胞在荧光显微镜下可以看到大量的绿色荧光(图2 A和B),而没有接种病毒的对照Marc-145细胞则没有特异荧光出现(图2 C),表明分离到的PRRSV毒株在Marc-145细胞中复制与增殖,PRRSV的核衣壳蛋白得到表达。
2.3 病毒目的片段扩增和全序列拼接
分别提取SDA2和SDA3的第5代病毒RNA,反转录得到其cDNA,以此为模板,通过表1的引物作PCR,成功扩增到9个片段(图3),将片段回收后送北京华大基因研究中心测序。病毒基因两端采用5′和3′ RACE方法扩增得到特异的条带(图4),连接pGEM-T载体,然后送北京华大基因研究中心测序。根据测序结果,利用DNAStar 5.0软件对SDA2和SDA3的基因序列进行拼接,得到这2个毒株的基因序列,分别为15349bp和15350bp。

M1:DL15000 DNA Marker;1~9:RT-PCR扩增SDA2的PCR产物;10:阴性对照;11~19:RT-PCR扩增SDA3的PCR产物;M2:DL2000 DNA Marker图3 SDA2和SDA3基因不同片段的RT-PCR结果

M:DL2000 DNA marker;1:PCR扩增PRRSV SDA2的5′UTR;2:PCR扩增PRRSV SDA3的5′UTR;3:PCR扩增PRRSV SDA2的3′UTR;4:PCR扩增PRRSV SDA3的3′UTR图4 5′RACE和3′RACE扩增SDA2和SDA3的5′UTR和3′UTR
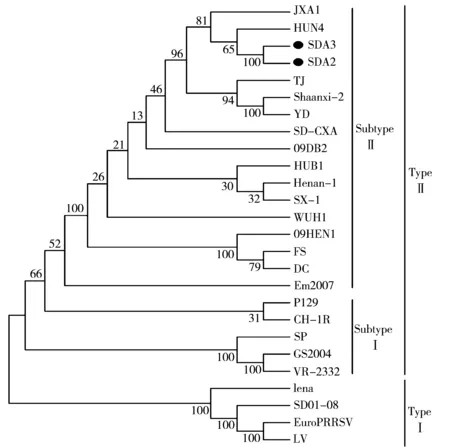
图5 SDA2和SDA3 PRRSV基因的遗传进化树分析
2.4 遗传进化分析
利用MEGA 4软件对2株新的PRRSV毒株进行遗传进化分析,参考毒株(表2)涵盖欧洲型和北美型以及HP-PRRSV。同源性分析显示,SDA2和SDA3的同源性为99.8%,与HuN4的同源性最高,为99.5%,表明这2株PRRSV与HuN4的亲缘关系很近。利用这2个毒株与其他24个参考毒株的基因绘制遗传进化树(图5),结果显示,PRRSV分为基因型Ⅰ(欧洲型)和基因型Ⅱ(北美型),中国分离株均为北美型。北美型又分为2个亚型:以VR-2332为代表的亚群Ⅰ和以HuN4为代表的亚群Ⅱ。分离的2株PRRSV均属于北美型中的亚群Ⅱ,与HuN4和JXA1处于同一小分支。NSP2是PRRSV变异最大的蛋白,分析发现SDA2和SDA3与近几年国内分离的HP-PRRSV一样,在482、533~561位共有30个氨基酸的缺失。结合临床症状及分离毒株的特性,可以判断分离到的2株PRRSV为中国流行的HP-PRRSV。
2.5 序列提交
SDA2和SDA3目前已提交到Genbank上,序列登录号分别为JX878379、JX878380。
3 讨论
PRRSV为不分节段的单股正链RNA病毒,基因全长约为15kb,具有5′帽子结构和3′Poly(A)尾巴,包含9个开放阅读框(ORF),分别是 ORF1a、ORF1b、ORF2a、ORF2b以及ORF3~ORF7,另外在5′和3′两端还分别有1个非编码区(untranslated region,UTR)[12-13]。ORF1a和ORF1b编码2个大的多聚蛋白pp1a和pp1b,然后水解成12种非结构蛋白(NSP),其中的NSP2是PRRSV复制酶编码的最大蛋白,变异程度最高,是欧洲型和北美型PRRSV的主要差异蛋白,常被作为PRRSV遗传变异的标记。2006年中国发生新的猪繁殖与呼吸综合征疫情,该PRRSV毒株的NSP2蛋白中缺失了30个氨基酸[10-11,14-16],因此推测NSP2缺失可能是造成毒力变化的主要原因[14-16]。杨汉春等[15]利用反向遗传系统实验证实NSP2的缺失与PRRSV毒力增强并无关系,因此引起PRRSV毒力的变化的机理还需要进一步研究。2011年笔者在山东分离到的2株SDA2和SDA3也均在NSP2中缺失30个氨基酸,且缺失位置和HuN4等HP-PRRSV一样,位于482和533~561氨基酸,结合临床症状及分离毒株的特性,判断它们为中国流行的HP-PRRSV。
杨汉春等[11]在分析中国PRRSV流行毒株分子遗传特征时发现,我国的PRRSV分离株与北美型毒株VR-2332较接近,病毒氨基酸同源性超过89%,而与欧洲型毒株氨基酸同源性低于60%,因此我国所流行的毒株为北美型毒株。最新的研究表明,HP-PRRSV起源于CH-1a等中国早前分离株,目前欧洲型和北美型毒株在我国都存在,但主要流行的是HP-PRRSV[9,11,16]。
本研究从送检的血清中成功分离到2株PRRSV,并对这2株PRRSV进行了基因测序分析,随后的遗传进化树分析发现分离株处于北美分支,与HuN4的亲缘关系最近,而基因序列与其他毒株同源性比较,发现其与HuN4的同源性最高,为99.5%,因此推断这2株毒株最可能是在HuN4毒株的基础上变异而来。虽然基因变化不大,但仍然有许多位点发生了核苷酸变化,如SDA2在3′UTR少了2个腺嘌呤核苷酸。SDA2和SDA3毒株的基因测序为PRRSV的流行病学提供了新的参考序列,也为构建HP-PRRSV毒株的感染性克隆奠定了基础。
[1]Rossow K D.Porcine reproductive and respiratory syndrome [J].Vet Pathol,1998,35:1-20.
[2]Zimmerman J J,Yoon K J,Wills R W,et al.General overview of PRRSV:a perspective from the United States [J].Microbiol,1997,55:187-196.
[3]Keffaber.Reproductive failture of unknown etiology [J].Am Assoc Swine Pract News,1989,2:1-10.
[4]Terpstra C,Wensvoort G,Pol J M.Experimental reproduction of porcine epidemic abortion and respiratory syndrome (mystery swine disease) by infection with Lelystad virus:Koch’s postulates fulfilled [J].Vet Q,1991,13:131-136.
[5]Wensvoort G,Terpstra C,Pol J M A,et al.Mystery swine disease in the Netherlands:the isolation of Lelystad virus [J].Vet Q,1991,13:121-130.
[6]Collins J E,Benfield D A,Christianson W T,et al.Isolation of swine infertility and respiratory syndrome virus (isolate ATCC VR-2332) in North America and experimental reproduction of the disease in gnotobiotic pigs [J].J Vet Diagn Invest,1992,4:117-126.
[7]Allende R,Lewis T L,Lu Z,et al.North American and European Porcine reproductive and respiratory syndrome virus differ in non-structural protein coding regions [J].Gen Virol,1999,80:307-315.
[8]郭宝清,陈章永,刘文兴,等.从疑似PRRS流产胎儿中分离PRRSV的研究[J].中国畜禽传染病,1996,(2):1-4.
[9]安同庆,田志军,李 冉,等.我国高致病性猪蓝耳病病毒的演化分析[J].中国兽医杂志,2011,47(4):3-6.
[10]Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark [J].PLOS ONE,2007,6:E526.
[11]Zhou L,Yang H C.Porcine reproductive and respiratory syndrome in China [J].Virus Research,2010,154:31-37.
[12]刘光清,云 涛,王根荣 等.猪生殖与呼吸综合征病毒的基因组及致病的分子基础 [J].病毒学报,2007,23(1):79-83.
[13]Huang Y W,Meng X J.Novel strategies and approaches to develop the next generation of vaccines against Porcine reproductive and respiratory syndrome virus[J].Virus Research,2010,154:141-149.
[14]Li Y,Wang X,Bo K,et al.Emergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastren region of China[J].Vet J,2007,174:577-584.
[15]Zhou L,Zhang J,Zeng J,et al.The 30-amino-acid deletion in the NSP2 of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence [J].J Virol,2009,83:5156-5157.
[16]Zhou L,Chen S X,Zhang J L,et al.Molecular variation analysis of porcine reproductive and respiratory syndrome virus in China [J].Virus Res,2009,145:97-105.
2012-09-11
中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室项目(SKLVBP201202)。
张 枫(1987-),男,湖北汉川人,硕士生,主要从事动物基因工程疫苗的研究。
[作者简介]熊 涛,E-mail:xiongtao@hotmail.com;翁长江,E-mail:wengchji@163.com。
10.3969/j.issn.1673-1409(S).2012.11.006
S852.65+1;Q781
A
1673-1409(2012)11-S024-06

