藻胆蛋白表达条件优化的研究
王 娟,王建勇,苏 平,涂俊铭
(湖北师范学院 生命科学学院,湖北 黄石 435002)
藻胆蛋白主要存在于蓝藻、红藻、隐藻和少数一些甲藻中 ,其主要功能是作为光合作用的捕光色素蛋白。已知的藻胆蛋白主要可以分为4大类 ,即藻红蛋白(Phycoerythrin)、藻蓝蛋白(Phycocyanin)、藻红蓝蛋白(Phcoerycyanin)和异藻蓝蛋白(Allophycocyanin)[1]。1928年,Lemberg首次证明藻胆蛋白是由脱辅基蛋白和通过一个或两个硫醚键共价连接藻蓝素(Phycocyanobilins,PCB)——一种开链四吡咯发色团组成的四吡咯结构的色基所组成[2],连接位点通常在α84(α亚基第 84位氨基酸)和β84(β亚基第84位氨基酸)等保守位点上[3]。由于藻胆蛋白与植物光敏素在形态、结构、组成以及光谱特征等方面均十分相似,而且在体外可以诱导藻胆蛋白具有类似于植物光敏素的光化学特征[4]。因此,推测藻胆蛋白与光敏素之间在功能上可能存在着某种关系,它们可能起源于同一祖先蛋白,在长期的进化中两者的功能发生改变,但在一定的条件下,藻胆蛋白可能会行使类似于植物光敏素的功能。
藻胆蛋白是种天然色素蛋白,具有较强荧光活性(发橙红色荧光),本身则呈红色、紫色或蓝色等,故被称为有色多肽。藻胆蛋白的水溶性大,无毒性,色泽鲜艳,荧光明亮,具有抗氧化,增强免疫抑制肿瘤等多种生物活性,因此在食品、化妆品、临床医学诊断、免疫化学和生物工程等领域中具有广阔潜在的应用前景和研究开发价值。藻胆蛋白及其标记物在国际上的售价相当高,研究和开发藻胆蛋白在经济效益方面有很好的前景[5];藻胆蛋白是种最具开发潜力的光敏剂,用于肿瘤的光动力治疗,且在光合作用的原初理论方面具有重要的研究价值;藻胆蛋白的水溶液呈亮泽蓝色,可望作为一种高营养天然色素应用于食品、化妆品领域;利用藻胆蛋白的特殊荧光可作为荧光免疫检测中的活性物质等[6~8]。
由此可见,在科研实验及工艺生产中对增加藻胆蛋白的表达量及提取纯化等是十分有意义的,这能为后续实验研究的正常有序进行奠定条件基础[9]。然而,在藻胆蛋白的研究上,国内外大量报导的主要是集中在藻胆蛋白的提取、结构、功能、基因工程、合成、应用及生物活性研究等方面,却在报道如何优化藻胆蛋白表达条件的相对较少。据薛志欣[10]等报道,在波长565和620nm处测定藻胆蛋白(0~1.2mg/mL内)具有良好的线性关系,相关系数分别为r=0.9995,r=0.9998,该方法测定藻胆蛋白的回收率分别为99.07%和99.11%.与传统的Lowry法相比,该方法测定蛋白简便快速,重现性好,只要充分注意避光,加入PBS,用分光光度法来测定藻胆蛋白的含量是完全可行的。尽管不同方式提取的藻胆蛋白的吸收峰位置略有不同,但几乎都有560nm左右的吸收峰[11,12],所以,本实验选用560nm作为藻红蛋白的定量标准,用单因素实验和正交实验的研究方法,通过极差分析和方差分析来优化藻胆蛋白表达的条件(温度、诱导剂量和诱导时间),从而希望能为实现藻胆蛋白科研乃至工艺生产规模化表达提取及其开发应用奠定一定的理论基础和参考价值。
1 材料与方法
1.1 材料
1.1.1 菌株 含有pACYCDuet-ho1-pcyA、pETDuet-pecE-pecF、pCOLADuet-pecA的E.coliBL21菌种,由本实验室构建并保存。
1.1.2 培养基 LB培养基(1%蛋白胨、0.5%酵母提取物、1%NaCl,pH7.2)
1.1.3 试剂与仪器 蛋白胨、酵母提取物为国产分析纯,IPTG(异丙基硫代-β-D-半乳糖苷),Amp(氨苄青霉素)、Kan(卡那霉素)为国产分析纯,Chl(氯霉素)为市售医用。
UV-2102PC紫外可见光光度计(尤尼科仪器有限公司)、超声波细胞粉碎机JY92-Ⅱ(宁波新芝科仪研究所)、高速台式离心机ROTINA35R(Hettich)、GL-20G-11型变速冷冻离心机(上海安亭科学仪器厂)。
1.2 实验方法
1.2.1 储存液配制 超声缓冲液(100mmol/L NaCl,0.2mol/L磷酸钾缓冲液,pH7.2)
Amp储备液(用无菌二次重蒸水配成100mg/mL氨苄青霉素(ampicillin,简称Amp)溶液,分装,-20℃保存备用)
Kan储备液(用无菌二次重蒸水配成10mg/mL卡那霉素(kanamycin,简称Kan)溶液,分装,-20℃保存备用)
氯霉素(Chl)储备液(用无水乙醇配成34mg/mL氯霉素溶液,分装,-20℃保存)
IPTG储备液(将2g异丙基硫代-β-D-半乳糖苷(isoprophyl thio-β-D-galactoside,简称IPTG),溶于二次重蒸水中,过滤除菌,分装,-20℃保存备用
1.2.2 菌种活化培养和表达 1) 菌种活化 挑取转化单菌落接种于5mL含有目标质粒的抗生素(氯霉素17μg/mL、氨苄霉素25μg/mL、卡那霉素15μg/mL)的LB培养基中37℃振荡培养过夜。
2) 扩大培养 将活化后的菌液接种到50mL的LB培养液的三角瓶中,同时加入相应的抗生素,放恒温摇床37℃培养。
3) 诱导表达 每隔1h测OD600,确保OD600在0.4~0.6之间后,将菌液置于冰水中放置半个小时,加入相应的IPTG量,在相应的温度下进行避光、过夜诱导。
1.2.3 蛋白提取 1) 将诱导后的菌液离心(5000rpm,5min)收集细胞,二次蒸馏水洗两次。
2) 将洗好的细胞倾去上清液后,重悬于一定量的超声缓冲液中,用超声波细胞粉碎仪进行超声破碎细胞(220W,工作2s,间隔3s,超声6min),然后12000r/min离心15min,得上清稀释定容为6mL备用。
1.2.4 蛋白含量测定及计算 取适量藻胆蛋白上清液,测定A568值依照公式:A=ξCL(其中:ξ藻胆蛋白在波长568nm处的摩尔吸光系数ξ568=96000M-1cm-1;[13]C蛋白上清液物质的量浓度;L比色杯内径1cm),求蛋白浓度。
1.3 实验设计
1.3.1 培养条件单因素实验 据陈思礼[14]等报道,诱导藻胆蛋白表达的最适宜的IPTG终浓度为1.0mmol/L,细胞浓度应控制OD600在0.4~0.6间(OD600为0.4和0.6分别处于细胞生长的对数早期和对数晚期,加入IPTG诱导后进入稳定期进行表达,对产物产量没有较明显的影响),摇床速度为100r/min,因此在各单因素试验中的上述条件相同。
试验因素1:诱导温度16℃、20℃、24℃、28℃、37℃,诱导时间12h.
试验因素2:诱导时间6、8、10、12、14、16h,诱导温度28℃(试验因素1中得出)。
1.3.2 正交实验 根据预实验结果,分别以诱导剂量、诱导时间、诱导温度三个因素为影响因素,以藻胆蛋白表达含量为考察指标,进行L9(33)正交试验研究,以确定最佳表达条件参数,试验方案如表1所示。

表1 藻胆蛋白表达的正交试验因素水平表
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 诱导温度对藻胆蛋白表达的影响 由不同温度下诱导表达蛋白含量得到图1,从图1可以看出,诱导温度在16℃和28℃时,藻胆蛋白表达率较高,在其他温度条件下,藻胆蛋白产量下降非常明显。诱导温度在28℃时达到最大,为7.52lmg/100mL.出现上述现象可能是因为,当温度为28℃时有利于该重组细胞的生长、蛋白的表达以及脱辅基蛋白与色素的耦合,而催化两者耦合的酶可能在低温16℃下的活性较高。结果说明,在其他条件相同的条件下,当提高温度,有利于细胞的表达,所以在该套表达重组体系中,28℃时蛋白与色素耦合在大肠杆菌体内表达重组效果明显好于其他温度,28℃为表达重组的最适温度。
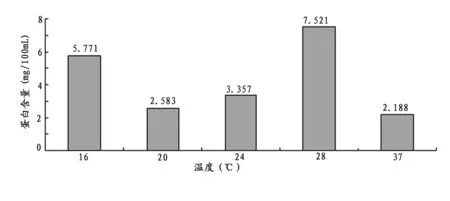
图1 诱导温度对藻胆蛋白表达的影响
2.1.2 诱导时间对藻胆蛋白表达的影响 由不同诱导时间获得蛋白含量得到图2,从图2中看出,在8h~14h诱导时间的区间内,藻胆蛋白的表达量总体上升趋势,在诱导时间8h时细胞表达量就已明显较高,在12~14h区间内的增加幅度最大,14h后则停止了增加或增长效果不明显。从结果可以分析,诱导表达时间太短,蛋白表达不足,脱辅基蛋白和色素不能最大限度的进行自催化重组;表达时间过长,体内产生过多的藻胆蛋白,这些蛋白在体内又可能形成包涵体,从而影响了脱辅基蛋白和色素的自催化重组结合,同时,培养基有效营养成分随着细胞生长的消耗减少也会在一定程度上影响了细胞的增殖生长,因此在本实验室条件的综合考虑下,诱导表达的最适时间为14h.
2.2 最佳表达条件的确定 在单因素实验的基础上选取诱导表达温度、诱导表达时间和诱导剂量进
行正交实验,考察这三个因素对藻胆蛋白提取率的影响。根据表1中三因素三水平的条件,设计L9(33)正交试验表,采用极差分析与方差分析,以确定藻胆蛋白表达的最佳条件,试验结果见表2、表3.
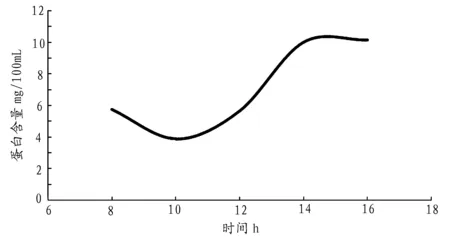
图2 诱导时间对藻胆蛋白表达的影响
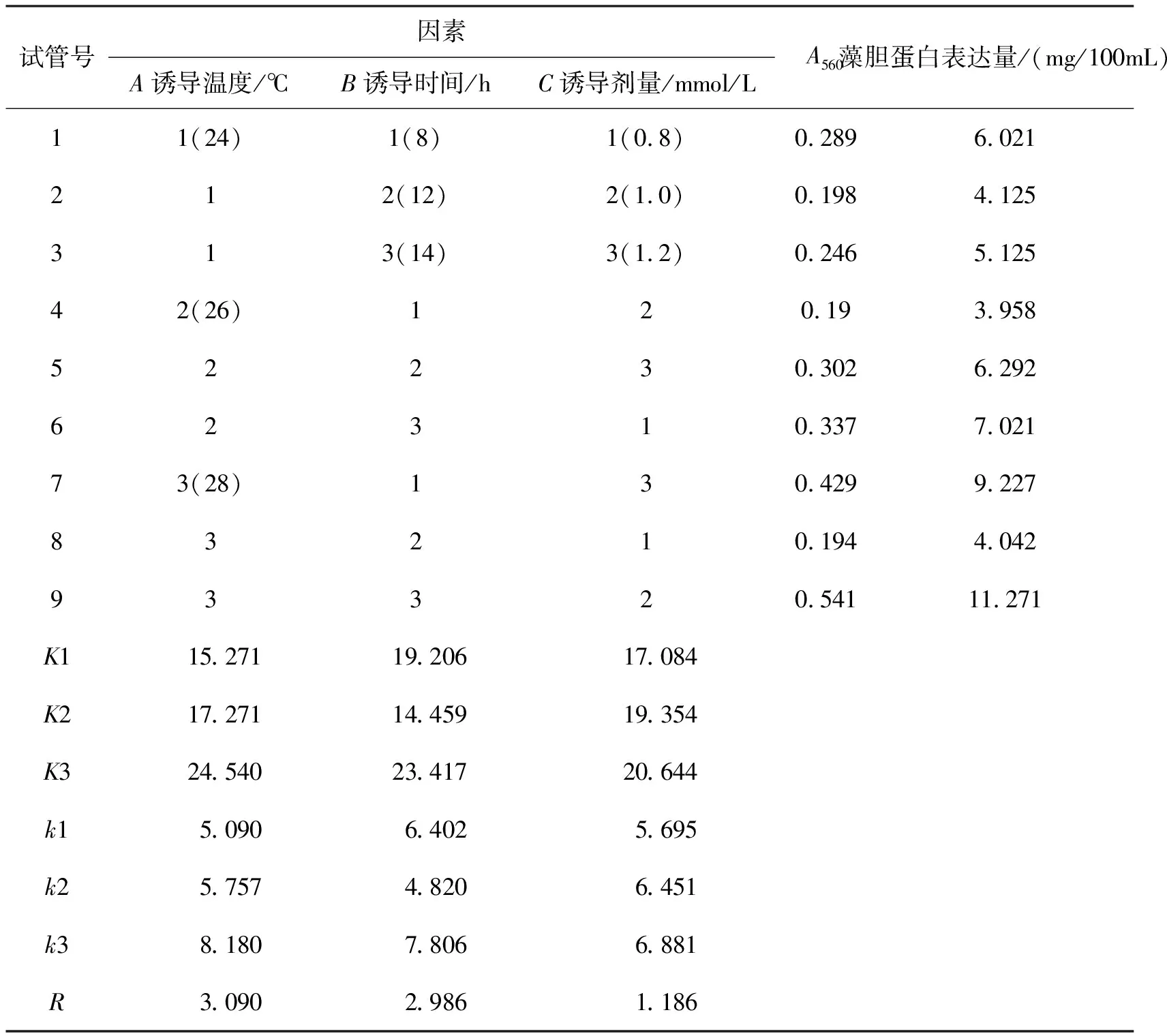
试管号因素A诱导温度/℃B诱导时间/hC诱导剂量/mmol/LA560藻胆蛋白表达量/(mg/100mL)11(24)1(8)1(0.8)0.2896.021212(12)2(1.0)0.1984.125313(14)3(1.2)0.2465.12542(26)120.193.95852230.3026.29262310.3377.02173(28)130.4299.22783210.1944.04293320.54111.271K115.27119.20617.084K2 17.27114.45919.354K324.54023.41720.644k15.0906.4025.695k25.7574.8206.451k38.1807.8066.881R3.0902.9861.186
2.3 正交实验结果分析
从表2中藻胆蛋白表达含量的极差分析(R)可以看出,在三个影响因素中,诱导表达温度和诱导表达时间对其影响较大且两者的影响程度相近,而诱导剂量的影响较小(即A>B>C).结果表明,诱导表达温度和诱导表达时间对藻胆蛋白表达影响较大,其主要原因有:温度是重组细胞的生长、蛋白的表达以及脱辅基蛋白和色素有效结合的重要条件,它的主要作用体现于对重组细胞酶活的影响;诱导表达时间对蛋白的表达、细菌质粒的拷贝数、脱辅基蛋白和色素的有效的结合及培养基有效营养成分组成等有重要影响。从结果还可以看出,随着诱导温度的上升和诱导时间的延长,藻蓝蛋白的表达含量不断增加。因此,选择诱导温度为28℃,诱导时间为14h.本实验所选择的诱导剂量对于藻胆蛋白的表达含量影响最小,这一因素的三个水平中,随着诱导剂量的增加,藻蓝蛋白的表达含量也在不断增加,综合考虑可知,选择第二个水平1mmol/L.综上分析,在实验设计的范围内,最好的实验方案为A3B3C2,即诱导表达温度为28℃,诱导表达时间为14h,诱导剂量为1.0mmol/L.方差分析表明,A、B、C三种因素对结果均无显著性影响。
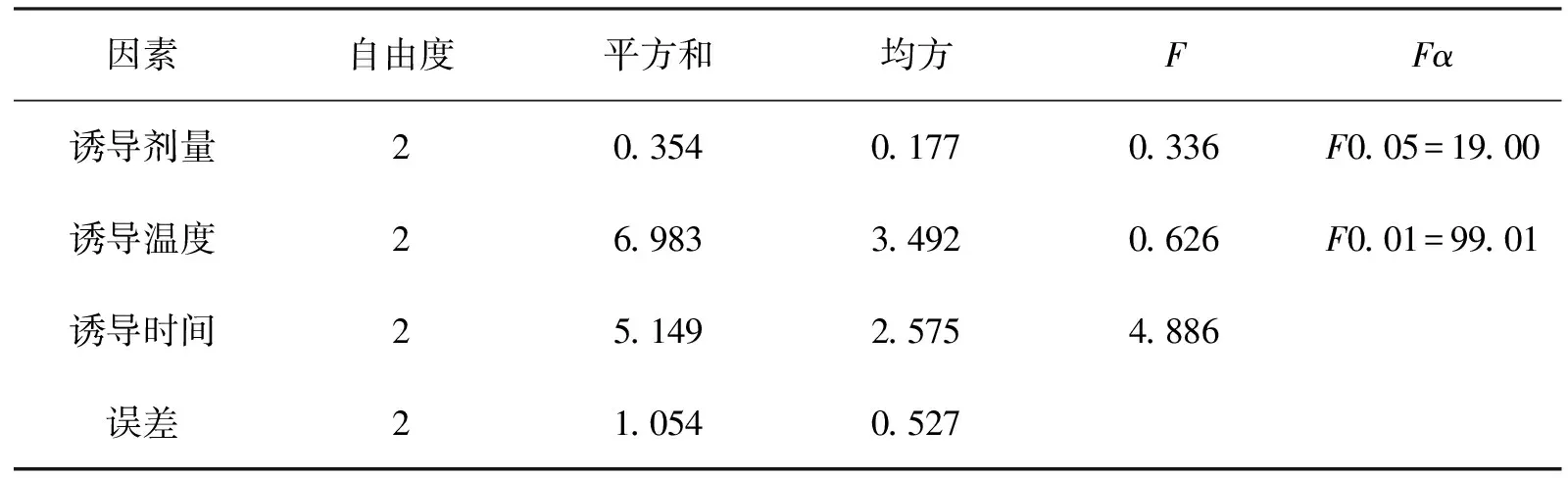
表3 因素方差分析
3 讨论
本次实验对含有三质粒pACYCDuet-ho1-pcyA、pETDuet-pecE-pecF、pCOLADuet-pecA大肠杆菌培养条件进行优化。不可否认的是,菌株的构建是影响蛋白表达量的关键,好的菌种其自身质粒拷贝数达到最优配比,蛋白表达数量和质量也最好。其次是外因条件对蛋白表达的影响。通过对诱导温度、诱导时间、诱导剂量等主要因素研究,采用单因素实验和正交试验,优化了藻胆蛋白表达的条件。结果表明,最优条件为:诱导表达温度为28℃、诱导表达时间为14h、诱导剂量为1.0mmol/L.经分析,优良的菌种在该工艺条件下,可高效表达藻胆蛋白。其中,诱导温度和诱导时间对表达量的影响最高。
参考文献:
[1]Zhao K H, Hong Q, Siebzehnruebl S, et al.Phycoerythrocyanin: A photoreceptor pigment with two faces[J].Frontiers of Photobiol, 1993, 31~36.
[2]Belknap W R, Haselkorn R.Cloning and light regulation of expression of the phycocyanin operon of the cyanobacterium Anabaena[J].EMBO J, 1987, 6(4):871~884.
[3]Ong L J, Glazer A N.R-phycocyanin II, a new phycocyanin occurring in marine Synechococcus species.Identification of the terminal energy acceptor bilin in phycocyanins[J].J Biol Chem, 1987, 262: 6323~6327.
[4]MacColl R, Guard-Friar D.The chromophore assay of phycocyanin 645 from the cryptomonad protozoa chroomonas species[J].J Biol Chem,1983,258:14327~14329.
[5]Ducret A,Sidler W,Frank G.Complete amino acid sequence of R-Phycocyanin I and βsubunits from the red alga Porphyridium cruentum[J].Eur J Biochem,1994, 221:563~580.
[6]萨姆布鲁克 J,弗里奇 E F,曼尼阿蒂斯 T.分子克隆实验指南(第二版)[M].金冬雁,黎孟枫,译.北京:科学出版社,1993.
[7]Zhao K H, Wu D, Zhou M, et al.Amino acid residues associated with enzymatic activities of the isomerizing phycoviolobilin-lyase PecE/F[J], Biochemistry, 2005,Jun 7,44(22):8126~37.
[8]Zhao, K H, Zhu J P, Song B, et al.Nonenzymatic chromophore attachment in biliproteins: Conformational control by the detergent Triton X-100[J].Biochim Biophys Acta,2004, 1657:131~145.
[9]Yeh S W, Glazer A N, Clark J H.Control of bilin transition dipole moment direction by macromolecular assembly:energy transfer in allphycocyanin[J].J Phys Chem,1986,90(19), 4578~4580.
[10]薛志欣.分光光度法测定藻胆蛋白含量的研究[J ].鲁东大学学报 (自然科学版 ),2008, 24 (3) : 250~253.
[11]张学成,程晓杰,施定基.江蓠属藻胆蛋白的研究Ⅱ:龙须菜藻胆蛋白光谱特性和荧光动力学研究[J ].海洋学报, 1999, 21 (1) : 90~96.
[12]Rossano R, Ungar o N, D' Ambrosio A, et al.Extracting and purifying R-phycoerythrin from Mediterranean red algae Corallina elongata Ellis & Solander[J].Journal of Biotechnology, 2003,101(3): 289~293.
[13]Siebzehnrübl S.The reversible photochemistry of phycorythrocyanin[M].Germany:LMU-Publikationen,1990.
[14]陈思礼,苏 平.细菌光敏色素PCB-AphA(26-320)体内重组与条件优化[J ].华中师范大学学报(自然科学版),2008, 42(4) : 606~611.

