茉莉酸甲酯对鲜切甘薯伤害防御反应的研究
郑亚男,胡文忠,姜爱丽,毕 阳
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070; 2.大连民族学院生命科学学院,辽宁大连116600)
茉莉酸甲酯对鲜切甘薯伤害防御反应的研究
郑亚男1,胡文忠2,*,姜爱丽2,毕 阳1
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070; 2.大连民族学院生命科学学院,辽宁大连116600)
为了研究不同浓度茉莉酸甲酯(MeJA)处理对鲜切甘薯伤害防御反应的影响,将甘薯切割成1cm×1cm×1cm的块状,在低浓度(15μmol/L)MeJA和高浓度(150μmol/L)MeJA下贮藏,每隔1d测定自由基清除系统工具酶(POD、CAT、APX、SOD)的活性、膜质过氧化程度、H2O2含量和多酚氧化酶(PPO)活性。实验结果表明,高浓度MeJA处理的鲜切甘薯可以显著提高CAT、APX、POD和PPO酶活性,抑制H2O2含量增加;SOD活性没有显著变化。高浓度MeJA处理可有效诱导防御反应发生,同时,通过提高自由基清除系统工具酶活性,使膜脂过氧化程度减轻;低浓度MeJA处理效果不显著。综合分析认为,150μmol/L MeJA是诱导鲜切甘薯防御反应产生的适宜处理浓度,作为一种新型诱变剂可以应用于鲜切果蔬的生产实践。
鲜切,甘薯,茉莉酸甲酯,膜质过氧化
茉莉酸类物质(Jasmonates,JAS)在自然界中广泛存在,其主要代表物质是茉莉酸(Jasmonic acid,JA)和茉莉酸甲酯(Methyle Jasmonate,MeJA),其被认为是植物伤信号分子的JA在植物防御反应中的作用得到了人们的广泛关注[1-2]。JA是与抗性密切相关的植物生长物质,它作为内源信号分子参与植物在机械伤害、病虫害等条件下的抗逆反应,并且与植物远距离非伤害部位的防御反应有关,是介导伤害反应必需和最关键的信号分子[4]。在番茄[5]、马铃薯[6]和烟草[7]等作物上的研究表明,内外源JA/MeJA均对植物伤害防卫基因的表达具有调节和促进作用。目前,人们对MeJA提高植物抗逆性的机理了解尚不足,还未见有关MeJA对鲜切甘薯防御反应影响的报道。甘薯[Ipomoea batatas(L)Lam],别名红薯、红茗、白薯、地瓜、山芋等,为旋花科,甘薯属多年生蔓生草本植物,原产于美洲热带地区。研究表明,甘薯的营养价值很高,甘薯中除了富含淀粉和可溶性糖外,还含有蛋白质、脂肪酸、多种维生素、氨基酸以及钙、磷、铁等无机盐,而且它所含的维生素和氨基酸种类及含量大多高于大米、白面,特别是维生素A、维生素B、维生素C和纤维素。近年来,随着鲜切果蔬加工的兴起和深加工的快速发展,果蔬鲜切加工所造成的伤害刺激信号转导及其调控的研究已引起采后果蔬生物学界的广泛关注。因此,本实验以甘薯为试材,研究了不同浓度MeJA处理后鲜切甘薯的防御性反应以及活性氧代谢和膜脂过氧化的变化,以期为MeJA作为防御激活因子在果蔬鲜切中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
甘薯 挑选无病虫害、机械伤,大小和成熟度基本一致的甘薯(Lpomoea batatasLam)为实验材料; MeJA 分析纯,Sigma公司;盐酸、浓硫酸、盐酸、浓氨水、丙酮、四氯化钛、磷酸氢二钠、磷酸二氢钠、乙醇、抗坏血酸、乙二胺四乙酸二钠、过氧化氢、邻苯二酚、愈创木酚、三氯乙酸、2-硫代巴比妥酸、二硫苏糖醇、聚乙烯吡咯烷酮等 均为分析纯。
Lambda-25型紫外可见分光光度计 美国PE; T-25型匀浆机 德国IKA公司;UV-2100型紫外可见分光光度计 尤尼柯上海仪器有限公司;电子天平梅特勒-托利多仪器 上海有限公司;BR4i型台式高速冷冻离心机 法国Jouan;DK-S26型电热恒温水浴锅 上海精宏实验设备有限公司;Sim-F140型制冰机 日本三洋。
1.2 实验方法
1.2.1 原材料预处理 实验前,用蒸馏水将甘薯洗净,并用滤纸擦干。然后用不锈钢刀去皮并切成1cm×1cm×1cm的方块。将切好的甘薯随机分组以便进行下一步的处理。
采用浸泡的方法,将MeJA用少量95%的乙醇溶解,加水稀释至所需浓度。实验设两个处理浓度,分别为15μmol/L和150μmol/L,处理后立即计时,与空白对照同期取样。浸泡之后,分别放入保鲜盒用保鲜膜封装,每盒约50g,放置于4℃条件下贮藏,每隔1d测定各项指标,其中第0d在切后1h取样测定。
1.2.2 POD活性的测定 参照Putter的方法[8]稍作修改:取1g样品,加入含有0.1g聚乙烯吡咯烷酮(PVPP)的20mL 0.2mol/L的磷酸盐缓冲液(pH= 6.4),冰浴匀浆,4℃下10000×g离心30min,取上清液为酶的粗提液,将0.5mL粗提液加入到2mL 0.05% (v/v)愈创木酚(用0.2mol/L pH=6.4的磷酸盐缓冲液配成)中,在30℃水浴中平衡5min,然后加入1mL 0.08%(v/v)H2O2(用0.2mol/L pH=6.4的磷酸盐缓冲液配成)混匀,1min后扫描2min内460nm处吸光值变化,酶活性以ΔOD460(min·g-1FW)表示。
1.2.3 过氧化氢酶(CAT)活性的测定 参照Nandwal等的方法[9]并修改,取1g样品,加入20mL预冷的 0.1mol/L pH=7.8的磷酸缓冲液(内含5mmol/L二硫苏糖醇和0.1g PVPP),冰浴匀浆,4℃下10000×g离心30min,收集上清液用于测定。CAT反应体系包括粗酶液0.2mL和3mL 20mmol/L H2O2(用50mmol/L pH=7.8的磷酸缓冲液配置),以蒸馏水作参比。在240nm下扫描吸光度变化,酶活性表示为ΔOD240(min·g-1FW)。
1.2.4 超氧化物歧化酶(SOD)活性的测定 采用NBT方法[10],以50%抑制的酶液量(μL)为1个酶活单位。
1.2.5 抗坏血酸过氧化物酶(APX)活性测定 参照沈文彪等的方法[11]并稍加修改,取1g样品,加入20mL预冷的0.1mol/L pH=7.8的磷酸缓冲液,冰浴匀浆,4℃下10000×g离心30min,收集上清液用于测定。反应体系包括:反应液(50mmol/L的磷酸缓冲液,pH=7.8;0.1mmol/L EDTA-Na2,0.5mmol/L ASA)2.6mL,0.1mL酶液,最后加入 2mmol/L H2O20.3mL而启动反应,测定30~60s内吸光值的变化,计算单位时间内吸光值减少量,结果以ΔOD290(min·g-1FW)表示。
1.2.6 MDA含量的测定 测定参照Heath&Pacontroler的方法[12]:MDA采用与POD相同的提取液,将1.5mL粗酶提取液加入2.5mL0.5%的硫代巴比妥酸(TBA,用15%的三氯乙酸配成)溶液中,混匀后在沸水域中煮沸18min,迅速用自来水冷并在10000 ×g离心机中离心10min。取上清液在532nm和600nm波长下分别测定光密度值,并按下式计算MDA含量:
MDA含量(nmol·g-1FW)=(OD532-OD600)× A×(V/a)/1.55×10-1×W
式中:A:反应液总量(4mL);V:提取液总量; a:测定提取液量(1.5mL);W:材料重(g);1.55×10-1为MDA的微摩尔消光系数。
1.2.7 H2O2含量的测定 参照 Patterson的方法[13]并稍加修改,准确称取1g样品,加入10mL预冷的丙酮研磨匀浆,10000×g离心20min弃沉淀,取1mL上清液加入0.1mL 20%TiCl4(v/v)的浓HCl,0.2mL浓氨水,形成过氧化物-Ti复合物后离(10000×g,15min),沉淀部分用冷丙酮洗涤4次以减少色素的干扰,最后将沉淀溶于3mL 2mol/L H2SO4溶液中,测定OD410值,按同样程序制备H2O2标准曲线。结果以μmolH2O2/g FW表示。
1.2.8 PPO活性的测定 参照Galeazzi等的方法[14]并加以改进:PPO采用与POD相同的提取液,将0.5mL粗酶提取液加入3mL 0.5mol/L的邻苯二酚溶液(用0.2mol/L pH=6.4的磷酸盐缓冲液配成)中。反应温度为25℃,加酶液后5s开始扫描30s内398nm处吸光度值变化,酶活性以ΔOD398(min·g-1FW)表示。
2 结果与分析
2.1 自由基清除系统工具酶的活性的影响
2.1.1 POD活性的影响 过氧化物酶(POD)是植物在逆境条件下酶促防御系统的关键酶,它也是细胞内清除活性氧的保护酶,其可避免活性氧在植物体内的产生和积累,使体内自由基维持在一个正常的动态水平。在贮藏过程中,POD活性呈先上升后下降趋势(图1)。切割伤害破坏了果蔬膜系统的完整性,加快细胞壁裂解,促进活性氧O2-·和H2O2的形成,伤害造成的氧化胁迫可诱导 POD活性的增加[15],而H2O2作为POD的主要底物,低浓度H2O2可提高POD的活性,高浓度则反过来抑制POD活性[16]。POD活性的下降可能是由于随着贮藏时间的延长,H2O2浓度积累从而抑制了其活性。对照样和15μmol/L MeJA处理在第0~6d呈上升趋势且在第6d达到最大值,之后缓慢下降,后者POD活性低于对照样;从图1中可以看出,各浓度处理存在差异,150μmol/L MeJA处理的POD活性快速上升且在第4d达到最大值,随后缓慢下降,均高于对照。说明150μmol/L MeJA处理使POD活性高峰值的出现提前,加快了POD活性的升高。
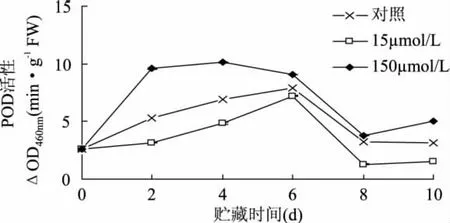
图1 MeJA处理对鲜切甘薯POD活性的影响Fig.1 Effects of methyl jasmonate treatments on POD activity of fresh-cut sweet potaoes
2.1.2 CAT活性的影响 过氧化氢酶(CAT)属于血红蛋白酶,含有铁,它能催化植物体内积累的过氧化氢(H2O2)分解为水和分子氧气,从而减少H2O2对果蔬组织可能造成的氧化伤害。CAT活性与植物的抗逆性、耐贮性密切相关[17]。总体上CAT活性呈波浪式;对照样在第2d达到最大值,随后缓慢下降; 150μmol/L MeJA处理的CAT活性在第8d达到最大值,总体高于对照水平;15μmol/L MeJA处理的CAT活性急剧上升,第2d达到最大活性值后又迅速下降,随后低于对照水平,分别是对照样和150μmol/L MeJA处理最大值的2.72倍和1.99倍。CAT是鲜切甘薯清除因伤胁迫产生活性氧的主要酶,对活性氧有很强的调节作用,150μmol/L MeJA处理的CAT活性较稳定,在贮藏后期可维持较高的活性。
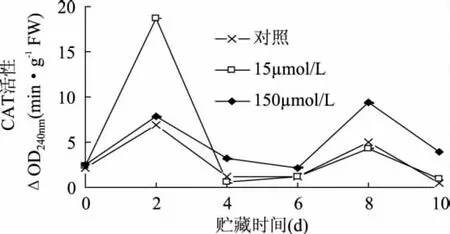
图2 MeJA处理对鲜切甘薯CAT活性的影响Fig.2 Effects of methyl jasmonate treatments on CAT activity of fresh-cut sweet potaoes
2.1.3 SOD活性的影响 超氧化物岐化酶(SOD)普遍存在于动植物与微生物体内。SOD是含金属辅基的酶。植物有三种类型的SOD:Mn-SOD,Cu/Zn-SOD和 Fe-SOD[18]。SOD能够清除超氧自由基(O2-·),它与CAT、POD等酶协同作用来防御活性氧或其它过氧化物自由基对细胞膜系统的伤害,从而减少自由基对有机体的毒害。SOD能通过歧化反应清除生物细胞中的超氧阴离子自由基,生成H2O2和O2-·。H2O2再由CAT进一步催化生成H2O和O2-·。由图3可知,SOD的活性总体上呈先上升后下降趋势,在第2d达到最大值,随即迅速下降;在第2~6d,MeJA处理均高于对照,但在整个贮藏期间,对照样与MeJA处理后的变化趋势相似,无明显差异。总体来看,SOD活性变化不大,说明SOD对鲜切甘薯伤害的反应不是很敏感。各处理之间抗氧化酶SOD活性差异不大(图3),暗示MeJA对超氧阴离子的代谢影响不大,可能其并不主要依靠调节超氧阴离子的代谢来提高抗性。

图3 MeJA处理对鲜切甘薯SOD活性的影响Fig.3 Effects of methyl jasmonate treatments on SOD activity of fresh-cut sweet potaoes
2.1.4 APX活性的影响 抗坏血酸过氧化物酶(APX)是植物体内清除H2O2的关键酶,APX活性的升高有利于植物体内H2O2的清除[19]。由图4可知,APX活性总体呈现逐渐下降的趋势。APX活性出现峰值时间早于SOD、CAT和POD,说明果实受到机械损伤后,APX因对受伤组织起到快速保护作用而迅速下降,所以在贮藏过程中清除H2O2的能力较弱。但150μmol/L MeJA处理的APX活性在整个贮藏时间显著高于对照,说明在整个贮藏期间,相较于15μmol/L MeJA处理,其还是维持较高活性。
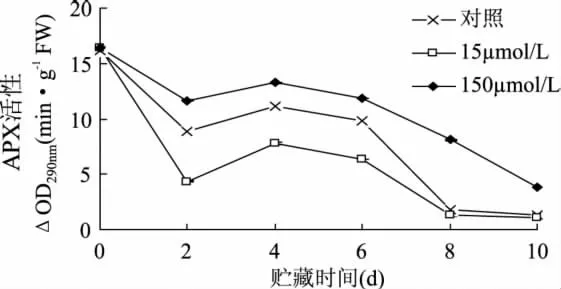
图4 MeJA处理对鲜切甘薯APX活性的影响Fig.4 Effects of methyl jasmonate treatments on APX activity of fresh-cut sweet potaoes
2.2 MDA含量的影响
果蔬组织中活性氧产生和清除之间的不平衡,导致了活性氧的积累,从而促进膜脂过氧化作用,丙二醛(MDA)是膜脂过氧化作用的主要产物之一,通常以它的含量作为膜质过氧化的指标,反映细胞膜过氧化的程度。从图5中可以看出,对照样和MeJA处理后均有一个上升过程,随后下降,在第2d达到最大值,15μmol/L MeJA处理较对照减少了23.60%,150μmol/L MeJA处理较对照增加了9.31%。在第6~10d,150μmol/L MeJA处理后MDA的含量均低于对照样和15μmol/L MeJA处理。说明细胞膜保护系统不断清除活性氧等自由基,使细胞内的氧化还原系统维持在一个平衡状态,对细胞起到保护作用。各处理组的MDA含量分别在不同时期内低于对照样,因此MeJA处理使鲜切甘薯的膜质过氧化程度降低,对于保持细胞膜完整性有重要的作用。

图5 MeJA处理对鲜切甘薯MDA含量的影响Fig.5 Effects of methyl jasmonate treatments on MDA content of fresh-cut sweet potaoes
2.3 H2O2含量的影响
MeJA处理的鲜切甘薯H2O2含量的变化如图6所示。随着贮藏时间的延长,无论是对照样还是MeJA处理,H2O2含量在处理早期均缓慢增加,对照样和MeJA处理在第6d均达到最大值,之后缓慢下降;在贮藏末期,15μmol/L MeJA处理的H2O2含量增加。150μmol/L MeJA处理的H2O2含量在早期比对照样高,在后期则比对照低。在整个贮藏期间,H2O2含量与MDA总体含量的变化趋势相似,说明鲜切甘薯中MDA的积累与H2O2的积累之间有密切关系。
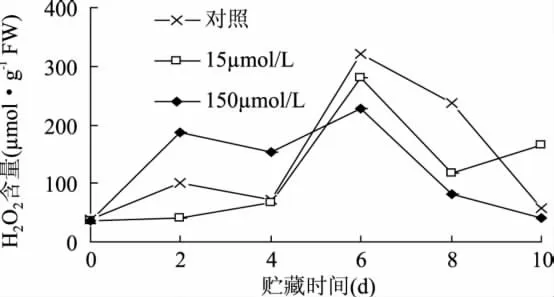
图6 MeJA处理对鲜切甘薯H2O2含量的影响Fig.6 Effects of methyl jasmonate treatments on H2O2content of fresh-cut sweet potaoes
2.4 PPO活性的影响
多酚氧化酶(PPO)是植物中广泛存在的催化酚类物质氧化的酶类,它可以催化酚类物质氧化成醌,一方面作为抗营养因子抵御昆虫咬食,另一方面醌还对细菌有抑制作用[20]。因此,PPO活性的高低是植物抵御机械伤害的重要指标。对照样和MeJA处理后PPO活性变化如图7所示。PPO活性在整个处理过程中有2个高峰,第1个高峰出现在处理后第2d,PPO活性有小幅增加,处理后第6d,PPO活性迅速升高并达到第2个高峰,第2个峰值远高于第1个峰值;150μmol/L MeJA处理的PPO活性高于对照样。说明150μmol/L MeJA可以显著提高PPO活性(图7),同时还发现MeJA的诱导效果与处理浓度有关,15μmol/L MeJA处理后,PPO活性虽有所提高,但高活性维持的时间很短。高浓度MeJA处理可有效提高抗性。
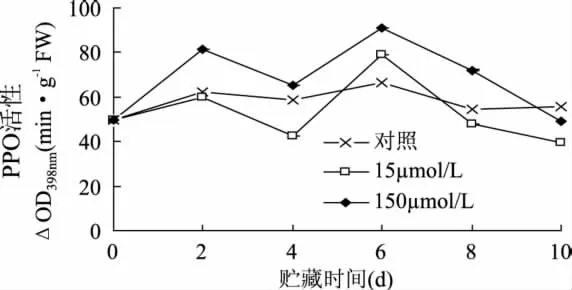
图7 MeJA处理对鲜切甘薯PPO活性的影响Fig.7 Effects of methyl jasmonate treatments on PPO activity of fresh-cut sweet potaoes
3 讨论
综上所述,外施MeJA能激发鲜切甘薯活性氧迸发,同时,又通过诱导自由基清除系统工具酶活性的提高,降低膜脂过氧化水平,进一步诱导防御反应发生。高浓度(150μmol/L)MeJA处理可以有效诱导自由基清除系统工具酶活性,减少 H2O2积累,降低MDA含量,提高PPO活性,在鲜切甘薯货架期中有一定的应用价值。综合分析不同浓度MeJA对鲜切甘薯影响的各项指标认为,150μmol/L MeJA是诱导鲜切甘薯防御反应发生的适宜浓度。
[1]Cheng YH,Chang HS,Gupta R,et al.Transcriptional profiling reveals novel interactions between wounding,pathogen,abiotic stress,and hormonal responses in Arabidopsis[J].Plant Physiol,2002,129:661.
[2]León J,Rojo E,Sanchez-Serrano JJ.Wound signaling in plants[J].J Exp Bot,2001,354:1-9.
[3]Szczegielniak J,Klimecka M,Liwosz A,et al.Woundresponsive and phospholipid-regulated maize calcium-dependent protein kinase[J].Plant Physiol,2005,139:1970-1983.
[4]Cheong JJ,Yang DD.Methyl jasmonate as vital substance in plants[J].Trends in Genetics,2003,19(7):409-413.
[5]Orozco-Cardenas M L,Narvaez-Vasquez J,Ryan C A.Hydrogen peroxide acts as a second messenger for the induction of defense genes in tomato plants in response to wounding,systemin and methyl jasmonate[J].Plant Cell,2001,13: 179-191.
[6]Cohen Y,Gisi U,Niderman T.Local and systemic protection agains Phytophthora in festans induced in potato and tomato plants by jasmonic acid and jasmonic methylester[J].Phytopanthology, 1993,83:1054-1062.
[7]宾金华,姜胜,黄胜琴,等.茉莉酸甲酯诱导烟草抗炭疽病与苯丙氨酸解氨酶活性及细胞壁物质的关系[J].植物生理学报,2000,26(1):1-6.
[8]Putter J.Methods of Enzymatic Analysis[M].New York: Academy Press,1974:685-689.
[9]Nandwal A S,Maan A,Kundu B S,et al.Ethylene evolution and antioxidant defence mechanism in Cicer arietinum roots in the presence ofnitrateand aminoethoxyvinylglycine[J].Plant Physiology and Biochemistry,2000,38(9):709-715.
[10]Constantine N G,Stanley K R.Superoxide dismutases[J]. Plant Physio,1977,59:309-314.
[11]沈文彪,徐朗莱,叶茂炳,等.抗坏血酸过氧化物酶活性测定的探讨[J].植物生理学通讯,1996,32(3):203-205.
[12]Heath R L,PackerL.Photoperoxidation in isolated chloroplasts I Kinetics and stoichiometry of fatty acid peroxidation[J].Archives of Biochemistry and Biophysics,1968,125(1): 189-198.
[13]Parterson B D,Mackae E A,Fegruson I B.Estimation of hydorgen peroxide in Plant extracts using titanium(IV)[J].Anyl Bioehem,1984,139:487-492.
[14]Galeazzi M A,Sgarbieri V C,Constantinides S M.Isolation,purification and physicochemical characterization of polyphenoloxidases(PPO)from a dwarf variety of banana(Musa cavendishii L.)[J].Journal of Food Science,1981,46:150-155.
[15]Oms-Oliu G,Odriozola-Serrano I,Soliva-Fortuny R,et al. The role of peroxidase on the antioxidant potential of fresh-cut“PieldeSapo”melon packaged underdifferentmodified atmospheres[J].Food Chemistry,2008,106(3):1085-1092.
[16]Burnette F S.Peroxidase and its relationship to food flavor and quality:a review[J].J Food Sci,1977,42:1-5.
[17]Chance B,Oshino N.Kinetics and mechanisms of catalase in peroxisomes ofthe mitochondrialfraction[J].Biochemical Journal,1971,122(2):225-233..
[18]马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传,2003,25(2):225-231.
[19]孙学成,谭启玲,胡承孝,等.低温胁迫下钼对冬小麦抗氧化酶活性的影响[J].中国农业科学,2006,39(5):952-959.
[20]Constable C P,Ryan C A.A survey of wound and methyl jasmonate induced leaf polyphnol oxidase in crop plants[J]. Phytochemistry,1998,47(4):507-511.
[21]Wang Y,Meny Y L,Ishidawa H,et al.Photosynthetic adaptation to salt stress in three-color leaves of a C4plant (Amararthus tricolor)[J].Plant Cell Physiology,1999,40:668-6745.
[22]Nakano Y,Asada K.Purification of ascorbate perosidase in spinach chloroplasts,its inactivation in ascorbate depleted medium and reactivation by monodehydroascorbate radical[J].Plant Cell Physiology,1987,28(1):131-140.
Research of methyl jasmonate on the wounding defense response for fresh-cut sweet potatoes
ZHENG Ya-nan1,HU Wen-zhong2,*,JIANG Ai-li2,BI Yang1
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China; 2.College of Life Science,Dalian Nationalities University,Dalian 116600,China)
In order to study the effect of the different concentrations of methyl jasmonate(MeJA)treatment on the wounding defense reaction of fresh-cut sweet potatoes,the sweet potatoes were cut to cubes of 1 cm×1cm× 1cm,at low concentrations(15μmol/L)MeJA and high concentrations(150μmol/L)MeJA concentration of storage,measured free radical scavenging systems tool enzyme such as peroxidase(POD),catalse(CAT),supiroxide dismutase(SOD),ascrobate peroxidase(APX),membrane lipid peroxidation,H2O2and polyphenol oxidase (PPO)at every other day.The results showed that high concentrations of MeJA processing fresh-cut sweet potatoes could significantly improve CAT,APX,POD and PPO activities and restrain H2O2increasing rapid;but it could not affect significantly superoxide dismutase activity(SOD).High concentration of MeJA could effectively induce plant defense response,and thus decrease the level of cell membrane lipid peroxidation.High concentration of MeJA could not affect significantly.It was concluded that MeJA,under the suitable concentration,could induce the wounding defense response for sweet potatoes,as a new mutagen could be applied to fresh-cut food and vegetable production practice.
fresh-cut;sweet potatoes;methyl jasmonate;membrane lipid proxidation
TS210.1
A
1002-0306(2012)02-0368-05
2011-10-12 *通讯联系人
郑亚男(1986-),女,硕士研究生,研究方向:采后生物学。
国家自然科学基金项目(30972038,31172009)。

