荧光共振能量转移(FRET)的定量检测及其应用
张建伟, 陈同生
(华南师范大学生物光子学研究院生命科学教育部重点实验室,广东广州 510631)
荧光共振能量转移(FRET)的定量检测及其应用
张建伟, 陈同生*
(华南师范大学生物光子学研究院生命科学教育部重点实验室,广东广州 510631)
荧光共振能量转移(Fluorescence Resonance Energy Transfer, FRET)技术被广泛应用于活细胞中生物大分子构象变化和分子间动态相互作用的实时研究. 针对光谱串扰和供体受体间的浓度比等困扰FRET效率定量检测的两大难题,已经发展了多种定量检测FRET效率的方法. 作者结合自己的研究结果介绍了多种FRET效率定量检测技术在细胞信号转导机制研究中的应用.
荧光共振能量转移(FRET); FRET效率; 定量检测; 荧光蛋白
1 FRET原理及影响因素
荧光共振能量转移(Fluorescence Resonance Energy Transfer, FRET)是依赖于供体和受体分子间距离的光物理进程,处于激发态的荧光团通过偶极子间的相互作用将能量以非辐射的方式转移给邻近的受体分子[1-2], 从而导致供体荧光淬灭和受体荧光发射的增加. 供体和受体之间的FRET效率(E)与分子间的空间距离(r)满足6次方的关系[3]:
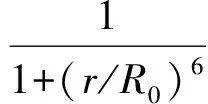
(1)
其中R0为Förster半径,是指E为50%时供体与受体间的距离.E与供体受体分子间空间的6次方关系决定了E对空间距离敏感, 决定了FRET技术特别适合用于研究分子间的相互作用以及大分子间的空间变化.
FRET效率是依赖于供体与受体间的距离r和Forster距离R0的.R0由下式给出[3-4]:
(2)
其中,QD为供体的量子产率,n为介质的折射率,κ2是2个荧光蛋白之间的偶极取向因子,NA是阿伏伽德罗常数,εA是受体最大的消光系数,J()为归一化的供体发射光谱FD与受体吸收光谱EA的光谱重合系数[5]
J()=FD()EA()4d,
(3)
其中表明影响FRET效率的因素主要有: (1)供体分子发射谱与受体分子吸收光谱需有相当部分的重合, 一般重合大于30%时的FRET效应才能被检测到; (2) 供体分子与受体分子的偶极矩空间取向不能相互垂直, 如果2个分子间的偶极取向互相垂直, 则κ2为0, 就不会有FRET作用. 虽然κ2可以从0到4之间变化, 但是在具体的计算中, 一般取κ2在各个可能方向值的平均值2/3[6]; (3) 供体与受体分子的空间距离不能超过10 nm, 否则很难检测到FRET信号. 影响FRET的其它因素还有供体的量子产率和受体的消光系数. 为了测量大范围的FRET信号,R0越大越好, 也就是必须选择有高量子产率的供体和有高消光系数的受体, 并且供体发射光谱与受体的激发光谱高度重合的供体受体对.
2 FRET定量检测的难点
已知主要有2个因素影响FRET效率的定量检测:一个是光谱串扰, 包括供体荧光串扰到受体通道(发射光谱串扰)和激发供体时直接激发受体(激发光谱串扰)[7-8]. 由于有机荧光团的光物理特性, 绝大数现有的FRET供体受体对都存在光谱串扰. 在定量检测FRET效率时必须消除这些串扰, 选择2个发射光谱分离较大的供体受体对, 能够减小串扰, 但同时J()会减小. 影响FRET定量检测的另一个因素是参与FRET作用的供体与受体对所占整个荧光基团的比例[9-10]. 自由的供体与受体相互作用时, 往往不是所有的供体或受体分子都参与相互作用. 参与相互作用分子的百分数难以知晓, 因此, 各种FRET效率的定量检测方法对有自由的供受体存在时都不能完全地反映FRET效率, 只能测量表观FRET效率. 另外, 活细胞中荧光蛋白表达水平和背景噪音等其它因素也可能影响FRET效率的定量检测.
3 GFP与FRET技术
绿色荧光蛋白(green fluorescent proteins, GFP)是从维多利亚水母中分离出来的, 受紫外或蓝光激发而发出绿色荧光[11]. 与GFP融合的蛋白在细胞中仍然能够行使正常的功能, 因此GFP成为了检测蛋白质分子间相互作用的报告分子. 近年来又发现了GFP的多种变体, 与迅速发展的荧光显微镜技术结合极大地改善了活细胞成像和FRET技术在活细胞中的应用,使得FRET技术在细胞生物学和化学方面的应用得到了质的飞跃. 基于荧光蛋白的FRET(FPs-FRET)技术已被广泛应用于活细胞实验研究中,极大促进了生物学的发展[12]. 利用基因转导技术和共聚焦荧光显微成像可以在活细胞中研究蛋白质定位、信号的传递、蛋白质分子间的相互作用和蛋白质分子的构象变化. 将荧光蛋白(FPs)接到感兴趣的蛋白质分子上, 可以对细胞进行实时动态检测, 也可视化监测细胞内蛋白质与蛋白相互作用的生理过程[13]. FPs-FRET传感器主要可以分为3类: 分子内的FRET传感器、双分子FRET传感器和基于双分子荧光互补传感器(BiFC)[13]. FPs-FRET传感器已经成为在活细胞中实时检测钙离子浓度、pH值、各种激酶活化、蛋白质磷酸化以及蛋白质分子间相互作用等动态过程的重要技术[13-14].
4 常用的定量检测FRET技术及其在细胞信号转导机制研究中应用
FRET定量检测的常用方法有寿命成像(FLIM-FRET), 光谱成像(spectral FRET), 受体光漂白(acceptor photobleaching FRET)和敏化发射测量(sensitized emission FRET)等方法, 下面介绍FRET技术在细胞信号转导机制研究中的应用.
4.1 荧光寿命成像显微术(FLIM-FRET)
FLIM方法主要是通过测量受体存在和不存在时的供体分子的荧光寿命D和DA来确定FRET效率E[5],
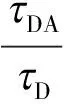
(4)
但在实际应用中, 一般是通过测量多分子的荧光强度指数衰减来计算供体的荧光寿命, 而且由于荧光强度衰减呈现多指数衰减的特点, 所以一般采用供体的平均寿命来计算FRET效率[15-16].
FLIM方法检测的结果一般作为其他FRET定量检测方法的对照标准. 要求供体通道选择性探测供体荧光, 而且FLIM系统价格昂贵, 同时也需要熟练的操作人员进行操作, 这些都限制了FLIM方法的推广应用. 事实上用时间相关单光子计数(TCSPC)进行精确地拟合时可能带来了其他的方法没有的复杂问题[10], 尤其是复杂的光物理性质增加了寿命法分析的困难[15, 17]. 为了精确地对分子的荧光寿命进行多指数拟合, 在每个像素点上需有大量的光子[18], 这将大大延长成像时间, 使得FLIM方法不适合于活细胞中的实时动态检测[19-20].
4.2 光谱法(spectral FRET, sFRET)
每一个荧光团都有各自的激发和发射光谱, 不同于采用荧光通道获得数据的强度测量方法和寿命测量方法的是光谱法获得的分别是供体、受体和供体与受体样本的发射光谱. 通过供体和受体的光谱对供体-受体样本的光谱进行拟合得到FRET效率.
THALER等人[21]提出了一种利用光谱成像的FRET效率定量测量方法. 存在FRET时混合光谱Fcomplex包括3个部分:供体的荧光、受体的荧光和从供体转移到受体的那部分荧光:
Fcomplex=d×(1-E)×Fd+a×Fa+d×E×
(Φa/Φd)×k()×Fa,
(5)
式(5)中,Fd和Fa分别表示单位浓度的供体和受体的发射谱,d和a表示供体和受体的浓度,Φd和Φa分别表示供体与受体的量子产率,κ()表示波长为的激发光分别激发单位浓度的供体和受体所得的荧光强度的比值. 采用2种不同激发光分别得到的2个不同的混合光谱方程, 通过对2个方程简化处理及设定关系式就可以获得供体浓度、受体浓度以及FRET效率.
本研究小组最近也提出了一种基于荧光光谱拟合的FRET定量分析方法[22]. 该方法通过测量细胞内供体-受体对的荧光发射谱, 然后按照供体和受体的荧光发射谱进行拟合得到FRET效率. 该方法有效地解决光谱串扰问题, 可用于检测蛋白质之间的相互作用. 最近, LEVY等[23]提出了基于2种不同激发光条件的发射光谱测量FRET效率的方法, 该方法能够测量很小的FRET效率和参与作用的供体与受体摩尔比, 而且能够通过仔细的校准来消除自发荧光和背景光的影响.
sFRET方法是测量FRET效率最为灵敏的方法, 在目前已知的方法中只有光谱法能够探测出小于5%FRET信号. sFRET方法能够有效地解决光谱串扰问题, 也能够很好地消除背景光和自发荧光的影响, 因此sFRET方法可以用于测量蛋白质分子间弱的FRET信号. 但是sFRET方法对于数据采集要求很高, 因为较小的干扰就可能对结果造成较大影响, 所以须对数据要进行严格的校正, 特别是须对背景光和自发荧光进行严格校正.
4.3 受体光漂白方法(cceptor photobleaching FRET,Pb-FRET)
光漂白方法(Pb-FRET)通过检测光漂白受体前后供体的荧光强度来获得FRET效率, 光漂白受体会导致供体的荧光强度上升. 光漂白方法分为完全光漂白方法和部分光漂白方法.
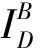
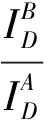
(6)
但是受体完全光漂白在现有的条件下很难做到, 而且随着光漂白程度的加深对细胞的损伤就越大, 本课题组的研究表明长时间的激光照射也可以引起细胞的凋亡[25].
ELDER等[20]提出了一种通过检测部分受体光漂白前后供体的荧光强度和受体光漂白程度来测量FRET效率的部分受体光漂白方法,
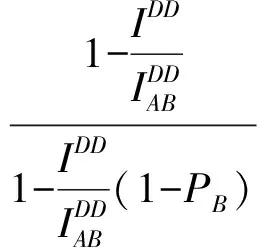
(7)
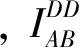
受体光漂白方法(Pb-FRET)操作简单, 在共聚焦显微镜上也很容易实现. Pb-FRET方法测量FRET效率既不依赖于系统参数,也不依赖于供体与受体的量子产率和消光系数, 只依赖于受体光漂白前后供体的荧光强度变化. 但是, 受体光漂白会对生物体造成的损伤, 不利于在单细胞中进行多次测量, 也不能在细胞中进行实时动态检测[20, 27]. 必须注意的是:受体光漂白过程中用最大的光强的受体激发光也可能漂白掉供体分子,最近发现在光漂白过程中YFP分子可以光转换成CFP分子[28].
4.4 敏化发射方法(Sensitized Emission FRET,SE-FRET)
敏化发射测量(SE-FRET)方法被广泛应用于活细胞中FRET效率的动态检测[20, 27]. SE-FRET既可以在共聚焦显微镜上实现, 也可以在宽场显微镜上实现. 传统的SE-FRET方法是利用3个滤光块组的方法, 每个滤光块组都是采用一个激发带宽滤光块来选择性激发供体或受体, 并用发射滤光块来收集供体或受体发射的荧光. 可是, 受体敏化发射荧光包括直接激发受体的荧光和供体串扰到受体通道的荧光, 其串扰路径如图1.

图1 敏化发射方法光谱串扰路径示意图
在实际的实验中, 除了测量待测FRET样本实验外, 还需增加对3个参考样本来对系统进行串扰校正:只有供体荧光团的供体对照样本, 只有受体荧光团的受体对照样本和已知FRET效率的校正样本. 增加的供体对照样本测量供体发射串扰(图1中path2), 受体对照样本测定直接激发受体发射串扰(图1中path1), 已知FRET效率的校正样本获得给定条件下成像系统的校正因子G[27]. 也有文献报道用2个化学计量比为1∶1且FRET效率差别较大的参考样本来获得校正因子G[29].
SE-FRET方法具有无损伤的特性, 成为在活细胞中最为适合于动态监测的方法[20, 26], 而且能够较好对光谱串扰和系统参数进行校正. 但是, SE-FRET方法也有其自身的限制,需要利用对照样本(至少3个)对光学检测系统以及荧光基团的光学性质进行事先校正,一旦校正完成,后续实验不能再改变任何系统参数, 且每次实验都要重新校正, 极大地增加了SE-FRET实验的工作量和难度, 也限制了该方法的推广应用. SE-FRET实验必须同时转染4个样本, 其中的任何一个样本没有转染成功, 都会导致实验的失败.
4.5 FRET技术在细胞信号转导机制研究中的应用
FRET技术已经成为在活细胞中研究蛋白质之间相互作用和蛋白质分子构象变化的广泛应的工具. 本研究小组近几年利用FRET技术在活细胞中研究了细胞增殖和细胞凋亡过程中的分析调控机制[30-34]. 通过构建基于GFPs的FRET质粒,利用共聚焦荧光显微镜在单个活细胞中研究各种诱导刺激条件下细胞凋亡的分子调控机理[32-36].
FRET技术在生物上的重要应用是通过实时检测荧光蛋白之间FRET的效率变化来研究荧光蛋白标记蛋白质分子间的相互作用. 利用FRET技术并结合共聚焦显微成像技术,本研究小组证明了在碱性条件下诱导细胞凋亡过程中Bid被切割成tBid并转位到线粒体上,并且证明凋亡过程中Caspase-3活化[31]. 为了在活细胞中实时研究Caspase-3的动态活化过程,筛选了稳定表达SCAT3的细胞系,在此基础上通过检测细胞凋亡期间SCAT3 FRET效率的动态变化,实现了在单个活细胞中实时检测caspase-3的动态活化过程[32].
利用ECFP标记Bax蛋白和EYFP标记PUMA蛋白,本实验室利用FRET技术在活细胞中首次证明了在紫外诱导的细胞凋亡过程中PUMA可以直接促进Bax的活化和转位,并抑制Bcl-XL蛋白活化[37]. 本研究小组还证明了低功率激光辐照能够通过GSK-3β未活化的机制来抑制Bax转位的上游过程[38],以及P53不依赖于PUMA转录因子而是通过Akt/FOXO3a介导的Bax活化和细胞凋亡[39].
5 总结
FRET技术已被广泛应用于活细胞中蛋白质之间相互作用和蛋白质分子构象变化的动态研究. 影响FRET定量检测的因素主要有光谱串扰和供体与受体的浓度比. GFP及其变种的发现以及显微荧光技术的发展使得FRET技术在活细胞中的应用更加广泛. 本文介绍了寿命测量法、光谱法、部分受光漂白方法和敏化发射等几种常用的FRET定量检测方法,并对上述各种方法在定量检测FRET效率上进行了简单的评述.
[1] LAKOWICZ J R. Energy Transfer: In Principles of Fluorescence Spectroscopy[M]. New York: Plenum Press, 1983.
[2] CLEGG R. Fluorescence Imaging Spectroscopy and Microscopy[M]. New York: Wiley, 1996.
[3] FÖRSTER T. Intermolecular energy migration and fluorescence[J]. Ann Phys, 1948, 2: 55-75.
[4] VAN DER MEER B. Kappa-squared: from nuisance to new sense[J]. Rew Mol Biotechnol, 2002, 82(3): 181-196.
[5] LAKOWICZ J R. Principles of fluorescence spectroscopy[M]. 2nd ed. New York: Plenum Press, 1999.
[6] PATTERSON G H, PISTON D W, BARISAS B G. Forster distances between green fluorescent protein pairs[J]. Anal Biochem, 2000, 284(2): 438-440.
[7] XIA Z, LIU Y. Reliable and global measurement of fluorescence resonance energy transfer using fluorescence microscopes[J]. Biophys J, 2001, 81(4): 2395-2402.
[8] ELANGOVAN M, WALLRABE H, CHEN Y, et al. Characterization of one- and two-photon excitation fluorescence resonance energy transfer microscopy[J]. Methods, 2003, 29(1): 58-73.
[9] HOPPE A, CHRISTENSEN K, SWANSON J A. Fluorescence resonance energy transfer-based stoichiometry in living cells[J]. Biophys J, 2002, 83(6): 3652-3664.
[10] MILLINGTON M, GRINDLAY G J, ALTENBACH K, et al. High-precision FLIM-FRET in fixed and living cells reveals heterogeneity in a simple CFP-YFP fusion protein[J]. Biophys Chem, 2007, 127(3): 155-164.
[11] TSIEN R Y. The green fluorescent protein[J]. Annu Rev Sci, 1998, 67: 509-544.
[12] SHANER N C, STEINBACH P A, TSIEN R Y. A guide to choosing fluorescent proteins[J]. Nat Methods, 2005, 2(12): 905-909.
[13] LBRAHEEM A, CAMPBELL R E. Designs and applications of fluorescent protein-based biosensors[J]. Curr Opin Chem Biol, 2010, 14(1): 30-36.
[14] AYE-HAN N N, NI Q, ZHANG J. Fluorescent biosensors for real-time tracking of post-translational modification dynamics[J]. Curr Opin Chem Biol, 2009, 13(4): 392-397.
[15] TRAMIER M, GAUTIER I, PIOLOT T, et al. Picosecond-hetero-FRET microscopy to probe protein-protein interactions in live cells[J]. Biophys J, 2002, 83(6): 3570-3577.
[16] HOPPE A, CHRISTENSEN K, SWANSON J A. Fluorescence resonance energy transfer-based stoichiometry in living cells[J]. Biophys J, 2002, 83(6): 3652-3664.
[17] SARKAR P, KOUSHIK S V, VOGEL S S, et al. Photophysical properties of cerulean and venus fluorescent proteins[J]. J Biomed Opt, 2009, 14(3): 034 - 047.
[18] KOLNER M, WOLFRUM J. How many photons are necessary for fluorescence lifetime measurements?[J]. Chem Phys Lett, 1992, 200(1/2): 199-204.
[19] LAKOWICZ J R. Principles of Fluorescence Spectroscopy[M]. New York: Springer, 2006.
[20] ELDER A D, DOMIN A, KAMINSKI SCHIERLE G S, et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission[J]. J R Soc Interface, 2009, 6(S1): S59-81.
[21] THALER C, KOUSHIK S V, BLANK P S,et al. Quantitative multiphoton spectral imaging and its use for measuring resonance energy transfer[J]. Biophys J, 2005, 89(4): 2736-2749.
[22] WANG L X, CHEN T S, QU J L, et al. Quantitative analysis of caspase-3 activation by fitting fluorescence emission spectra in living cells[J]. Micron, 2009, 40(8): 811-820.
[23] LEVY S, WILMS C D, BRUMER E, et al. SpRET: highly sensitive and reliable spectral measurement of absolute FRET efficiency[J]. Microsc Microanal, 2011, 17(2): 176-190.
[24] KENWORTHY A K, EDIDIN M. Distribution of a glycosylphosphatidylinositol-anchored protein at the apical surface of MDCK cells examined at a resolution of <100 Å using imaging fluorescence resonance energy transfer[J]. J Cell Biol, 1998, 142(1): 69-84.
[25] WANG F, CHEN T S, XING D, et al. Measuring dynamics of caspase-3 activity in living cells using FRET technique during apoptosis induced by high fluence low power laser irradiation[J]. Lasers Surg Med, 2005, 36(1): 2-7.
[26] WANG L X, CHEN T S, QU J L, et al. Photobleaching-based quantitative analysis of fluorescence resonance energy transfer inside Single living cell[J]. J Fluoresc, 2010, 20(1): 27-35.
[27] ZAL T, GASCOIGNE N R. Photobleaching-corrected FRET efficiency imaging of live cells[J]. Biophys J, 2004, 86(6): 3923-3939.
[28] VALENTIN G, VERHEGGEN C, PIOLOT T, et al. Photoconversion of YFP into a CFP-like species during acceptor photobleaching FRET experiments[J]. Nat Methods, 2005, 2(1): 801.
[29] CHEN H, PUHL H L, 3RD KOUSHIK S V, et al. Measurement of FRET efficiency and ratio of donor to acceptor concentration in living cells[J]. Biophys J, 2006, 91(5): L39-41.
[30] GUO W J, QIAN L, ZHANG J, et al. SIRT1 overexpression in neurons promotes neurite outgrowth and cell survival with reduced mTOR signaling[J]. J Neurosci Res, 2011, 89(11): 1723-1736.
[31] CHEN T S, WANG J J, XING D, et al.Spatio-temporal dynamic analysis of Bid activation and apoptosis induced by alkaline condition in human lung adenocarcinoma cell[J].Cell Physiol Biochem,2007,20(8):569-578.
[32] PAN W L, QU J L, CHEN T S, et al. FLIM and emission spectral analysis of caspase-3 activation inside single living cell during anticancer drug-induced cell death[J]. Eur Biophy J, 2009, 38:447-456.
[33] LU Y Y, CHEN T S, WANG X P, et al. Single cell analysis of dihydroartemisinin(DHA)-induced apoptosis through reactive oxygen species (ROS)-mediated caspase-8 activation and mitochondrial pathway in ASTC-a-1 cells using fluorescence imaging techniques[J]. J Biomed Opt, 2010,15(4): 046028-1-16.
[34] ZHANG W W, WANG Z P, CHEN T S. Curcumol induces apoptosis via caspases-independent mitochondrial pathway in huaman lung adenocarcinoma ASTC-a-1 cells[J]. Medicine Oncology, 2011, 28(1): 307-314.
[35] WU Y X, XING D. CHEN W R. Single cell FRET imaging for determination of pathway of tumor cell apoptosis induced by photofrin-PDT[J]. Cell Cycle, 2006, 5(7): 729-734.
[36] WU Y X, XING D, LUO S M, et al. Detection of caspase-3 activation in single cells by fluorescence resonance energy transfer during photodynamic therapy induced apoptosis[J]. Cancer Lett, 2006, 235(2): 239-247.
[37] ZHANG Y J, XING D, LIU L. PUMA promotes bax translocation by both directly activating Bax and antagonizing Bcl-XL during UV-induced apoptosis[J]. Mol Biol Cell, 2009, 20(13): 3077-3087.
[38] ZHANG L L, ZHANG Y J, XING D. LPLI inhibits apoptosis upstream of Bax translocation via a GSK-3β-inactivation mechanism[J]. J Cell Physiol, 2010, 224(1): 218-228.
[39] ZHANG Y J, ZHANG Z Z, XING D. P53-independent transcriptional regulation of PUMA by Akt/FOXO3a mediates Bax activation and cell apoptosis[J]. Cell Death Differ, 2010, in revision.
QuantitationandApplicationofFluorescenceResonanceEnergyTransfer(FRET)
ZHANG Jianwei, CHEN Tongsheng*
(MOE Key Laboratory of Laser Life Science & Institute of Laser Life Science, College of Biophotonics, South China Normal University, Guangzhou 510631, China)
Fluorescence resonance energy transfer (FRET) is the most widely used technology to study the protein-protein real-time dynamic interactions and the change of macromolecular conformation in living cells. Spectral cross-talks and acceptor-to-donor concentration ratio are the tissues harassing the quantitative measurement of FRET efficiency. Many different methods to quantitate FRET efficiency, such as FLIM-FRET, spectral FRET, acceptor photobleaching FRET and sensitized emission FRET methods, have been proposed. In this report, we introduce some quantitative FRET methods to study the mechanism of cell signal translation.
2012-04-23
国家自然科学基金项目(31071218; 61178078); 广东省高教厅重点项目(cxzd115)
*通讯作者,chentsh@scnu.edu.cn
1000-5463(2012)03-0012-06
Q631
A
10.6054/j.jscnun.2012.06.002
Keywords: Fluorescence Resonance Energy Transfer (FRET); FRET efficiency; quantitative measurement; fluorescent proteins
【责任编辑 成 文】

