小鼠精原干细胞分离培养条件的优化
张秀娟,李 莉,卫恒习,白银山,师如意,张守全
(华南农业大学动物科学学院,广东广州 510642)
在哺乳动物睾丸内,精子发生是一个受高度调控和持续的过程:精原干细胞(Spermatogonial stem cells,SSCs)一方面进行自我更新维持干细胞数量,另一方面又不断执行分化生成各级生精细胞直至最后生成精子[1-2].SSCs定居在曲精细管上皮的基膜处,是哺乳动物精子发生的最原始细胞,也是动物体内唯一能将遗传信息传递的干细胞[3].精原干细胞体外培养体系的建立,在SSCs生物学、医学、畜牧业生产及制备转基因动物等领域具有广阔的应用前景,然而SSCs在成年哺乳动物睾丸中的数量非常低,据报道1只成年公鼠睾丸内只有约2×104~3×104个被称为 Asingle(As)的精原细胞[4-5],因此建立SSCs的体外培养体系是开展其各方面研究的重中之重.研究表明,不但在不同物种间SSCs体外培养特性存在共性和差异,即使相同物种而遗传背景不同SSCs体外培养也有差异,如同一培养条件对不同品系来源SSCs体外增殖的影响有很大差异[6],建立的培养体系能支持 ICR或 C57BL/6×DBA/2 F1(BDF1)遗传背景的小鼠SSCs的体外增殖,但不支持C57BL/6和129/Sv遗传背景的小鼠SSCs.甚至小鼠不同品系 SSCs培养对生长因子的需求都不同[7],DBA/2小鼠的 SSCs在体外培养时,仅添加胶质细胞源性神经营养因子(Glial cell line-derived neurotrophic factor,GDNF)就能维持其长期增殖,而其他品系小鼠SSCs在体外的长期自我复制还需要其他生长因子.这些体外培养研究提示着遗传背景是影响SSCs增殖的重要因素之一,最新研究表明小鼠的遗传背景也会参与调控体内SSCs的自我更新[8],将不同供体小鼠的SSCs移植到经白消安处理的受体曲精细管内,发现其中DBA/2遗传背景与C57BL/6遗传背景相比,其SSCs在受体睾丸内增殖较快且数量较多.因MTT法可同时反映细胞数量和活力,近年来被广泛地应用在细胞增殖的检测中[9-10].昆明小鼠因遗传多样性、繁殖性能快等优点,目前是生命科学研究领域的重要模式动物之一,尤其在生殖与发育生物学方面,然而昆明小鼠SSCs增殖的体外培养体系对生长因子的需求还不完全清晰,因此本研究分离培养了昆明小鼠SSCs,采用MTT法检测其不同生长因子及其添加浓度对SSCs体外增殖的影响,从而建立一种简单有效的增殖SSCs培养体系.
1 材料与方法
1.1 研究对象与主要试剂
5~7 d的雄性昆明小鼠,购于南方医科大学实验动物中心.Ⅳ型胶原酶、DNA酶Ⅰ和0.25%胰酶 -EDTA为Sigma公司产品,DMEM培养基和胎牛血清(FCS)等为Gibco公司产品,Percoll液为Pharmacia公司产品,四甲基偶氮唑蓝(MTT)为Amresco公司产品;重组小鼠碱性成纤维生长因子(basic fibroblast growth factor,bFGF)和重组大鼠 GDNF(rrGDNF)为R&D公司产品,鼠白血病抑制因子(murine leukemia inhibitory factor,LIF)为Chemicon公司产品.
1.2 SSCs的分离与纯化
两步酶消化法[11]获得曲精细管细胞悬液.先用1 g/LⅣ型胶原酶和20 μg/mL DNAseⅠ联合消化,600 r/min离心5 min,收集曲精细管,再用0.25%胰酶-EDTA 和20 μg/mL DNAaseⅠ消化.用4 g/L台盼兰拒染法检测细胞活率≥90%.
差速贴壁法,将细胞悬液接种至2 g/L明胶包被的培养瓶,首次差速贴壁时间为6~8 h,转移到新的2 g/L明胶包被的培养瓶继续培养差贴8~10 h,第3次转移后培养过夜,即获得纯化的SSCs.
Percoll不连续密度梯度法,按9 g/L无菌生理盐水∶Percoll原液体积比为1∶9比例配成φ为90%的Percoll母液,梯度设置见表1.

表1 Percoll不连续密度梯度的组成Tab.1 Composition of Percoll discontinuous density gradients
1.3 小鼠支持细胞(MSC)饲养层的准备
继续培养首次差速贴壁后的体细胞,体外传代培养至稳定,形态学观察约大于95%的细胞属支持细胞,取稳定培养的F3~F6,经10 μg/mL的丝裂霉素C处理制作饲养层.
1.4 SSCs的纯化率鉴定
因SSCs具有碱性磷酸酶(Alkaline phosphatase,AP)活性[7],而分化的和体细胞不具有此特性,制作细胞涂片,做AP活性染色鉴定,每次涂片选取n个(n≥3)视野,计算染色细胞数目占总细胞数目的比率,每种纯化方法,重复3次.
1.5 MTT法检测生长因子对SSCs体外培养增殖的效果
SSCs培养液是 DMEM液,并添加 55 μmol/L 2-巯基乙醇,2 mmol/L L-谷氨酰胺,30 μg/mL丙酮酸钠,必需氨基酸(φ为1%),非必需氨基酸(φ为1%),维生素溶液(φ 为 1%),φ 为 5%FCS,20 ng/mL bFGF因子,20 ng/mL GDNF因子,103U/mL LIF因子,φ为1%的双抗.
将纯化的SSCs调整细胞密度至2×105mL-1,接种至MSC饲养层上,每孔接种200 μL;每个处理组设置4个重复(分组情况见表2),对照组无生长因子添加,分别与体外培养3、5和7 d的同一时间点,显微镜下观察细胞的生长,MTT法检测细胞增殖情况.
1.6 统计与分析
数据采用EXCEL和SPSS 14.0统计分析.
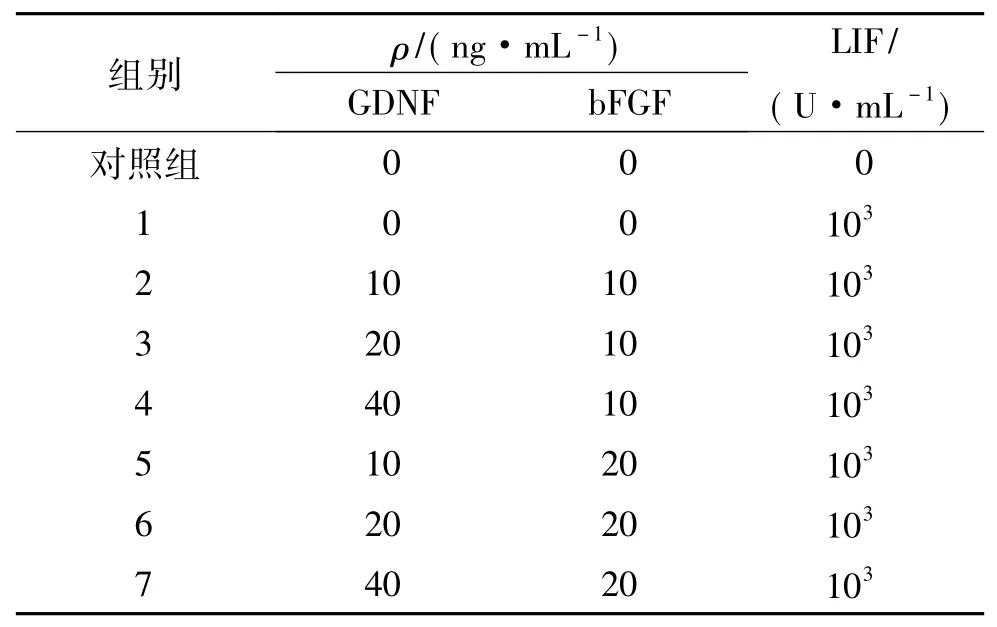
表2 LIF、GDNF、bFGF 3种生长因子不同组合浓度的分组Tab.2 Groups of LIF,GDNF,bFGF factors in different combination concentrations
2 结果与分析
2.1 5日龄小鼠和7日龄小鼠SSCs的分离效果分析
小鼠出生后睾丸组织细胞增殖很快,发现5日龄和7日龄其睾丸组织消化效果有很大差异(表3),7日龄小鼠在细胞总数、多细胞团率以及多次共贴壁率方面都显著高于5日龄的(P<0.05),且7日龄小鼠睾丸细胞活力较高,但从获得更多的SSCs来看,2个日龄无显著差异(P>0.05).
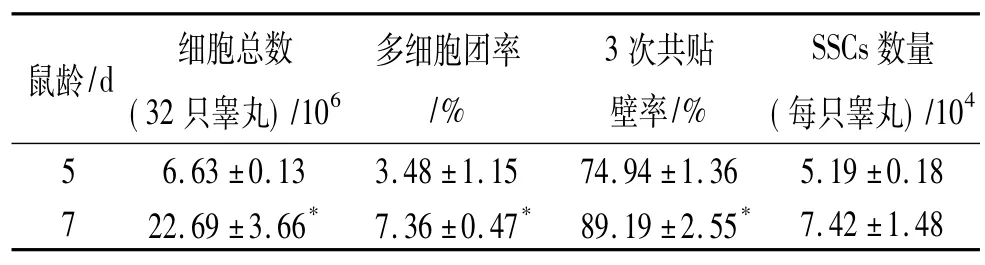
表3 两步酶消化法对两组鼠龄睾丸组织分离效果分析1)Tab.3 Isolation result analysis of two groups of pup mouse testes by two-step enzymatic digestion method
2.2 两种SSCs纯化方法效果的比较
从图1可明显看出,多次差速贴壁法在纯化后细胞占纯化前细胞总量的回收细胞比率(20.10%vs.13.94%)和AP 阳性率(85.06%vs.81.82%)都高于Percoll不连续密度梯度法,尽管两者无统计意义上的显著差异(P>0.05),但多次差速贴壁法因操作相对简便而被选择应用在后续的研究中.

图1 两种SSCs纯化方法的结果比较Fig.1 Results comparison of two purification methods
2.3 LIF因子对SSCs的增殖作用
MTT法检测结果表明,LIF的添加组在培养的3和5 d时,无明显促进,而在培养的7 d后,与对照组相比有显著的促增殖作用(P<0.05,图2).
2.4 GDNF、bFGF和LIF三因子组合对SSCs增殖的影响
MTT法检测结果(图3)及细胞形态学观察结果(图4)表明,GDNF、bFGF和103U/mL LIF 3种因子不同质量浓度组与对照组相比,在培养的3、5和7 d的增殖效应都显著高于对照组(P<0.05),尤其是20 ng/mL bFGF、20 ng/mL GDNF 和 103U/mL LIF组,在培养的7 d后,促增殖效应显著高于其他质量浓度添加组(P<0.05).

图2 LIF因子添加对原代小鼠SSCs增殖的影响Fig.2 Effects of LIF factor on primary SSCs proliferation

图3 MTT法检测GDNF、bFGF和LIF组合对原代小鼠SSCs增殖的影响Fig.3 Effect of three factors of GDNF,bFGF and LIF on primary SSCs proliferation by MTT method

图4 GDNF、bFGF和LIF组合添加培养原代SSCs的形态学观察Fig.4 Morphology observation of primary SSCs at day 5 in vitro culture with three factors of GDNF,bFGF and LIF
3 讨论
小鼠的年龄会影响睾丸中SSCs的活性,一般采用幼年的动物为研究对象.新生鼠睾丸中SSCs纯度高且无分化型精原细胞,但是细胞数量相对来说很少[5,12].幼龄小鼠因富含 SSCs[7,13]和较高的细胞活性[14]而成为理想的试验材料,7日龄的小鼠睾丸细胞总数约是5日龄的3~4倍,SSCs的总数只是略多,却无统计意义上的显著差异,小鼠出生后的几天内,生殖母细胞继续增殖发育成SSCs,SSCs缓慢增殖维持着干细胞的数量和功能.
不连续密度梯度法和差速贴壁法都是简单有效的方法,资料报道,Percoll密度梯度法和BSA梯度法可获得较为纯化的小鼠 SSCs,其纯度大约从68.76% ~90%不等[15-16],本试验Percoll密度梯度法纯化5~7 d的昆明小鼠SSCs,在35% ~45%处获得SSCs,其纯度达到平均81.82%.利用睾丸内支持细胞和间质细胞在体外能较快贴壁生长的特点,多次差速贴壁后获得平均为85.06%的纯化率.同时,研究表明少量体细胞作为SSCs生长的微环境可支持体外短期生长和特性维持[17].利用多次差速贴壁方法成功获得遗传背景分别为DBA/2和ICR的小鼠SSCs体外至少6个月的长期稳定增殖[18-19].
GDNF促进体外培养的SSCs自我更新,主要通过Ras信号通路最终上调 C-fos的表达[20]和 Src信号通路最终上调N-Myc的表达来实现[21].GDNF和bFGF 2种因子同时添加对多种遗传背景的小鼠SSCs体外培养增殖具有协同效应[7,22-23],本试验结果证明该效果.昆明小鼠SSCs的体外培养bFGF单独添加,较对照组显著促进了SSCs的增殖,形成小克隆簇(结果未显示),同时bFGF因子是PGCs体外培养的一关键生长因子,两者是有连续的,有相似之处.研究表明bFGF通过自分泌方式能够促使GDNF和GFRα1的生成,从而降低了神经细胞的凋亡[24],这或许提示着bFGF在SSCs体外自我更新和增殖当中,能够通过这种方式或通过某些信号通路从而和GDNF有协同作用.
LIF因子对SSCs的作用方式和途径目前尚未完全清楚,尽管LIF因子对小鼠SSCs的克隆形成和体外增殖无显著作用[23],但诸多已建立的小鼠SSCs体外培养体系,培养基含LIF因子或使用分泌LIF因子的 MEF 饲养层等[6,18,22].目前的研究主要集中在细胞形态学观察、体外培养或移植后克隆形成数量来评价LIF因子的作用,本试验通过MTT法,发现在培养的7 d,单因子添加LIF组比对照组SSCs活细胞数量显著增多,并且LIF因子和GDNF、bFGF具有组合效应,对SSCs的增殖具有促进作用,但通过细胞形态学观察无明显区别,这可能是MTT法对活细胞数量检测的客观精确性,LIF因子对SSCs体外培养的作用有待进一步的揭示.
[1]SCCLATT S.Spermatogonial stem cell preservation and transplantation[J].Mol Cell Endocrinol,2002,187(1/2):107-111.
[2]DE ROOIJ D G.Proliferation and differentiation of spermatogonial stem cells[J].Reproduction,2001,121:347-354.
[3]OGAWA T,OHMURA M,YUMURA Y,et al.Expansion of murine spermatogonial stem cells through serial transplantation[J].Biol Reprod,2003,68(1):316-322.
[4]MEISTRICH M L,VAN BEEK M E.Spermatogonial stem cells:Assessing their survival and ability to produce differentiated cells[J].Methods Toxicol,1993,3(A):106-123.
[5]DE ROOIJ D G.Stem cells in the testis[J].Int J Exp Pathol,1998,79(2):67-80.
[6]KANATSU-SHINOHARA M,OGONUKI N,INOUE K,et al.Long term proliferation in culture and germline transmission of mouse male germline stem cells[J].Biol Reprod,2003,69(2):612-616.
[7]KUBOTA H,AVARBOCK M R,BRINSTER R L.Culture conditions and single growth factors affect fate determination of mouse spermatogonial stem cells[J].Biol Reprod,2004,71(3):722-731.
[8]KANATSU-SHINOHARA M,OGONUKI N,MIKI H,et al.Genetic influences in mouse spermatogonial stem cell self-renewal[J].J Reprod Dev,2010,56:145-153.
[9]LIU Hui,COLLINS S F,SUGGS L J.Three dimensional culture of expansion and differentiation of mouse embryonic stem cells[J].Biomaterials,2006,27:6004-6014.
[10]ZHANG Ge,WANG Xiao-hong,WANG Zong-li,et al.A PEGylated fibrin patch for mesenchymal stem cell delivery[J].Tissue Eng,2006,12(1):9-19.
[11]KUBOTA H,AVARBOCK M R,BRINSTER R L.Growth factors essential for self-renewal and expansion of mouse spermatogonial stem cells[J].PNAS,2004,101(47):16489-16494.
[12]YOSHIDA S,SUKENO T,NAKAGAWA K,et al.The first round of mouse spermatogenesis is a distinctive program that lacks the self-renewing spermatogonia stage[J].Development,2006,133(8):1495-1505.
[13]SHINOHARA T,ORWIG K E,AVARBOCK M R,et al.Remodeling of the postnatal mouse testis is accompanied by dramatic changes in stem cell number and niche accessibility[J].PNAS,2001,98(11):6186-6191.
[14]NAGANO M,RYU B Y,BRINSER C J,et al.Maintenance of mouse male germ line stem cells in vitro[J].Biol Reprod,2003,68(6):2207-2214.
[15]张学明,赖良学,李德雪,等.小鼠精原细胞的分离和纯化[J].解剖学报,2000,31(3):235-238.
[16]BRAYDICH-STOLLE L,NATALIA K,MARTIN D,et al.Role of Src family kinases and N-Myc in spermatogonial stem cell proliferation[J].Dev Biol,2007,304(1):34-45.
[17]OATLY M J,RACICOT K E,OATLY J M.Sertoli cells dictate spermatogonial stem cell niches in the mouse testis[J].Biol Reprod,2010,84(4):639-645.
[18]OGAWA T,OHMURA M,TAMURA Y,et al.Derivation and morphological characterization of mouse spermatogonial stem cell line[J].Arch Histol Cytol,2004,67(4):297-306.
[19]KANATSU-SHINOHARA M,INOUE K,OGONUKI N,et al.Long term cultureof mouse male germline stem cells under serum or feeder free conditions[J].Biol Reprod,2005,72(4):985-991.
[20]HE Zu-ping,JIANG Ji-ji,KOKKINAKI M,et al.GDNF up-regulates c-fos Transcription via the Ras/ERK1/2 pathway to promote mouse spermatogonial stem cell proliferation[J].Stem Cells,2008,26(1):266-278.
[21]LEE J,KANATSU-SHINOHARA M,INOUE K,et al.Akt mediates self-renewal division of mouse spermatogonial stem cells[J].Development,2007,134(10):1853-1859.
[22]RYU B Y,KUBOTAH,AVARBOCK M R,et al.Conservation of spermatogonial stem cell self-renewal signaling between mouse and rat[J].PNAS,2005,102(40):14302-14307.
[23]KANATSU-SHINOHARA M,SHINOHARA T.Cultureand genetic modification of mouse germline stem cells[J].Ann NY Acad Sci,2007,1120(1):59-71.
[24]LENHARD T,SCHOBER A,SUTER-CRAZZOLARA C,et al.Fibroblast growth Factor-2 requires glial-cell-derived neurtrophic factor exerting its neuroprtective actions on glutamate-lesioned hippocampal neurons[J].Mol Cell Neuro Sci,2002,20(2):181-197.

