论影响葡萄糖在骨骼肌和心肌中转运的因素
陈 松
(东北大学体育部,辽宁沈阳 110004)
◂运动人体科学
论影响葡萄糖在骨骼肌和心肌中转运的因素
陈 松
(东北大学体育部,辽宁沈阳 110004)
就近期国外在此方面发表的文章进行了归纳总结,主要论述了AMP激活蛋白激酶(AMPK)、钙、锂离子、雌性激素和生长激素及糖朊在骨骼肌和心肌的葡萄糖转运过程中所起的协同或抑制作用。
葡萄糖转运;低氧状态;运动训练;胰岛素;骨骼肌;心肌
文献报道骨骼肌中葡萄糖转运主要是由葡萄糖转运因子4(GLUT-4)蛋白质所调节的[1-7]。葡萄糖在肌肉中转运的三种主要影响因素是胰岛素、锻炼或者肌肉收缩和低氧状态[8-14]。组织细胞运转和利用氧和能源物质为机体活动提供能量的水平,是两个决定提高运动能力最关键的因素。为了维持能量平衡,组织细胞以能量代谢为中心对氧和能源物质的代谢进行十分复杂而精细的调整。葡萄糖是哺乳动物十分重要的能源物质,是维持能力代谢和生命活动的重要代谢底物。组织葡萄糖含量的变化受葡萄糖摄取、分解及转换为糖原三个环节的影响。葡萄糖代谢的第一步是葡萄糖跨过细胞膜进入细胞内,这一步是多种细胞或组织中的葡萄糖代谢的限速步骤,因此,葡萄糖摄取这一环节成为多种激素或生理刺激影响细胞内葡萄糖代谢的作用点[15]。葡萄糖转运是典型的所有真核状态的细胞的一个根本生理过程,现已知道的三种葡萄糖在肌肉中的转运的主要生理刺激是胰岛素、运动锻炼或者肌肉收缩和低氧状态,即胰岛素、低氧环境和锻炼或肌肉收缩能激活并增加葡萄糖的转运。除此之外,还有许多因素能够影响葡萄糖在骨骼肌和心肌中的转运,例如多种蛋白酶,激素,糖朊,药物,钙离子,食物结构,体液酸碱值等。为了更好地了解影响葡萄糖转运的机制,提高运动训练时骨骼肌和心肌对葡萄糖的摄取能力。
本文就近期国外在此方面发表的文章进行了归纳总结,主要论述了AMP激活蛋白激酶(AMPK),钙调节酶,雌性激素和生长激素及糖朊在骨骼肌和心肌的葡萄糖转运过程中所起的作用,以便更科学、更合理、更有效地安排训炼,并达到提高运动训练效率的目的。
1 AMP激活蛋白激酶(AMPK)在葡萄糖转运中的作用
AMP激活蛋白激酶(AMPK)是能量感觉酶,是被细胞的急剧增加的(AMP)与(ATP)比率所激活的。在骨骼肌和心肌中,AMPK活动可被如锻炼、低氧状态、局部缺血和渗透压力等刺激而增加。许多实验证明了骨骼肌中的AMPK活动的增加可导致对葡萄糖转运的增加。虽然这种功效类似胰岛素在肌肉葡萄糖转运中的作用,但是AMPK调节的葡萄糖转运的机制包括接近信号与胰岛素的完全不同。
图1说明了AMPK在葡萄糖转运中的作用[16]:刺激导致的(AMP)与(ATP)比率的增加激活了AMPK而引起葡萄糖转运的增加。低氧状态导致的葡萄糖转运的增加大概完全由AMPK调控的,锻炼和渗透压力导致的葡萄糖转运增加似乎同时由AMPK依赖和AMPK独立路径所调控,降血糖药甲福明二甲双胍和噻唑烷二酮可激活AMPK。有些报告建议甲福明二甲双胍可以独立方式激活AMPK。
这里简述一个研究实例。为了研究低氧状态和5氨基咪唑4氨甲酰1贝它D呋喃核糖苷(AICAR)在激活AMP激酶(AMPK)并且刺激葡萄糖转运的同时,是否也导致胰岛素敏感性的增加,Fisher[17]等利用Wistar大鼠游泳活动后取肱骨内上肌肉做样品培养并测定葡萄糖转运量。结果显示葡萄糖转运量与对照组相比增加了一倍,胰岛素敏感性的增量相当于游泳两个小时或10分钟的体外电子被刺激的肌肉收缩。在预先的锻炼或AICAR处理后的磷脂酰肌醇激酶和蛋白激酶B(PKB)均未增加胰岛素对葡萄糖转运的敏感性。肌肉收缩与AICAR的处理和低氧状态均能提高2~3倍AMPK的活动能力。结果显示胰岛素对肌肉锻炼后葡萄糖转运的敏感性增量是由活化的AMPK调节,即AMP激酶的活化作用提高了胰岛素对肌肉葡萄糖转运的敏感性。
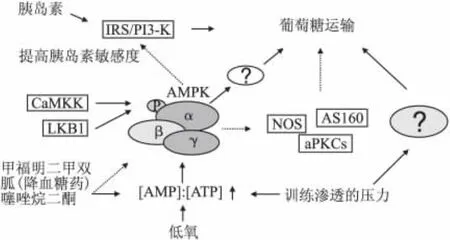
图1 AMPK和葡萄糖转运关系
尽管有四百多篇的科研报告研究了AMPK和葡萄糖转运间的机制[18-24],但其中间体、信号机制依然尚未定义,AMPK在提高胰岛素敏感性的潜在作用的机制尚未清楚,这些都是急需体育科研工作者共同努力来证明的。
2 钙离子在葡萄糖转运中的作用
2.1 钙依赖调节蛋白激酶II(CAMKII)抑制剂(KN-62)在胰岛素和低氧状态刺激的葡萄糖转运过程中的抑制作用
已有的研究表明,钙调节蛋白在低氧状态和胰岛素刺激所引起的葡萄糖转运过程中发挥了作用。然而,因为钙调节蛋白与多种蛋白质底物相互作用,尚未确定哪种蛋白质介入了葡萄糖的转运。Brozinick[25]等使用了钙依赖调节蛋白激酶II(CAMKII)抑制剂1[N,O -Bis-(5-isoquinolinesulphonyl)–N-methyl-LTYROSYL-4-phenylpiperazine(KN-62)研究了其在提取的鼠比目鱼肌和肱骨内肌肉上对葡萄糖转运所起的作用。通过分别测量肌肉上葡萄糖的转运活动,钙离子和糖朊的数量及其磷酸肌醇3激酶的活动,KN-62没有影响2脱氧葡萄糖的转运,但是却分别抑制了胰岛素和低氧状态被刺激的葡萄糖转运的46%和40%。与此同时,测定1N,O-Bis-(1,5-isoquinolinesulphonyl)-N甲醇ltyrosyl-4-phenylpiperazine(KN-04),KN-62的一个结构类似物,发现其不抑制CAMKII,并且没有影响低氧状态或被胰岛素刺激的葡萄糖的转运。相应地,KN-62减少了细胞表面的GLUT4数量即降低了葡萄糖的转运(胰岛素刺激状态减少了49%,低氧状态减少了54%)。另外的实验显示,KN-62也能抑制胰岛素和低氧状态刺激的鼠肱骨内上部肌肉(快速抽搐肌肉)的葡萄糖转运,使葡萄糖转运分别降低了37和40%。此结果表明KN-62对葡萄糖转运抑制作用不仅在比目鱼肌的慢抽搐纤维部分,而且还在快速抽搐肌肉部分。KN-62对低氧状态被刺激的葡萄糖转运的抑制作用极可能是作用于钙依赖调节蛋白激酶II(CAMKII),因为KN-62没有抑制低氧状态被刺激的钙从肌肉的流出和低氧状态被刺激的糖朊裂解。另外,KN-62没有影响被胰岛素刺激的磷酸肌醇3激酶和Akt的活动,因此建议KN-62的作用不归结于非特异性抑制剂的作用。本研究的结果表明钙依赖调节蛋白激酶(CAMKII)在被胰岛素和低氧状态刺激的葡萄糖转运中起着重要作用。
2.2 钙调节蛋白抑制剂(CGS 9343B)对骨骼肌中的葡萄糖转运的作用
Shashkin[26]用提取的老鼠比目鱼肌研究了钙调蛋白在胰岛素控制的碳水化合物代谢中的作用。通过实验测定了鼠比目鱼肌中葡萄糖6P的含量,糖朊合成量,CGS 9343B抑制糖朊合成量,2脱氧葡萄糖的摄取,3-O-甲基葡萄糖的转运和CGS 9343B调节抑制3-O-甲基葡萄糖在老鼠肱骨内上肌的转运依赖性后得出结论,钙调蛋白拮抗剂CGS 9343B对基础糖朊合成酶的功效、高能磷酸盐含量,葡萄糖6P或者糖朊合成没有影响。然而,CGS 9343B分别抑制了2脱氧葡萄糖摄取和3-O-甲基葡萄糖的转运率达到30%(P<0.05)和40%(P<0.001)。胰岛素增强了糖朊合成酶差不多40%(P<0.01)的活动而且增量在CGS 9343B存在下不变。胰岛素增加了葡萄糖6 P含量(大约2倍),糖朊合成(大约8倍),2脱氧葡萄糖摄取(大约3倍)和3-O-甲基葡萄糖转运(大约2倍)并且这些增量可被CGS 9343B抑制。在提取的老鼠肱骨内上肌的实验发现CGS 9343B也抑制在低氧状态下3-O-甲基葡萄糖的转运。结果表明:无论在有无外界刺激下(胰岛素和低氧状态),己糖转运需要功能钙调节蛋白;胰岛素调节的糖朊合酶的活化作用不需要功能钙调蛋白。
2.3 在慢抽搐鼠比目鱼肌收缩和低氧状态刺激的葡萄糖转运仅由钙离子依赖机制调节
在快速抽搐鼠肱骨内上肌被收缩刺激引起的葡萄糖转运的增加由AMPK-和钙离子/钙调蛋白依赖蛋白激酶(CAMK)-依赖信号路径来调节。然而,最近研究建议在慢抽搐骨骼肌上被收缩刺激引起的葡萄糖转运的增加通过一条由AMPK独立的路径来调节。本研究的目的是验证这个假设。将检验收缩刺激在鼠的葡萄糖转运慢抽搐比目鱼肌肌肉由一条AMPK-独立/钙离子依赖来调节的。咖啡因、钙离子释放的媒介(SR),在高能磷酸盐不导致肌肉收缩也不减少的浓度,导致了脱氧葡萄糖(2DG)在分裂的比目鱼肌中大约2倍的增量。这种葡萄糖转运的增量可被SR钙通道阻止剂-丹曲洛林和CAMK抑制剂KN93所阻止。相反地,5氨基咪唑4氨甲酰1betaD呋喃核糖苷(AICAR),AMPK活化剂,没有对在分裂比目鱼肌中2DG的摄取起增加作用,而导致磷酸化AMPK和它的基体乙酰基CoA碳酸酵素增加大约2倍。由低氧导致的2DG的增量可由丹曲洛林和KN93防止,而由低氧刺激的AMPK磷酸化却不能由这些媒介来改变。僵直的肌肉收缩导致大约3.5倍2DG摄取增加可由KN93阻止,却不能阻止AMPK磷酸化的增量。以上的结果证明,鼠慢抽搐肌的低氧和被收缩刺激引起的葡萄糖转运是完全被钙离子依赖机制所调节的[27]。
2.4 碱性pH对葡萄糖在骨骼肌转运中的刺激作用
Ren[28]通过以下实验验证了碱性pH对葡萄糖在骨骼肌转运的刺激作用。鼠肱骨内上肌肉在pH8.6培养45分钟后导致葡萄糖转运强度增加大约三倍,然而当减少培养基中的钙离子的浓度以及用25微摩尔的丹曲洛林-肌浆网钙离子释放拮抗化剂并没有影响葡萄糖的转运强度。此实验表明,碱性pH能导致钙离子从骨骼肌肌浆网中释放,肌质、肌浆中的钙离子浓度的提高能够刺激葡萄糖在骨骼肌中的转运。
3 多种非钙化合物对葡萄糖转运的影响
3.1 钒、钨和硒化合物对葡萄糖在鼠肌中转运的影响
Fürnsinn[29]对钒酸盐、钨酸盐、硒酸盐和亚硒酸盐对葡萄糖在提取的鼠比目鱼肌肌肉中新陈代谢的直接影响进行了研究。实验表明所有化合物均刺激了葡萄糖的转运,但是仅钒酸盐在糖朊合成上产生了胰岛素象的作用。葡萄糖处理过的肌肉在与钨酸盐、硒酸盐和亚硒酸盐接触后,即形成了缺氧肌肉,而且这种葡萄糖的摄取增加能够被丹曲洛林所抑制,并且迅速导致醣酵解和糖朊降解。结果表明:钒酸盐对葡萄糖在肌肉中新陈代谢的作用为胰岛素象的,而钨和硒盐刺激的葡萄糖转运是非胰岛素象的,可能为对毒性或渗透压的非特异性反应。
3.2 锂增加葡萄糖转运对各种刺激的敏感性
Tabata[30]发现在鼠肱骨内上肌肉上锂对基础葡萄糖转运活动仅有最小的作用,而锂能明显增加葡萄糖转运对胰岛素的敏感性-300微微摩尔的胰岛素在锂存在时能使葡萄糖转运量增加2.5倍。锂能中等程度地提高胰岛素反应性,锂的这种增加葡萄糖转运对刺激的敏感性能并不局限于胰岛素,锂也能增加葡萄糖转运对收缩活动、低氧状态、佛波醇酯类和磷脂酶C等刺激的敏感性。锂对葡萄糖在骨骼肌中的转运和新陈代谢的功效与持久的体育锻炼作用非常相似。
4 雌激素在对缺氧锻炼的生理反应循环中的作用
Sandoval[31]测试了口服避孕药周期是否影响对缺氧的内分泌和新陈代谢的反应。实验分为低氧组(氧气13%,P(IO2):95mmHg;H)和氧量正常组P(IO2):153mmHg;N)并且进行锻炼。8名妇女(28+/-1.2yr)在她们的口服避孕药周期期间参与了测试,分别服用了避孕药和安慰剂。在服用前、服用期间和服用后分别测量了她们的心肺功能,新陈代谢和神经内分泌测量。结果显示,心率对于训练反应是低氧组高于正常组,但是在避孕药组和安慰剂组之间无区别。乳酸盐水平在锻炼期间显著升高,并且乳酸盐和葡萄糖水平在30分钟的锻炼后低氧组显著高于正常组(P<0.0001)。相对于基础线,避孕药组的乳酸盐水平低于安慰剂组,但是葡萄糖水平和氢化皮质酮水平高于安慰剂组(P<0.001)。在锻炼期间和低氧组对于正常组,去甲肾上腺素水平均显著增加(P<0.0001)。然而,肾上腺素水平随着时间的推移或在试验组之间没有变化。由此可见,流通的雌二醇和孕酮在服药期间降低了对低氧锻炼的葡萄糖和乳酸盐反应。
5 锻炼和生长激素对葡萄糖耐受力的交互式作用
本研究调查了受训练的和未受训练的老鼠服用生长激素(GH)对葡萄糖耐受和肌肉GLUT4的蛋白质表达的作用。48只鼠分配到以下4个小组:控制、GH、锻炼训练和锻炼训练+GH小组。在注射GH 2个星期(65微克/千克/天)和锻炼训练以后,测量了老鼠的葡萄糖耐受和胰岛素反应和在红色腓肠肌和跖肌中GLUT4蛋白质水平、糖朊存贮和枸橼酸盐合酶活动。较注射盐水的控制鼠比,每日GH的服用增高了口头糖耐量试验和胰岛素反应的曲线。此外,在18小时的锻炼训练后测定,锻炼训练完全消除了GH导致的胰岛素抵抗性。另外,运动训练极大增加了肌肉糖朊存贮和GLUT4蛋白质水平,而GH的服用没有影响锻炼训练导致的GLUT4蛋白质和糖朊存贮增量,但是GH的服用使在跖肌的枸橼酸盐合酶活动进一步大于在训练导致的枸橼酸盐合酶活动水平之上。总而言之,这项研究第一次证明了规律的运动训练能够防止老鼠的由GH导致的胰岛素抵抗副作用[32]。
6 在鼠骨骼肌中低氧状态刺激的葡萄糖转运机制:糖朊的潜在作用
Reynolds[33]通过以下的实验研究了肌肉糖朊对低氧状态的葡萄糖转运的潜在抑制作用。三天游泳训练(2x3小时/天)导致鼠肱骨内上肌肉糖朊的含量增100%,GLUT-4的含量增加70%。在低氧状态1小时,锻炼训练(ET)之后鼠肌肉的葡萄糖转运不是明显升高,而惯座不动(SED)鼠的肌肉的葡萄糖转运降低了40%。在低氧状态1小时糖朊水平分别减少了27(ET)和64%(SED)。在低氧状态2小时以后,葡萄糖转运在基础之上显著增加在ET鼠的肌肉,但是仍然低于55%在SED鼠的肌肉。在低氧状态2小时以后,糖朊在ET和SET鼠的肌肉含量分别减少了50和83%。在隔夜快速地改过以后(大约4.5克食物),低氧状态1小时的葡萄糖转运和糖朊反应在两种鼠肌肉之间没有较大不同。这些研究结果显示糖朊和低氧状态被刺激的葡萄糖转运活动之间有一个相反关系,糖朊抑制低氧状态的葡萄糖转运。
7 训练对鼠肱骨内上肌的葡萄糖转运和细胞表面GLUT-4的影响作用
Reynolds[34]研究了在鼠肱骨内上肌肉锻炼训练的作用对其葡萄糖最大的转运活动和细胞表面GLUT-4的影响。五天游泳训练(2x3小时/天)导致在枸橼酸盐合酶活动的显著增加(24.5+/-0.6对20.1+/-0.7微摩尔x分钟(-1)x克(-1)),GLUT-4含量(22.9+/-0.8对 17.4+/-0.4%GLUT-4标准)和糖朊水平(54.3+/-9.4对28.6+/-9.4微摩尔/克)。在锻炼训练的肱骨内上肌肉,被胰岛素刺激的葡萄糖转运活动和细胞表面GLUT-4分别最大地增加了55%(1.50+/-0.11对0.97+/-0.10微摩尔x毫升[(-1)x20分钟(-1)]和48%[12.0+/-0.8对8.1+/-0.9x分钟(-1)(dpm)x毫克(-1)]。相反,同样在锻炼训练的肱骨内上肌,低氧状态被刺激的葡萄糖转运活动和细胞表面GLUT-4分别减少了38%[0.78+/-0.08vs.1.25+/-0.14微摩尔xml(-1)x20分钟(-1)]和40%(5.7+/-0.9对9.4+/-1.2dpm/毫克)。这些结果显示,在锻炼训练后,胰岛素和低氧状态被刺激的葡萄糖转运活动上的变化完全由细胞表面GLUT-4决定。最后,推论锻炼训练造成肌肉糖朊高水平使低氧状态被刺激的葡萄糖转运活动的降低。
8 系统低氧状态对训练的鼠心脏GLUT4蛋白质表达的作用
为提高运动员的耐力表现高度训练是一个共同的使用方法。Chou[35]研究了交互式作用的锻炼训练和慢性缺氧对糖朊存贮和GLUT4在心肌的蛋白质表达。32只体重相同的雄性Sprague-Dawley鼠被分配到以下四个小组之一:控制、锻炼、低氧状态和低氧状态锻炼。训练包括每天游泳2次,每次3小时,为期4个星期。所有鼠的糖朊含量、GLUT4蛋白质和mRNA在处理以后的16小时测定,测定方法主要为Westernblotting&Northernblotting。结果显示四个星期的锻炼组心肌糖朊水平升高了45%。低氧锻炼组心肌糖朊水平升高67%,比锻炼组显著增高。低氧状态组、锻炼组和低氧状态锻炼组的在心肌中的GLUT4蛋白质显著升高了40%~70%。低氧状态组在没有锻炼的情况下GLUT1蛋白质水平显著增高。在这项研究中发现GLUT4在心肌的基因表达可以由与低氧状态相结合的锻炼训练而显著增强。
9 人体心肌在有高度的低氧状态下葡萄糖的摄取量增加
Chen[36]在一个模仿的高度环境(14%氧气,相当于在海平面上3000米)或室空气(21%氧气)使用(18F)-2 deoxy 2 fluoro D葡萄糖正电子成象术(FDG-PET),测定人心脏的葡萄糖摄取。结果显示,测试对象(n=6)在大约45min时开始承受缺氧状态的困难,这与极大增加的血液乳酸盐含量一致,反映无氧醣解作用的加速率。在心脏低氧状态升高了大约70%的FDG,但是不在肢体(代表主要骨骼肌)、脑子和肝脏。这项研究为低氧状态被刺激的葡萄糖在心脏的升高提供了第一个人的证据。在这个低氧水平,以前观察到的鼠骨骼肌在低氧状态被刺激的葡萄糖升高在人的研究中未被证实。
10 结论
1)骨骼肌中AMPK活动的增加可导致对葡萄糖转运的增加,但是,AMPK调节葡萄糖转运的机制包括接近信号与胰岛素的完全不同。尽管许多实验研究了AMPK和葡萄糖转运间的机制[18-24],但其中间体、信号机制依然尚未定义,AMPK在提高胰岛素敏感性的潜在作用的机制尚未清楚。
2)钙依赖调节蛋白激酶(CAMKII)在被胰岛素和低氧状态刺激的葡萄糖转运中起着重要作用。无论在有无外界刺激下(胰岛素和低氧状态),己糖转运需要功能钙调节蛋白,胰岛素调节的糖朊合酶的活化作用不需要功能钙调节蛋白。鼠慢抽搐肌的低氧和被收缩刺激引起的葡萄糖转运是完全被钙离子依赖机制所调节的。碱性pH能导致钙离子从骨骼肌肌浆网中释放,肌质、肌浆中的钙离子浓度的提高能够刺激葡萄糖在骨骼肌中的转运。
3)钒酸盐对葡萄糖在肌肉中新陈代谢的作用为胰岛素象的,而钨和硒盐刺激的葡萄糖转运是非胰岛素象的,可能为对毒性或渗透压的非特异性反应。锂增加葡萄糖转运对刺激的敏感性能并不局限于胰岛素,锂也能增加葡萄糖转运对收缩活动、低氧状态、佛波醇酯类和磷脂酶C等刺激的敏感性。锂对葡萄糖在骨骼肌中的转运和新陈代谢的功效与持久的体育锻炼的作用非常相似。
4)流通的雌二醇和孕酮在服药期间降低了对低氧锻炼的葡萄糖和乳酸盐反应。规律的运动训练能够防止老鼠的由GH导致的胰岛素抵抗副作用[32]。糖朊和低氧状态被刺激的葡萄糖转运活动之间有一个相反关系,糖朊抑制低氧状态的葡萄糖转运。在锻炼训练后,胰岛素和低氧状态被刺激的葡萄糖转运活动上的变化完全由细胞表GLUT-4决定。最后,推论锻炼训练造成肌肉糖朊高水平使低氧状态被刺激的葡萄糖转运活动的降低。GLUT4在心肌的基因表达可以由与低氧状态相结合的锻炼训练而显著增强。人体心肌在有高度的低氧状态下葡萄糖的摄取量增加。
[1]Assimacopoulos-Jeannet F,Cusin I,Greco-Perotto RM,et al.Glucose transporters:structure,function,and regulation[J].Biochimie,1991,73(1):67 -70.
[2]Rodnick KJ,Henriksen EJ,James DE,et al.Exercise training,glucose transporters,and glucose transport in rat skeletal[J].Am J Physiol,1992,262(1 Pt 1):C9 -14.
[3]Rodnick KJ,Slot JW,Studelska DR,et al.Immunocytochemical and biochemical studies of GLUT4 in rat skeletal muscle[J].J Biol Chem,1992,267(9):6278 -85.
[4]Zorzano A,Palacín M,Gumà A.Mechanisms regulating GLUT4 glucose transporter expression and glucose transport in skeletal muscle[J].Acta Physiol Scand,2005,183(1):43 -58.
[5]Holmes B,Dohm GL.Regulation of GLUT4 gene expression during exercise[J].Med Sci Sports Exerc,2004,36(7):1202 - 1206.
[6]Wallberg-Henriksson H,Zierath JR.GLUT4:a key player regulating glucose homeostasis?Insights from transgenic and knockout mice(review)[J].Mol Membr Biol,2001,18(3):205 -211.
[7]Brozinick JT Jr,McCoid SC,Reynolds TH,et al.Regulation of cell surface GLUT4 in skeletal muscle of transgenic mice[J].Biochem J,1997,321(Pt 1):75 -81.
[8]Fujiwara R,Nakai T.Effect of glucose,insulin,and insulin-like growth factor-I on glucose transport activity in cultured rat vascular smooth muscle cells[J].Atherosclerosis,1996,127(1):49 -57.
[9]Wheeler TJ,Cole D,Hauck MA.Characterization of glucose transport activity reconstituted from heart and other tissues[J].Biochim Biophys Acta,1998,1414(1 -2):217 -230.
[10]Zierath JR,Tsao TS,Stenbit AE.Restoration of hypoxia–simulated glucose uptake in GLUT4-deficient muscles by muscle-specific GLUT4 transgenic complementation[J].J Bio Chem,1998,273(33):20910-20915.
[11] Ismail-Beigi F.Metabolic regulation of glucose transport[J].J Membr Biol,1993,135(1):1 -10.
[12]Kraegen EW,Sowden JA,Halstead MB,et al.Glucose transporters and in vivo glucose uptake in skeletal and cardiac muscle:fasting,insulin stimulation and immunoisolation studies of GLUT1 and GLUT4[J].Biochem J,1993,295(Pt 1):287 -293.
[13]Terada S,Yokozeki T,Kawanaka T.Effect of high-intensity swimming training on GLUT4 and glucose transport activity in rat skeletal muscle[J].J Apl Physiol,2001,90(6):2019 - 2024.
[14]Cartee GD,Douen AG,Ramlal T,et al.Stimulation of glucose transport in skeletal muscle by hypoxia[J].J Appl Physiol,1991,70(4):1593-1600.
[15]Zhao P,LuY,Feng L,et al.Effect of Hypoxic Training on Glucose Transport and Utilization Ability in Rats[J].China Sport Science,2008,28(7):51 -60.
[16]Fujii N,Jessen N,Goodyear LJ.AMP-activated protein kinase and the regulation of glucose transport[J].Am J Physiol Endocrinol Metab,2006,291(5):E867 -877.
[17]Fisher JS,Gao J,Han DH,et al.Activation of AMP kinase enhances sensitivity of muscle glucose transport to insulin[J].Am J Physiol Endocrinol Metab.2002 Jan;282(1):E18 -23.
[18]Deshmukh AS,Glund S,Tom RZ,et al.Role of the AMPKgamma3 isoform in hypoxia-stimulated glucose transport in glycolytic skeletal muscle[J].Am J Physiol Endocrinol Metab,2009 ,297(6):E1388-1394.
[19]Hue L,Rider MH.The AMP-activated protein kinase:more than an energy sensor[J].Essays Biochem,2007,43:121 -137.
[20]Wojtaszewski JF,Nielsen JN,J?rgensen SB,et al.Transgenic models-a scientific tool to understand exercise-induced metabolism:the regulatory role of AMPK(5’-AMP-activated protein kinase)in glucose transport and glycogen synthase activity in skeletal muscle[J].Biochem Soc Trans,2003,31(Pt 6):1290 -1294.
[21]Hayashi T,Hirshman MF,Fujii N,et al.Metabolic stress and altered glucose transport:activation of AMP-activated protein kinase as a unifying coupling mechanism[J].Diabetes,2000,49(4):527 -531.
[22]Nielsen JN,J Rgensen SB,Frsig C,et al A possible role for AMP-activated protein kinase in exercise-induced glucose utilization insights from humans and transgenic animals[J].Biochem Soc Trans,2003,31(Pt 1):186 -190.
[23]Sandstrm ME,Zhang SJ,Bruton J,et al.Role of reactive oxygen species in contraction-mediated glucose transport in mouse skeletal muscle[J].J Physiol,2006,575(Pt 1):251 -262.
[24]Katz A.Modulation of glucose transport in skeletal muscle by reactive oxygen species[J].J Appl Physiol,2007,102(4):1671 -1676.
[25]Brozinick JT Jr,Reynolds TH,Dean D,et al.1-[N,O-bis-(5-isoquinolinesulphonyl)-N-methyl-L-tyrosyl]-4-phenylpiperazine(KN-62),an inhibitor of calcium-dependent camodulin protein kinase II,inhibits both insulin-and hypoxia-stimulated glucose transport in skeletal muscle[J].Biochem J,1999,339(Pt 3):533 -540.
[26]Shashkin P,Koshkin A,Langley D,et al.Effects of CGS 9343B(a putative calmodulin antagonist)on isolated skeletal muscle.Dissociation of signalling pathways for insulin-mediated activation of glycogen synthase and hexose transport[J].J Biol Chem,1995,270(43):25613-25618.
[27]Wright DC,Geiger PC,Holloszy JO,et al.Contraction-and hypoxiastimulated glucose transport is mediated by a Ca2+-dependent mechanism in slow-twitch rat soleus muscle[J].Am J Physiol Endocrinol Metab,2005,288(6):E1062 -1066.
[28]Ren JM,Youn JH,Gulve EA,et al.Effects of alkaline pH on the stimulation of glucose transport in rat skeletal muscle[J].Biochim Biophys Acta,1993,1145(2):199 -204.
[29]Fürnsinn C,Englisch R,Ebner K,et al.Insulin-like vs.non-insulin-like stimulation of glucose metabolism by vanadium,tungsten,and selenium compounds in rat muscle[J].Life Sci,1996,59(23):1989-2000.
[30]Tabata I,Schluter J,Gulve EA,et al.Lithium increases susceptibility of muscle glucose transport to stimulation by various agents[J].Diabetes,1994,43(7):903 -907.
[31]Sandoval DA,Matt KS.Effects of the Oral Contraceptive Pill Cycle on Physiological Responses to Hypoxic Exercise[J].High Alt Med Biol.2003 Spring;4(1):61 - 72.
[32] Hou CW,Chou SW,Ho HY,et al.Interactive effect of exercise training and growth hormone administration on glucose tolerance and muscle GLUT4 protein expression in rats[J].J Biomed Sci,2003,10(6 Pt 2):689-696.
[33]Reynolds TH IV,Brozinick JT Jr,Rogers MA,et al.Mechanism of hypoxia-stimulated glucose transport in rat skeletal muscle:potential role of glycogen[J].Am J Physiol,1998,274(5 Pt 1):E773 -778.
[34]Reynolds TH IV,Brozinick JT Jr,Rogers MA,et al.Effects of exercise training on glucose transport and cell surface GLUT-4 in isolated rat epitrochlearis muscle[J].Am J Physiol,1997,272(2 Pt 1):E320-325.
[35]Chou SW,Chiu LL,Cho YM,et al.Effect of systemic hypoxia on GLUT4 protein expression in exercised rat heart[J].Jpn J Physiol,2004,54(4):357 -363.
[36]Chen CH,Liu YF,Lee SD,et al.Altitude hypoxia increases glucose uptake in human heart[J].High Alt Med Biol,2009,10(1):83 -86.
Factors of Glucose Transport in Skeletal Muscles
CHEN Song
(Department of P.E.,Northeastern University,Shenyang 110004,Liaoning,China)
Published literature reported that glucose transport in skeletal muscles was mainly mediated and controlled by Glucose transporter type 4(Glut-4).There are three major factors affecting glucose transport in muscles.They are insulin,exercise or muscle contraction and hypoxia.Many other factors can affect glucose transport in skeletal and heart muscle as well,such as multi kinases,calcium,hormones,glycogen,medicines and food etc.This article mainly reviews these types of published papers and especially discusses the increasing or decreasing effect of AMPK,Calcium and Lithium,female hormone,and growth hormone and glycogen on glucose transport in skeletal and heart muscles.
glucose transport;hypoxia;exercise training;insulin;skeletal muscle;heart muscle
G804.21
A
1004-0560(2012)05-0080-05
2012-03-06;
2012-04-08
国家科技攻关计划项目:青少年户外运动健身方案及应用研究(2009Bak62B02-011)。
陈 松(1963-),男,副教授,博士,主要研究方向为体育教育与运动训练。
责任编辑:乔艳春

