RSM 法优化提取槟榔中槟榔碱及其抑菌活性研究
刘文杰,孙爱东
(北京林业大学 生物科学与技术学院,北京 100083)
槟榔 (Areca catechu Linn)为棕榈科槟榔属植物,主产于我国海南、广东、广西、云南、福建和台湾等地以及印度和马来西亚等国,是我国4 大南药之一[1]。
响应面分析法 (response surface methodology,RSM)是利用合理的试验设计,采用多元二次回归方程拟合因素与响应值之间的函数关系,通过对回归方程的分析来寻求最佳工艺参数,解决多变量问题的一种统计方法。它与过去广为使用的正交试验设计法不同,具有试验周期短,求得的回归方程精度高,能研究几种因素间交互作用等优点。在单因素试验的基础上,利用响应面分析法对槟榔中槟榔碱提取工艺进行优化[2]。
抑菌圈法又称琼脂平板法或药剂扩散法,是指化合物通过介质渗透扩散,施药部位周围的病菌被杀死,或生长受到限制,从而产生了抑菌圈或透明圈。抑菌圈和化合物浓度之间,在一定范围内呈函数关系,通过测定抑菌圈的大小,可以比较抗菌化合物活性的大小。
1 材料与方法
1.1 原料与试剂
槟榔果原料来自海南,取槟榔壳70℃烘干至恒重后,粉碎过80 目 (0.177 mm)筛,即为槟榔原料;氢溴酸槟榔碱标准品,九州同业公司;溴甲酚绿,分析纯,天津津科精细化工研究所;氢氧化钾、无水硫酸钠,分析纯,西陇化工股份公司;无水乙醇、乙酸、浓氨水、乙酸钠、氯仿,分析纯,北京化工厂;甲醇,色谱纯。
牛肉膏蛋白胨培养基[3](用于细菌培养):牛肉膏3 g,蛋白胨10 g,NaCl 5 g,水1 000 mL,pH 值7.4~7.6。
马铃薯培养基 (PDA) (用于霉菌和酵母菌培养):马铃薯 (去皮)200 g,蔗糖 (或葡萄糖)20 g,水1 000 mL。
半固体素琼脂 (用于细菌转导):琼脂1 g,水100 mL,121℃湿热灭菌30 min。
1.2 主要仪器
JAC-600 超声波中药处理机 (山东济宁超声电器有限公司);旋转蒸发器RE252AA (上海亚荣生化仪器厂);SP22100UV 型紫外可见分光光度计(上海光谱仪器有限公司);DK29821 型电热恒温水浴锅 (天津市泰斯特仪器有限公司);DF204 电热鼓风干燥箱 (北京西城区医疗器械二厂)。
1.3 试验方法
1.3.1 槟榔碱的提取
参照文献[4],称量粉碎的槟榔原料10.00 g,在200 mL 的三角瓶中注入85%乙醇溶液,搅拌摇匀,在频率为40 kHz、超声功率300 W 条件下进行超声波辅助提取30 min,重复3 次,回收乙醇。将提取物浓缩至浸膏后,用氨水调整pH 值至9,得到碱性提取液,加入氯仿萃取3 次,合并浸提液,然后减压将浸提液浓缩至乙醇含量的20%,静置过夜,滤除沉淀得到滤液,减压浓缩后得到槟榔生物碱提取物。
1.3.2 槟榔碱含量的测定方法
本实验采用溴甲酚绿光度法测定槟榔碱的含量,利用在一定pH 值下,生物碱阳离子和酸性染料阴离子定量结合生成有色络合物,此络合物的离子对可以定量被某种有机溶剂萃取,根据这一原理通过测萃取液吸光度来测总生物碱含量[5]。
1.3.3 槟榔碱抑菌活性的测定方法
本实验采用平板打孔法[6-7]研究槟榔碱的抑菌活性,并用涂布和混和平板2种方法接入菌种,以抑菌圈大小作为槟榔碱抑菌活性的指标。
涂布法。将配制好的固体培养基融化灭菌后,倒成约4 mm 厚的平板,待凝固后取100 μL 菌悬液置于培养基上,用玻璃涂布棒将菌悬液涂布均匀,制成带菌平板。
混合平板法。取100 μL 菌悬液置于无菌平皿中,于上述盛有菌液的培养皿中倒入融化灭菌后并冷却至45℃左右的相应培养基迅速摇匀,置水平位置凝固,制成带菌平板。用灭过菌的直径为6 mm 的打孔器等间距打4个孔,其中3个孔注入0.1 g·mL-1的氢溴酸槟榔碱溶液100 μL,另外一个孔注入无菌水作对照。
将细菌于37℃恒温培养24 h,酵母菌和霉菌于28℃恒温培养48 h,观察菌落生长情况,采用十字交叉法测定抑菌圈2个垂直方向的直径大小,取其平均值 (mm),以抑菌圈直径作为槟榔碱抑菌活性指标,直径越大抑菌活性越强。每项抑菌试验均平行重复3 次,取其平均值作为试验结果。
1.3.4 最低抑菌浓度 (MIC)的测定
最低抑菌浓度 (minimal inhibitory concentration,MIC)是指用无菌水配制成一系列不同稀释度的样品,制成平板后,向每一稀释度药物接种等量的供试菌,培养后观察生长情况,能抑制细菌生长的最低浓度即为该样品的最小抑菌浓度。MIC 是判断抗菌活性的最重要的指标[8]。
MIC 的测定采用二倍稀释平板法。用无菌水将槟榔提取物逐级稀释成 200.000,100.000,50.000,25.000,12.500,6.250 和3.125 mg ·mL-1等系列浓度,其余步骤均同抑菌活性实验,每项抑菌试验均重复3 次,细菌置于37℃培养24 h,真菌于28℃培养48 h 后观察结果。完全不生长菌平板的最低样品浓度即为最低抑菌浓度。
2 结果与分析
2.1 单因素实验
在其他提取因素不变的情况下,分别乙醇浓度、料液比、超声时间、碱化pH 值4个对槟榔碱提取影响较大的因素进行单因素实验,根据单因素实验确定最佳乙醇浓度为78%,料液比1 ∶13,超声时间25 min,碱化pH 值8。
2.2 响应面分析法优化工艺
2.2.1 响应面分析因素水平的选取
根据Box-Benhnken 的中心组合试验设计原理,综合单因素影响试验结果,选取乙醇浓度 (X4)、料液比 (X3,m/V)、超声时间 (X1)、碱化pH 值(X2)对槟榔碱提取影响显著的4个因素,在单因素试验的基础上采用4 因素3 水平的响应面分析方法,分析因素的-1,0,1 水平,X1分别为20,30,40 min;X2分别为7,8,9;X3分别为1∶12,1∶14,1∶16;X4分别为65%,75%,85%。
2.2.2 响应面试验设计及结果
选用了中心复合模型,做4 因素3 水平共29个实验点 (5个中心点)的响应面分析实验[9]。这29个实验点 (表1)可分为2 类:其一是析因点,自变量取值在各因素所构成的三维顶点,共有24个析因点;其二是零点,为区域的中心点,零点实验重复5 次,用以估计实验误差。槟榔中槟榔碱提取率为响应值 (指标值)。
采用Design Expert7.0 软件对试验数据进行回归分析[10],由此可求出影响因素的一次效应、二次效应及其交互效应的关联方程,对超声波辅助提取槟榔中槟榔碱的影响因素进行更深入的研究和条件优化,并作出响应面图 (图1-6)。
应用Design Expert 7.0 软件进行分析,得到槟榔中槟榔碱提取率与各因素变量的二次方程模型。槟榔碱提取率与各因素变量的二次方程模型为:
Y=0.34-5.667×10-3X1+0.028X2-8.750×10-3X3-7.500× 10-4X4-0.026X1X2+1.500×10-3X1X3+0.015X1X4+5.000× 10-4X2X3+3.500×10-3X2X4-5.750×10-3X3X4-0.056X21-
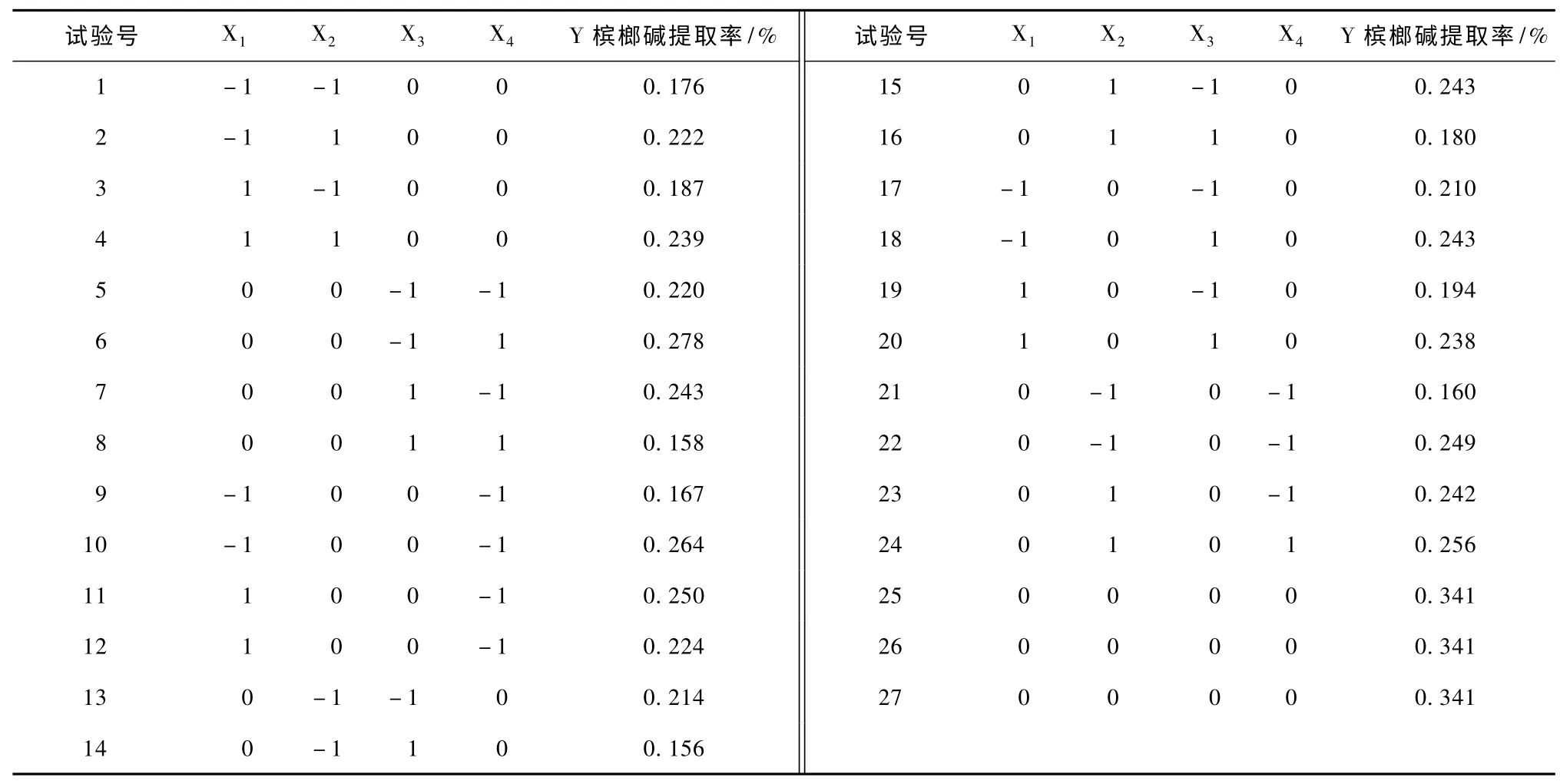
表1 响应面分析实验方案及实验结果

图1 Y=f (X1,X2)的响应面

图2 Y=f (X1,X3)的响应面

图3 Y=f (X1,X4)的响应面

图4 Y=f (X2,X3)的响应面

图5 Y=f (X2,X4)的响应面

图6 Y=f (X3,X4)的响应面
2.2.3 方差分析和回归方程
回归方程各项的方差分析见表2。
从表3 可以得出,用上述回归方程描述各因素与响应值之间的关系时,Quadratic 回归方差模型是高度显著的,其因变量和全体自变量之间的线性关系显著,模型的显著水平远远小于0.05。从回归方程各项的方差分析结果还可以看出方程的失拟项较小,表明该方程对试验拟合情况好,试验误差小,因此可用该回归方程代替试验真实点对实验结果进行分析和预测[11]。从表2 还可以看出,对提取率影响的大小依次为碱化pH 值X2、超声时间X1、料液比X3、乙醇浓度X4。

表2 回归方程方差分析结果
2.2.4 试验验证
为了检测试验结果是否与真实情况相一致,根据上述试验结果进行了近似验证试验,考虑到实际操作的便利,将最佳工艺条件修正为:室温下,超声功率600 W,乙醇浓度81%,料液比为1∶13,提取时间为25 min,碱化pH 值为8.3,槟榔碱平均含量0.341%。与理论预测值相比,其相对误差约为0.01%。而且重复性也很好,说明优化结果可靠。
2.3 抑菌圈测定结果
表3 可见,氢溴酸槟榔碱对常见细菌均具有抑制作用,其中对金黄色葡萄球菌的抑制作用最强,但对真菌无抑制作用,实验中均未有明显的抑制生长作用。另外,涂布法测量出的抑菌圈直径均大于混合菌液法,可见抑菌圈测量中使用不同方法得到的结果不相同。对槟榔碱的抑制作用最敏感的3种细菌涂布法抑菌圈及混合菌液法结果分别见图7 和图8。
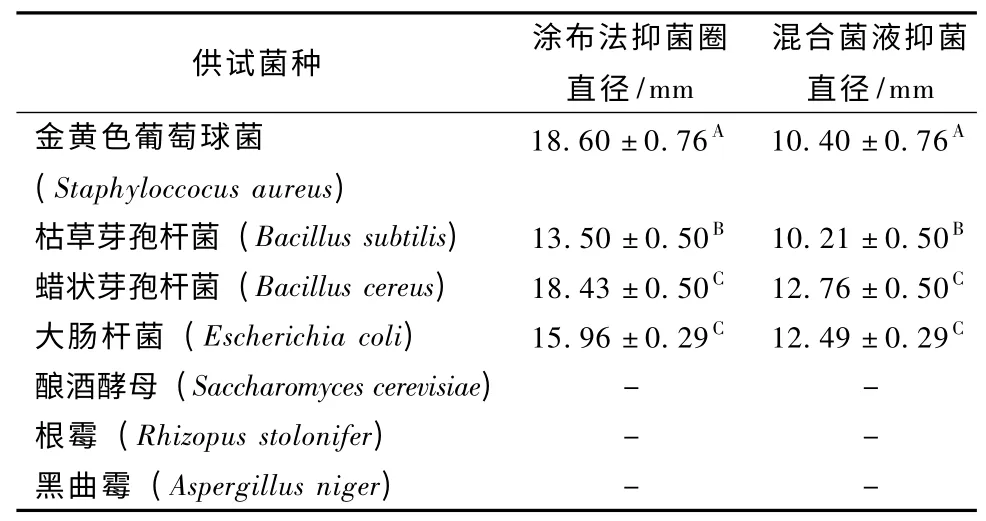
表3 抑菌圈实验结果
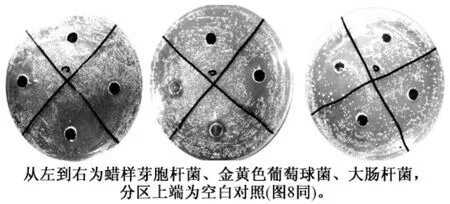
图7 涂布法抑菌结果
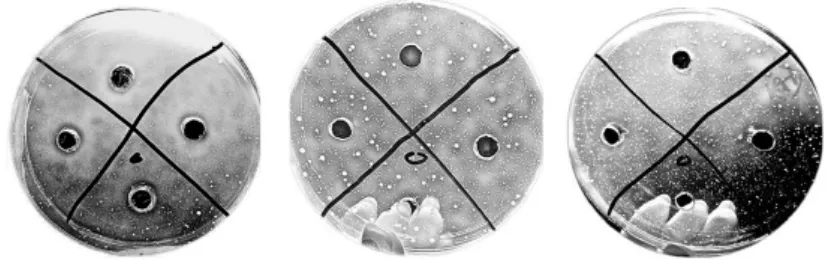
图8 混合菌液法抑菌结果
由图7,8 还可以看出,槟榔提取物对供试的革兰氏阳性细菌 (G+)和革兰氏阴性细菌(G-)都有非常明显的抑制作用,而对真菌完全无抑制作用。
2.4 最小抑菌浓度的测定 (MIC)
通过抑菌圈观察槟榔提取物的抑菌效果后,测定槟榔提取物的MIC[12],定量分析槟榔碱的抑菌能力 (表4)。
由表4 可知,槟榔提取物对金黄色葡萄球菌和枯草芽孢杆菌有很强的抑制作用。增加提取物浓度,其抑菌活性明显增高。槟榔提取物对金黄色葡萄球菌和枯草芽孢杆菌的最小抑菌浓度分别为12.50 和6.25 mg·mL-1;槟榔提取物对蜡状芽孢杆菌和大肠杆菌的最小抑菌浓度均为25.00 mg·mL-1,抑制作用相对较弱。

表4 槟榔提取物对4种细菌MIC 的测定结果
3 小结
利用响应面分析法 (RSM)对超声波辅助提取槟榔碱工艺进行了优化,得出最优方案为超声功率600 W,乙醇浓度81%,料液比为1 ∶13,提取时间为25 min,碱化pH 值为8.3,用此方法提取槟榔碱平均含量为0.341%。
利用平板打孔法研究槟榔碱提取物对食品中常见的4种细菌和3种真菌的抑制作用。实验结果表明,槟榔提取物对金黄色葡萄球菌和枯草芽孢杆菌的最小抑菌浓度分别为12.50 和6.25 mg·mL-1,对蜡状芽孢杆菌和大肠杆菌的最小抑菌浓度均为25.00 mg·mL-1,对酿酒酵母、黑曲霉、根霉这3种真菌没有抑制作用。槟榔提取物对供试的革兰氏阳性细菌 (G+)和革兰氏阴性细菌 (G-)都有非常明显的抑制作用,而对真菌完全无抑制作用,说明其在开发益齿抗菌产品上有巨大潜力。这些研究为槟榔的综合利用以及防牙护齿产品的开发提供了一定的理论依据。
[1]全国中草药汇编编写组.全国中草药汇编 (上册) [M].北京:人民卫生出版社,1978:898.
[2]陈鹏.东南亚的槟榔[M].世界民族,1996 (1):66-69.
[3]陈良秋,万玲.我国引种槟榔时间及其它[M].中国农村小康科技,2007 (2),4-50.
[4]何和明,梁学琛,符气浩.槟榔生物学和生态特性的研究[J],海南大学学报:自然科学版,1995,15 (3):216-220.
[5]何和明.海南岛槟榔开花习性、花粉特征及花器生理脱落的原因[J].蜜蜂杂志,2005 (3).9-10.
[6]何昌浩,夏国谨,李桂玲.槟榔碱与灭螺药物合用的增效作用研究 [J].中国血吸虫病防治杂志,1999,11(4):215.
[7]宋立人.现代中药学大辞典[M].北京:人民卫生出版社,2001:2305-2306.
[8]周文化,李忠海,张海德.不同槟榔果常规营养成分和槟榔碱含量分析[J].食品与机械,2009,25 (3):27-30.
[9]李时珍 (明).本草纲目[M].北京:中国档案出版社,1999:1412-1416.
[10]郑锦星.槟榔提取物功能评价的研究[D].长沙:中南林业科技大学硕士学位论文,2007.
[11]刘家福.食品词典[M].上海:上海辞书出版社,1991:536-537.
[12]陈潮燕.槟榔碱的提取分离对胃肠道平滑肌收缩作用的影响[J].广东药学,2000,10 (2):48-50.

