微生物转化在天然产物研究中的应用
刘庆鑫,李慧梁,柳润辉
(1.福建中医药大学药学系,福建 福州 350108, 2.第二军医大学药学院天然药物化学教研室,上海 200433)
·综述·
微生物转化在天然产物研究中的应用
刘庆鑫1,李慧梁2,柳润辉2
(1.福建中医药大学药学系,福建 福州 350108, 2.第二军医大学药学院天然药物化学教研室,上海 200433)
随着生物科学技术的不断发展,微生物转化逐渐应用于天然产物的研究中。本文简介了微生物转化反应的专一有效、反应条件温和、收率高等特点,对近5年来微生物转化在天然产物研究中的应用进行了综述,重点综述了微生物对蒽醌类、黄酮类、萜类、甾体类、生物碱类和苷类化合物的生物转化,并对其发展前景进行了展望。
微生物转化;天然产物研究;应用
1 概述
微生物转化是指某一微生物将一种物质(底物)转化成为另一种物质(产物)的过程,这一过程是由此种微生物产生的一种或者几种特殊的胞内或胞外酶作为生物催化剂来进行的一种或者几种化学反应,简而言之,即为一种利用微生物酶或者微生物本身来进行的合成技术。这些具有生物催化剂作用的酶大多数对微生物的生命过程也是必需的,但是在微生物转化的过程中,这些酶仅作为生物催化剂作用于化学反应。由于微生物所产生的大多数生物催化剂不仅可以催化自身的底物和其类似物,且有时还对外源添加的底物也具有催化作用,因而微生物转化也可以认为是有机化学反应中的一个特殊分支[1]。与酶转化和悬浮细胞转化相比,微生物转化操作更简易,有利于大规模工业生产。
2 微生物转化的特点
2.1反应专一有效 微生物转化不需要添加其它的催化剂,只需先培养出大量的微生物菌种,然后加入底物进行单一的催化反应。此催化反应可以多次重复。它可以完成某些有机合成难以实现或者不可能实现的反应,所以微生物转化法比化学试剂的反应法更专一、更有效。
2.2反应条件温和 微生物转化反应一般都是在常温和pH为7左右的条件下进行催化反应,不需要高温、高压等苛刻的条件。设备的运行操作也比较简单、安全,产生的公害较少,一般不会造成环境污染,后处理也相对简单。
2.3筛选不同的菌种与优化反应条件可提高转化率 对同一底物进行微生物转化的菌种可能有多种,通过筛选选出最佳菌种,可以保证较高的转化率。微生物转化底物的过程中易受到底物浓度、温度和反应时间等影响。郭继强等[2]利用正交实验设计法,对喜树碱的生物转化菌种及反应条件进行优化研究,最终发现假单胞菌Blx在转化时间60 h、温度28 ℃、浓度为0.1 g/L、pH为6.5时,菌种具有最高转化率19.1%。
3 微生物转化在天然产物中的应用
上个世纪50年代,美国Upjohn公司的Murray和Peterson成功地使用黑根霉(Rhizopusnigricans)一步在孕酮11位上导入一个α羟基,使用孕酮合成皮质酮仅需3步,且收率高达90%,可的松从而问世,使体内各类微量的甾体激素成为临床治疗药物,是工业化生物转化的重要里程碑[3],如图1。他们还利用紫罗兰梨头霉(Tieghemellaorchidis)在氢化可的松前体RSA (17α-羟基孕甾-4-烯-3, 20-二酮-21-醋酸酯)中导入11β-羟基。这些特异性的微生物转化反应为其在医药领域中的应用奠定了基础。

图1 孕酮的微生物转化
微生物转化的反应条件温和、高选择性等特点已经倍受天然产物学家的关注。迄今为止,已发现的可由微生物转化作用完成的反应有氧化、还原、水解、裂解、降解等多种反应[4],在天然产物中的应用也十分广泛。在醌类、黄酮类、萜类、甾体类、生物碱类和苷类化合物都有很深入的研究。
3.1醌类化合物的微生物转化 张薇等[5]利用刺囊毛霉对大黄中的大黄酚、大黄素和大黄素甲醚进行微生物转化,共得到4个转化产物,如图2,主要以糖苷化和甲基化反应为主。在大黄药材中结合型蒽醌衍生物主导泻下作用。大黄经酒精酵母、面包酵母转化后,总蒽醌和结合型蒽醌的含量略有降低,游离型蒽醌含量增加约6倍,缓和了大黄的泻下作用和对胃肠道的刺激,可见微生物转化可应用于大黄药材的炮制中[6]。

图2 大黄酚、大黄素和大黄素甲醚的微生物转化
3.2黄酮类化合物的微生物转化 槲皮素是典型的黄酮类化合物,具有较好的祛痰、止咳、平喘等作用。近几年的研究表明,槲皮素是已知的最强抗癌剂之一 ,在治疗肿瘤疾病上的需求量很大,因此开发槲皮素具有良好的市场前景[7]。利用灰色链霉菌对芦丁进行微生物转化,分离鉴定了6个代谢产物,除了槲皮素还有槲皮素-3-O-β-D-葡萄糖苷、山柰酚-3-β-D-芸香糖苷、异鼠李素、异鼠李素-3-O-葡萄糖苷和山柰酚,此转化过程涉及到糖苷水解、甲基化和去羟基化反应,共3类反应。后经研究发现,利用黑曲霉可将槐米中的芦丁转化为槲皮素,如图3,且转化所得的槲皮素纯度较高[8~10],具有转化为工业生产的应用价值。
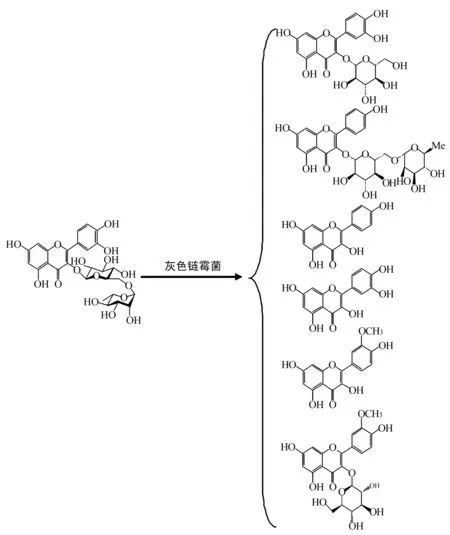
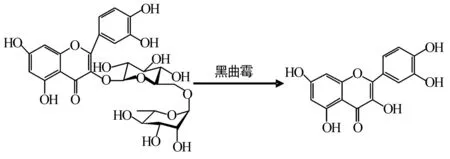
图3 芦丁的微生物转化
此外,杨莉萍等[11]发现采用融粘帚霉AS3.3987对葛根素进行微生物转化,生成的主要产物是3-羟基葛根素,其得率最高为93.2 mg/g葛根素。汪红等[12]筛选到一株菌株HQ-10,可以将黄芩作为底物,通过产生葡萄糖醛酸酶发酵将黄芩中的黄芩苷转化为黄芩素,且黄芩苷转化率近于92%。
3.3萜类化合物的微生物转化 微生物转化在萜类化合物的相关研究中应用的比较多,如青蒿素。青蒿素是我国科学研究者首次从黄花蒿叶中提取分离得到的一个具有过氧桥的倍半萜类化合物,具有高效低毒的抗疟活性,尤其是对具有抗氯喹能力的脑疟和急性疟有效。陈有根和余伯阳利用微生物Streptomycesgriseus(ATCC-13273)对青蒿素进行转化,得到一个新化合物9α-羟基青蒿素,体外抗疟实验表明该化合物具有抗恶性疟原虫FCC/HN的活性[13]。后续的研究发现,华根霉、雅致小克银汉霉、刺孢小克银汉霉、黑曲霉和毛霉对青蒿素也有不同的转化[14,15]。
此外,还有许多其他萜类化合物的微生物转化研究。如可利用新月弯孢霉KA-9或者刺囊毛霉AS3.345对甘草次酸进行微生物转化,获得化合物7β-羟基甘草次酸,如图4[16~18];占纪勋等[19]利用铜绿假单孢菌AS1.860对紫杉醇进行微生物转化,获得3个化合物,如图5;李合平等[20]从土壤中分离得到的变形斑沙雷菌对穿心莲内酯有较好的转化活性,如图6,转化率约70%;雅致小克银汉霉除了对青蒿素有转化活性,对黄柏酮同样有良好的转化活性[21]。
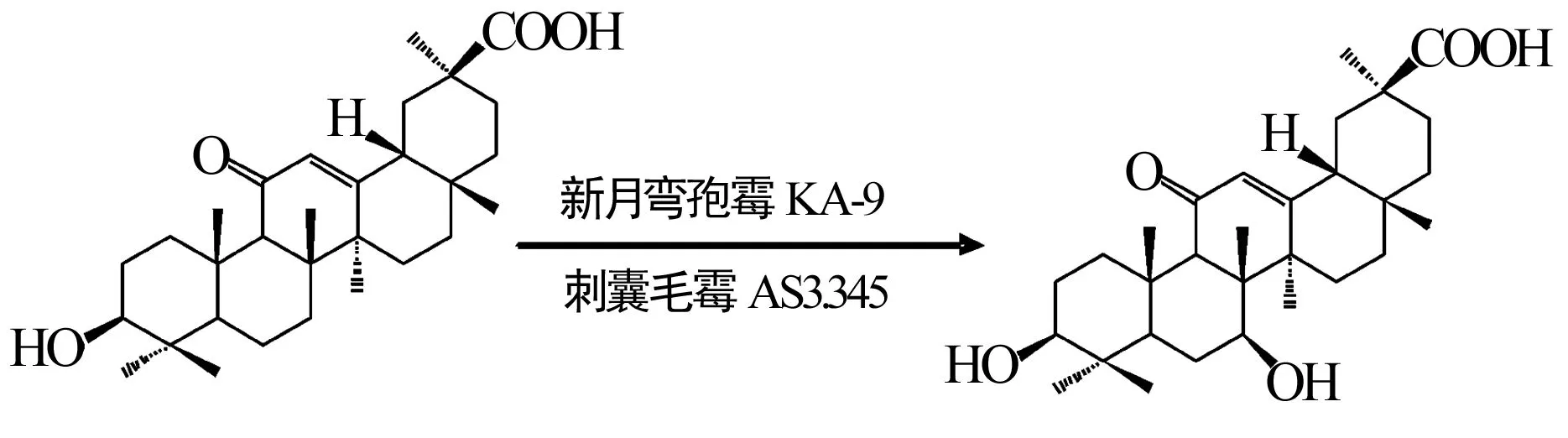
图4 甘草次酸的微生物转化

图5 铜绿假单孢菌AS1.860对紫杉醇的微生物转化

图6 穿心莲内酯的微生物转化
3.4甾体类化合物的微生物转化 李于善和贺艳[22]将从三峡白首乌中分离得到的C21甾苷元告达庭甾苷元和开德甾苷元作为底物,利用黑根霉与赭曲霉在水-正丁醇的双相体系中,转化得到C11α-羟基化的C21甾苷元告达庭苷元和开德苷元,转化率达74.1%如图7。近些年的研究发现,利用菌株MycobacteriumHCCB006能够将甾醇类化合物转化为雄甾-1,4-二烯-3,17-二酮(ADD)[23,24],而ADD则是合成甾体药物的重要前体化合物。这一研究的发现为天然产物转化为重要的前体化合物提供了理论依据。

图7 告达庭甾苷元的微生物转化
3.5生物碱类化合物的微生物转化 喜树碱和10-羟基喜树碱是从喜树中分离的天然抗肿瘤活性成分。10-羟基喜树碱比喜树碱的抗肿瘤效果更好、毒性更低,因此在全球市场上成为继紫杉醇之后第2个获准上市的具有抗癌活性的天然产物,并日益成为喜树碱类衍生物研究的重要中间体。但由于10-羟基喜树碱在喜树的种子内含量极低,科研人员一直在寻求有效的方法对喜树碱进行结构上的修饰和改造,以获得活性更好的10-羟基喜树碱。近期的研究发现 ,采用假单胞菌Bl、毛霉和禾谷镰刀菌均可以将喜树碱转化为10-羟基喜树碱,如图8,为喜树碱的衍生物合成开辟了新的途径[2,25]。

图8 喜树碱的微生物转化
本教研室近几年也着眼于甾体生物碱的微生物转化,藜芦生物碱具有良好的抗肿瘤活性,因而越来越受到世人的关注。通过刺孢小克银汉霉对vermitaline进行生物转化,共获得4个新化合物,如图9[26]。
3.6苷类化合物的微生物转化 大多数的天然产物均可与糖或者糖的衍生物形成苷,酸碱水解可打断糖苷键生成苷元但不适用于结构不稳定的苷类化合物。而微生物转化反应条件温和,适于对苷类化合物的水解。由于人参皂苷具有良好的药理活性而备受关注,对它的微生物转化研究也相对较多。以人参皂苷Rb1为例,经青霉属菌株GH-9转化可生成人参皂苷C-K,此产物具有抑制癌细胞生长以及抗癌细胞转移的作用,是一种具有良好开发前景的抗癌药物成分;经GY-06转化可以生成Rd和Rg3;从中国广东产的橙子中分离到的菌株CZ2对人参皂苷Rb1具有较好的生物转化活性,可将其转化为稀有的次级人参皂苷F2,人参皂苷F2对肺癌SPC-A-l以及胃癌SGC-7901细胞均具有一定的抑制作用,如图10和表1[27~29]。除了对人参皂苷的研究外,还有很多其他苷类化合物的研究。田天丽等[30]从中药虎杖中筛选出根霉菌株T-34,利用该菌株能将虎杖苷转化为白藜芦醇,且转化率高达98%,而白藜芦醇具有良好的抗心血管疾病和抗癌的功效。研究发现青霉Penicilliumnigricans可将京尼平苷转化为具有抗肝硬化、抗炎、抗脂质过氧化等活性的京尼平,且转化率高达95%以上[31]。

图9 vermitaline的微生物转化
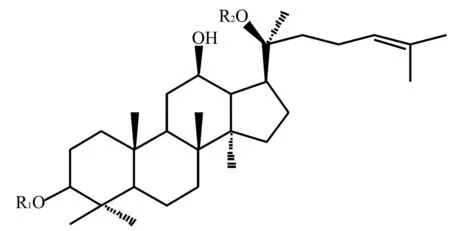
图10 人参皂苷Rb1、C-K、Rd、Rg3和F2的结构

人参皂苷R1R2Rb1-Glc2-1Glc-Glc6-1GlcC-K-H-GlcRd-Glc2-1Glc-GlcRg3-Glc2-1Glc-HF2-Glc-Glc
这些天然产物转化反应的机制都已经基本上进行过深入研究,其中许多相关的酶己经被分离纯化,国外已经开始把微生物转化或其中的酶作为高效催化工具来使用,并且对此进行了广泛而深入的科学研究。
4 微生物转化研究的未来展望
微生物转化在天然产物中的应用不仅仅局限于以上几个方面,在现代社会其工业化的发展具有极大的潜力。随着现代生物技术以及基因工程技术的飞速发展,利用诱变筛选新菌种或者改建基因生成新的工程菌,可以使微生物转化在医药工业生产的应用中目的更加明确、方法更加简单。我国天然产物资源丰富,拥有良好的研究基础。且天然产物大多为分子结构相对复杂的有机化合物,将微生物转化技术引入到天然产物的研究中,包括资源开发、药物设计和新的活性先导化合物的发现与筛选等各个环节,从而开发出拥有自主知识产权、并具有中国特色的创新药物。
[1] 陈代杰. 生物转化与药物开发[J]. 医药化工, 2005,9(9): 1.
[2] 郭继强, 朱殿生, 谭 慧,等. 假单胞菌转化喜树碱的初步研究[J]. 食品科技, 2010, 35(1): 42.
[3] Peterson D, Murray H,Eppstein S.etal, Microbiological Transformations of Steroids. 1 I. Introduction of Oxygen at Carbon-11 of Progesterone[J]. Journal of the American Chemical Society, 1952, 74 (23): 5933.
[4] 吴梧桐, 丁锡申, 刘景晶. 基因工程药物: 基础与临床[M].北京:人民卫生出版社, 1996:183.
[5] 张 薇, 占纪勋, 陈英杰, 等. 刺囊毛霉对三种大黄游离蒽醌的生物转化研究[J]. 中国天然药物, 2003, 1(4): 219.
[6] 戴万生, 赵荣华. 发酵法对大黄蒽醌类成分含量的影响[J]. 云南中医中药杂志, 2005, 26(1): 38.
[7] Jakubowicz-Gil J, Paduch R, Gawron A,etal. The effect of heat shock, cisplatin, etoposide and quercetin on Hsp27 expression in human normal and tumour cells[J]. Folia Histochem Cytobiol, 2002, 40(1): 31.
[8] 王园园, 余伯阳, 李 里, 等. 灰色链霉菌对芦丁的生物转化及产物的抗氧化活性[J]. 中国天然药物, 2006, 4(1): 66.
[9] 徐萌萌, 沈 竞, 徐 春, 等. 槐米固态发酵提高槲皮素含量的研究[J]. 时珍国医国药, 2008, 19(3): 704.
[10] 高 陪, 苏 建, 沈 竞, 等. 微生物发酵转化芦丁制备槲皮素的研究[J]. 四川大学学报(自然科学版), 2010, 47(6): 1429.
[11] 杨莉萍, 崔志超, 高 芳, 等. 融粘帚霉对葛根素的生物转化研究[J]. 工业微生物, 2011, 41(2): 47.
[12] 汪 红, 高 陪, 廖 勇, 等. 微生物发酵转化黄芩苷生成黄芩素的研究[J]. 四川大学学报(自然科学版), 2009, 46(3): 795.
[13] 陈有根, 余伯阳. 微生物转化青蒿素为9α-羟基青蒿素的条件优化[J]. 药物生物技术, 2001, 8(2): 90.
[14] 占纪勋, 魏秋芬, 单成启, 等. 四个青蒿素生物转化产物抗体外培养恶性疟原虫滑陛研究[J]. 中国热带医学, 2003, 3(1): 17.
[15] Zhan JX, Guo HZ, Han J,etal. Biotransformation of artemisinin by fermentation of Rhizopus chinensis and Curminghamell elegans[J]. Chinese Traditional Herbal Drugs, 2002, 33 (10): 869.
[16] 和朝军, 孙 华, 李鹏举, 等. 新月弯孢霉KA-9l对甘草次酸的转化研究[J]. 药物生物技术, 2011, 18(3): 238.
[17] 马 晶, 辛秀兰, 张 薇, 等. 刺囊毛霉对甘草次酸的微生物转化研究[J]. 北京化工大学学报,2008,35(1):79.
[18] 马 晶, 辛秀兰, 袁其朋, 等. HPLC法测定刺囊毛霉微生物转化甘草次酸的主产物含量[J]. 微生物学通报, 2008, 35(10): l664.
[19] 占纪勋, 张元兴, 宁黎丽, 等. 铜绿假单孢菌AS1.860对紫杉醇的微生物转化[J]. 应用与环境生物学报, 2003, 9(4): 429.
[20] 李合平, 许东升, 徐海伟, 等. 微生物转化法制备脱水穿心莲内酯[J]. 中国药科大学学报, 2008, 39(5): 479.
[21] 杨若林, 郑桂兰, 张荣庆. 黄柏酮微生物转化研究[J]. 中草药, 2007, 38 (10): 1471.
[22] 李于善, 贺 艳. 白首乌甾苷元C11α-羟基化的两种微生物转化[J]. 化学与生物工程, 2008, 25(7): 48.
[23] 姜绍通, 赵俊平, 杨 英, 等. 两相系统发酵转化植物甾醇为雄烯二酮的研究[J]. 食品与发酵工业, 2008, 34(6): 46.
[24] 郝雪秦, 许激扬, 陈代杰, 等. 利用双水相系统转化雄甾-1, 4-二烯-3, 17-二酮的研究[J]. 药物生物技术, 2003, 10(3): 169.
[25] 朱殿生, 张 彧, 于 营, 等. 喜树碱生物转化优良菌株的筛选及其转化条件初步研究[J]. 大连轻工业学院学报, 2007, 26(1): 18.
[26] Lv YF, Chen KY, Li HL,etal. Biotransformation of vermitaline by Cunninghamella echinulata[J]. Helvetica Chimica Acta,2008, 91: 819.
[27] 金 艳, 尹成日, 金恩华. 微生物转化人参皂苷Rbl为C-K的研究[J]. 人参研究, 2010, (4): 7.
[28] 白龙律, 臧蕴霞, 尹成日. 微生物转化人参皂苷Rb1为Rg3的研究[J]. 延边大学学报(自然科学版), 2009, 35(2): 141.
[29] 金 艳, 金香梅, 尹成日. 微生物转化人参皂苷Rbl为稀有皂苷F2[J]. 延边大学农学学报, 2011, 33(2): 112.
[30] 田天丽, 沈 竞, 徐萌萌, 等. 虎杖中虎杖苷的微生物发酵转化研究[J]. 四川大学学报(自然科学版), 2008, 45(2): 437.
[31] 王永宏, 苏 建, 王建芳, 等. 栀子中京尼平苷的微生物转化研究[J]. 时珍国医国药, 2007, 18(12): 3003.
Applicationofmicrobialtransformationinnaturalproductsresearch
LIU Qing-xin1, LI Hui-liang2, LIU Run-hui2
(1. Department of Pharmacy, Fujian Traditional Chinese Medicine University, Fuzhou 350108,China;2 .Department of Phytochemistry,School of Pharmacy, Second Military Medical University, Shanghai 200433,China)
With the continuous development of biotechnology technology, microbial transformation gradually was applied to the study of natural products. The specific effective reactions, mild reaction conditions and high yield of the microbial transformation were outlined in this paper. The applications were reviewed in the microbial transformation of natural products in recent five years, especially in anthraquinones, flavonoids, terpenoids, steroids, alkaloids and glycosides. The developments of microbial transformation were prospected.
microbial transformation; natural products research; applications
刘庆鑫(1988-),男,硕士研究生.Tel:(021)81871252,E-mail:lqx.007@163.com.cn.
柳润辉.Tel:(021)81871245,E-mail:lyliurh@126.com.
Q93;R93
A
1006-0111(2012)05-0321-05
10.3969/j.issn.1006-0111.2012.05.001
2012-02-02
[修回日期]2012-03-26

