g-Al2O 3表面结构的红外光谱研究
赵国利,王少军,凌凤香,吴洪新,崔晓莉,张玉涵
(1. 中国石化抚顺石油化工研究院,辽宁 抚顺 113001; 2. 辽宁石油化工大学, 辽宁 抚顺 113001)
科研与开发
g-Al2O3表面结构的红外光谱研究
赵国利1,王少军1,凌凤香1,吴洪新1,崔晓莉1,张玉涵2
(1. 中国石化抚顺石油化工研究院,辽宁 抚顺 113001; 2. 辽宁石油化工大学, 辽宁 抚顺 113001)
采用原位红外光谱技术对不同温度(100~500 ℃)脱水g-Al2O3的表面羟基进行了研究,同时应用吡啶吸附原位红外光谱法对g-Al2O3表面上路易斯酸(L酸)进行了研究。实验结果表明,在升高脱水温度的过程中,在g-Al2O3表面共出现五个羟基谱带,分别为3 785,3 762,3 725,3 697,3 674 cm-1。在g-Al2O3表面上存在三种L酸性位,分别对应于五配位(酸性最弱)、四配位(酸性中等)和三配位的Al3+(酸性最强)。这三种Al3+的数量随脱水温度升高而增大,而且g-Al2O3表面上的L酸性位均有羟基与其相连。
红外光谱;g-Al2O3;羟基;L酸性位
氧化铝是应用最为广泛的催化材料[1]。由于具备很好的催化性能,氧化铝的性质一直是人们研究的热点,同时在催化材料之中,氧化铝表面是金属氧化物中最为复杂的。许多研究者[2-4]尝试对氧化铝表面羟基进行归属,从而深入研究氧化铝的表面结构。Tsyganenko等[3]研究了在氧化铝表面脱水过程中羟基的变化及归属并指出,在脱水过程中会增加氧化铝表面羟基的类型。近年来,在揭示g-Al2O3结构和表面羟基研究中,理论计算[4-7]起到了重要作用。Digne等[4,5]提出了一个非尖晶石结构的g-Al2O3模型,并应用该模型对红外光谱测定的表面羟基进行了归属,该模型获得了Paglia等[8]的支持。但是Sun等人[9]的密度泛函理论计算(DFT)和X射线衍射(XRD)结果表明,尖晶石结构模型也能够比较好地描述g-Al2O3体相结构。
氧化铝表面路易斯酸(Lewis acid,L酸)是另外一个催化研究热点,在脱水后的氧化铝表面产生L酸性位,以配位不饱和铝离子形式存在。应用红外光谱[2,3,10-13]、固体核磁共振[14,16]和理论计算[4,8]等对g-Al2O3的表面结构进行了研究,结果表明在g-Al2O3表面存在三配位、四配位和五配位的铝离子,这三种铝离子是氧化铝表面L酸的来源。红外光谱(IR)是研究氧化铝表面性质最好的技术手段,尤其是氧化铝表面羟基类型和配位不饱和铝离子。g-Al2O3的红外结果[17]表明其表面羟基具有非常弱的酸性。当吡啶吸附在氧化铝表面时,不生成吡啶离子[18],羟基与吡啶分子之间的作用力主要是氢键。氧化铝表面L酸非常复杂,表面三种类型的L酸分别为三配位、五配位铝离子和Al3+-Al3+离子对。然而27Al NMR研究表明在氧化铝表面只有作为L酸的四配位和五配位铝离子[15]。关于g-Al2O3表面信息的研究已取得一些进展,但是还没有完全阐明表面的详细结构,还存在一定的分歧,需要进一步对g-Al2O3表面结构进行研究。
本实验采用吡啶吸附的原位红外光谱技术对不同温度条件下脱水的g-Al2O3表面羟基和L酸进行了研究。
1 实验部分
原位红外光谱实验采用美国热电公司Nicolet 6700 傅立叶红外光谱仪(配MCT/A检测器),光谱扫描范围4 000 ~ 1 300 cm-1,分辨率4 cm-1。将所测氧化铝样品压制成直径为13 mm的自支撑片,装入以CaF2为窗口材料的原位红外池中,然后将g-Al2O3样品在100~500 ℃范围内真空脱水。所用吡啶经过严格脱水处理,将吡啶蒸气导入真空原位池,吸附15 min,然后抽真空并在特定温度下脱附,恒温高真空抽空30 min,再降至室温采谱,所有的光谱采集都在室温下进行,最后对测得的谱图与吸附吡啶前的谱图进行差谱,即可得到吸附吡啶分子的样品红外光谱。所有红外谱图经过归一化处理。
2 结果与讨论
图1为在不同温度下脱水的g-Al2O3羟基区原位红外光谱图,样品脱水温度分别为100、200、300、400和500 ℃。由图1可以看到在样品表面脱水过程中,逐渐发生了脱除吸附水、破坏氢键和脱羟基的过程。在增加脱水温度的过程中,g-Al2O3羟基的3 785、3 762、3 725和3 674 cm-1谱带变得更加清楚,3 697 cm-1羟基谱带逐渐消失,同时在3 540 cm-1附近的氢键谱带因发生脱水而逐渐减小,这些谱带的变化是氧化铝表面脱羟基过程和破坏羟基间氢键的结果。根据文献[2,3],3 785 cm-1对应于I4型OH,3 762 cm-1对应于I6型OH,3 725 cm-1对应于II66型OH,3 697 cm-1和3 674 cm-1对应于III型OH,其中4和6代表铝离子的配位数。由图1还可以看到,各羟基峰位的相互关系为,I4> I6> II66> II64> III,此趋势与文献一致。
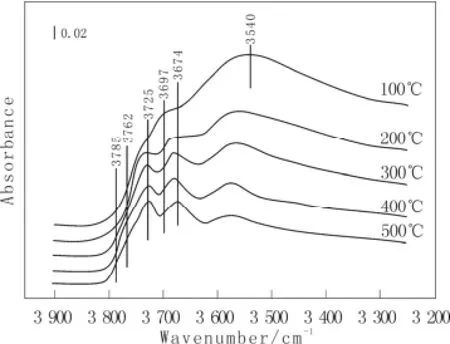
图1 γ-Al2O3在不同温度脱水后羟基区原位红外光谱图Fig.1 Infrared spectra in the hydroxyl spectral region of theg-Al2O3 dehydrated at different temperature
图2为在室温(25 ℃)条件下吡啶吸附在g-Al2O3表面上的原位红外光谱图。图2中在1 540 cm-1附近没有出现红外吸收谱带,说明在g-Al2O3表面上没有B酸(Brönsted acid)吸附吡啶,所以没有出现吡啶正离子。1 450 cm-1附近的红外吸收谱带表明存在L酸,这与文献[2]的结果相一致。1 576 cm-1和1 612 cm-1处的红外吸收谱带分别对应g-Al2O3表面上最弱的L酸和中等强度L酸。当脱水温度升高到200 ℃时,在g-Al2O3表面出现酸性最强的L酸(1 622 cm-1),且随着脱水温度的增加,这种L酸酸性位数量逐渐增加。而从图2中还可以看出,增加脱水温度,能够显著地增加g-Al2O3的L酸性位数量。
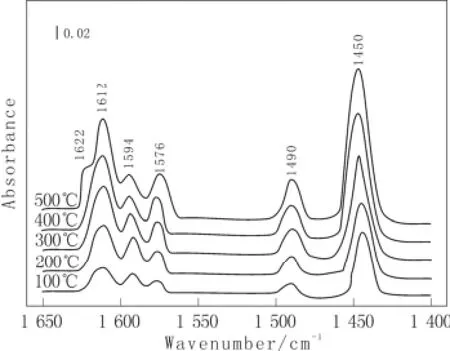
图2 g-Al2O3在不同温度脱水后吡啶吸附原位红外光谱图Fig.2 Infrared spectra in the pyridine ring vibration region of the dehydrated γ-Al2O3 after treatment at different temperature
当吡啶吸附在g-Al2O3上会与表面羟基形成氢键,对谱带1 450 cm-1、1 490 cm-1和1 595 cm-1均有贡献,此氢键可在150 ℃高真空条件下消除。同时,1 490 cm-1还有L酸和B酸(如果存在)的贡献;1 450 cm-1还主要是L酸特征峰。因此,当升高温度(>200 ℃)真空脱附在g-Al2O3上吸附的吡啶时,吸附比较弱的特征谱带(氢键和弱L酸)会明显减弱,如图3所示。

图3 不同脱附温度下γ-Al2O3表面吸附吡啶的红外光谱 Fig.3 Infrared spectroscopy of the same sample at different treated temperature
图3是吡啶吸附在经过400 ℃脱水的g-Al2O3表面,然后经过不同脱附温度处理的原位红外光谱图。吸附吡啶后分别在25、200、350和450 ℃进行真空脱附处理,以考察氧化铝表面的酸强度分布。在1 630~1 560 cm-1光谱区内,能够清楚地看出不同强度L酸在不同温度条件下的吡啶脱附情况。当处理温度从25 ℃增加到200 ℃时,此g-Al2O3最弱的L酸(1 576 cm-1)完全消失;中等强度的L酸(1 612 cm-1)强度减小。随着处理温度增加到450 ℃时,此g-Al2O3上中等强度的L酸消失,同时酸性最强的L酸对应的特征峰(1 622 cm-1)面积明显减小,g-Al2O3上L酸1 450 cm-1特征峰的变化趋势与此结果一致。
当吡啶吸附在g-Al2O3表面L酸性位上时,会与邻近的羟基群发生相互作用形成氢键,从而减小g-Al2O3表面的羟基强度,500 ℃脱水的样品吸附吡啶前后羟基区变化的实验结果如图4所示,此图是吸附吡啶后与吸附吡啶前的差谱。从图4中可以看出,在3 785、3 762、3 725和3 675 cm-1处均出现负峰,说明这四个羟基特征峰吸附吡啶后减小,同时出现3个新的特征峰(3 644、3 535和3 350 cm-1),归属为与吡啶分子形成氢键的羟基特征峰。当吡啶吸附在不同酸强度的L酸性位上时,致使吡啶环上的电子密度不同,因此吡啶环与邻近羟基形成的氢键强度不同,生成三种不同类型的氢键。这表明在g-Al2O3表面存在三种类型的L酸性位,分别归属为五配位、四配位和三配位的铝离子,其酸性逐渐增加。g-Al2O3表面上的五配位铝离子是经过六配位铝离子脱水产生;而四配位铝离子源于脱水后的五配位铝离子或者氧化铝表面四面体的铝离子,这两种来源的四配位铝离子对应的L酸强度存在一些差别;而三配位的铝离子是经过四面体配位的铝离子高温脱水形成的。
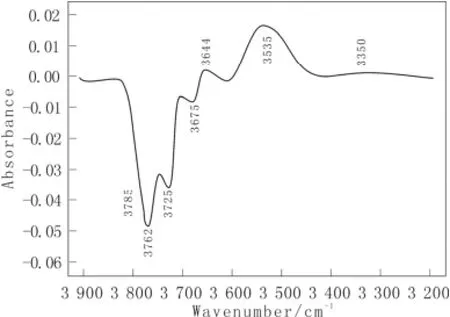
图4 500℃脱水γ-Al2O3表面吸附吡啶后羟基区的红外光谱 Fig.4 Infrared spectroscopy in the hydroxyl spectral region of the dehydrated γ-Al2O3 at 500℃
为了进一步考察g-Al2O3表面羟基和L酸之间的关系,对所有吸附吡啶后与吸附前的红外光谱进行差谱和积分,然后对g-Al2O3总L酸的数量作图,不同脱水温度的结果在图5中给出。从此图中可以看出,所有数据点近似地组成一条直线,而且这条直线通过原点,表明形成氢键的羟基与L酸性位的总量存在线性关系。所有的L酸性位都有与其相连的羟基群,当吡啶吸附在g-Al2O3表面的L酸性位上时,吡啶与邻近的羟基形成氢键,形成新的红外谱带(3 644、3 535和3 350 cm-1)。因此,吸附的吡啶分子只与邻近的羟基发生相互作用,不能与其他的羟基形成氢键,而且所有的L酸性位都有邻近的羟基,致使受到扰动(与吡啶形成氢键)的羟基谱带强度与总L酸数量成线性关系。
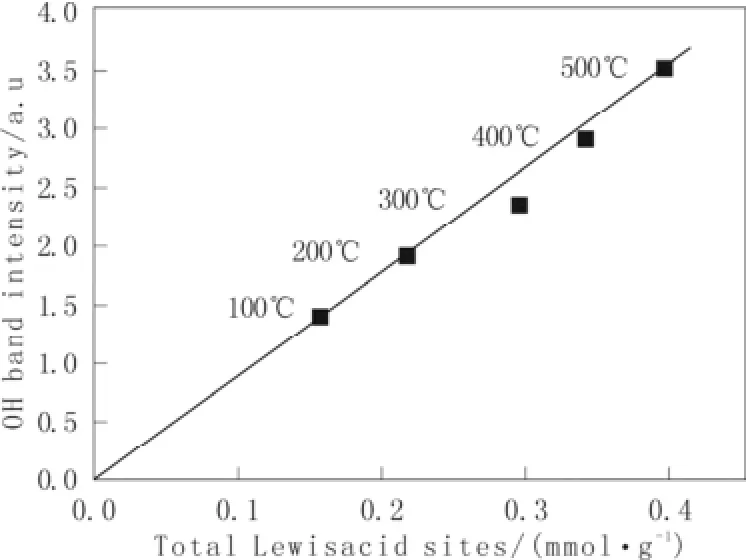
图5 不同脱水温度下γ-Al2O3形成氢键羟基面积积分与总L酸的关系Fig.5 Plot of OH band intensity against total Lewis acid sites for different dehydration temperature
3 结 论
在g-Al2O3脱水温度提高过程中,在氧化铝表面先后出现五个羟基谱带,分别是对应于I4型OH的3 785 cm-1,I6型OH的3 762 cm-1,II66型OH的3 725 cm-1,III型OH的3 674 cm-1和3 697 cm-1。在g-Al2O3表面上存在三种L酸性位,分别对应于五配位(酸性最弱)、四配位(酸性中等)和三配位的Al3+(酸性最强)。这三种Al3+的数量随脱水温度升高而增大,而且g-Al2O3表面上的L酸性位均有羟基与其相连。
[1]辛勤, 罗孟飞. 现代催化研究方法 [M]. 北京: 科学出版社, 2009.
[2]MORTERRA C, MAGNACCA G. A case study: surface chemistry and surface structure of catalytic aluminas, as studied by vibrational spectroscopy of adsorbed species [J]. Catalysis Today, 1996, 27(3-4): 497-532.
[3]TSYGANENKO A A, MARDILOVICH P P. Structure of alumina surfaces [J]. Journal of the Chemical Society, Faraday Transactions, 1996, 92(23): 4843-4852.
[4]DIGNE M, SAUTET P, RAYBAUD P, et al. Hydroxyl Groups on γ-Alumina Surfaces: A DFT Study [J]. Journal of Catalysis, 2002, 211(1): 1-5.
[5]DIGNE M, SAUTET P, RAYBAUD P, et al. Use of DFT to achieve a rational understanding of acid–basic properties of γ-alumina surfaces [J]. Journal of Catalysis, 2004, 226(1): 54-68.
[6]RAYBAUD P, DIGNE M, IFTIMIE R, et al. Morphology and Surface Properties of Boehmite (γ-AlOOH): A Density Functional Theory Study [J]. Journal of Catalysis, 2001, 201(2): 236-246.
[7]SOHLBERG K, PENNYCOOK S J, PANTELIDES S T. Hydrogen and the Structure of the Transition Aluminas [J]. Journal of the American Chemical Society, 1999, 121(33): 7493-7499.
[8]PAGLIA G, BOŽIN E S, BILLINGE S J L. Fine-Scale Nanostructure in γ-Al2O3[J]. Chemistry of Materials, 2006, 18(14): 3242-3248.
[9]SUN M, NELSON A E, ADJAYE J. Examination of Spinel and Nonspinel Structural Models for γ-Al2O3by DFT and Rietveld Refinement Simulations [J]. The Journal of Physical Chemistry B, 2006, 110(5): 2310-2317.
[10]LIU X. DRIFTS Study of Surface of γ-Alumina and Its Dehydro xylation [J]. The Journal of Physical Chemistry C, 2008, 112(13): 5066-5073.
[11]MORTERRA C, BOLIS V, MAGNACCA G. IR Spectroscopic and Microcalorimetric Characterization of Lewis Acid Sites on (Transition Phase) Al2O3Using Adsorbed CO [J]. Langmuir, 1994, 10(6): 1812-1824.
[12]GRIBOV E N, ZAVOROTYNSKA O, AGOSTINI G, et al. FTIR spectroscopy and thermodynamics of CO and H2adsorbed on γ-, δand α-Al2O3[J]. Physical Chemistry Chemical Physics, 2010, 12(24): 6474-6482.
[13]BARZETTI T, SELLI E, MOSCOTTI D, et al. Pyridine and ammonia as probes for FTIR analysis of solid acid catalysts [J]. Journal of the Chemical Society, Faraday Transactions, 1996, 92(8): 1401-1407.
[14]HUGGINS B A, ELLIS P D. Aluminum-27 nuclear magnetic resonance study of aluminas and their surfaces [J]. Journal of the American Chemical Society, 1992, 114(6): 2098-2108.
[15]BLUMENFELD A L, FRIPIAT J J. Acid sites topology in aluminas and zeolites from high-resolution solid-state NMR [J]. Topics in Catalysis, 1997, 4(1): 119-129.
[16]LUNSFORD J H. Characterization of acidity in zeolites and related oxides using trimethylphosphine as a probe [J]. Topics in Catalysis, 1997, 4(1): 91-98.
[17]LIU X, TRUITT R E. DRFT-IR Studies of the Surface of γ-Alumina [J]. Journal of the American Chemical Society, 1997, 119(41): 9856-9860.
[18]RIPMEESTER J A. Surface acid site characterization by means of CP/MAS nitrogen-15 NMR [J]. Journal of the American Chemical Society, 1983, 105(9): 2925-2927.
Infrared Spectroscopic Study of the Surface of g-Alumina
ZHAO Guo-li1,WANG Shao-jun1,LING Feng-xiang1,WU Hong-xin1,CUI Xiao-li1,ZHANG Yu-han2
(1. Fushun Research Institute of Petroleum and Petrochemicals, Liaoning Fushun 113001, China;2. Liaoning Shihua University, Liaoning Fushun 113001, China)
OH groups and Lewis acid sites on the surface of g-Alumina dehydrated at different temperature (100~500℃) were studied by using conventional pyridine adsorption/FT-IR. The experimental results show that five OH groups (3 785, 3 762, 3 725, 3 697, 3 674 cm-1) are found on the surface in the process of increasing dehydration temperature. The results also demonstrate that only three types of Lewis acid sites on the surface correspond to the three possible Al3+coordination configurations, and five-coordination Al3+sites are weak Lewis acid sites, while the three- and fourcoordinate Al3+sites are strong and medium strong Lewis acid sites, respectively. The numbers of weak, medium and strong Lewis acid sites change with dehydration temperature, and all types of Lewis acid sites have adjacent OH groups.
Infrared spectroscopy; g-alumina; OH; Lewis acid site
TE 624. 4
A
1671-0460(2012)07-0661-03
2012-06-19
赵国利(1977-),男,辽宁抚顺人,工程师,博士,2010年毕业于大连理工大学物理化学专业,从事催化剂原位红外光谱表征研究。E-mail:zhaoguoli.fshy@sinopec.com,Tel:024-56389320。

