盐酸13-己基小檗碱对T淋巴细胞活化和角质形成细胞细胞因子产生的影响
宋莎莎 李新宇 王永芳 徐兰芳 唐美育 郑家润
湿疹、皮炎及银屑病等一类炎症相关性皮肤病是皮肤科常见病。该类疾病通常由活化的T淋巴细胞介导免疫紊乱引起,多种免疫细胞及表皮角质形成细胞共同参与发病过程[1]。表皮角质形成细胞不仅是浸润的T淋巴细胞免疫攻击的靶细胞,而且是皮肤免疫反应中的积极参与者。角质形成细胞在静息状态其免疫-炎症介质呈低表达状,一旦受到来自活化T细胞表达的TNF-α、IFN-γ等细胞因子或致炎信号刺激,它能表达过量的炎症介质如IL-8和TNF-α等[2]。此外,疾病状态下巨噬细胞表达的IL-1等趋化因子也是强有力的致炎因子。细胞因子和炎症介质间形成的复杂网络是导致炎症性皮肤病免疫病理损伤的重要因素,调节免疫细胞和角质形成细胞引起或使之持续的炎症事件是重要的治疗手段。
小檗碱为毛莨科黄连属植物黄连的根状茎中提取的主要有效成分,是传统抗菌药,并有抗炎等生物活性。盐酸13-己基小檗碱是盐酸小檗碱的衍生物。本实验室前期研究发现,该化合物具有较强的抗炎、抗菌和抗疱疹病毒等活性[3,4]。为了探索该化合物针对炎症性皮肤病的抗炎作用靶点,为进一步研发提供实验依据,本研究以体外培养的永生化角质形成细胞株HaCaT细胞、小鼠脾脏T淋巴细胞和腹腔巨噬细胞为靶细胞,在体外培养诱导体系中探讨盐酸13-己基小檗碱对T淋巴细胞活化,以及IL-8、TNF-α和IL-1β产生的影响,同时与他克莫司、雷公藤内酯醇和丙酸氯倍他索做对照研究。
材料与方法
1.材料:(1)细胞株和动物:人表皮角质形成细胞永生化株HaCaT(ATCC);清洁级C57BL/6小鼠(雌雄各半,8~12周龄,购于南通大学)。(2)药物和试剂:盐酸13-己基小檗碱(中国药科大学李耐三教授提供,含量99.36%);他克莫司(浙江万马药业有限公司提供,含量99.4%);雷公藤内酯醇(中国医学科学院皮肤病研究所药物研究室提供,含量99.78%);丙酸氯倍他索(天津药业集团有限公司提供,含量98.2%);重组人肿瘤坏死因子 -α(rhTNF-α,美国 Peprotech);伴刀豆球蛋白A(ConA,Sigma);脂多糖(LPS,Sigma);人TNF-α、IL-8和小鼠IL-1βELISA检测试剂盒(R&D公司生产,北京四正柏生物有限公司分装)。(3)仪器:312nm窄波UVB照射仪(德国Waldmann-medizintechnik公司)。
2.方法:(1)小鼠T淋巴细胞活化试验:小鼠脾脏剪碎后用RPMI1640完全培养液制成3×106/毫升悬液,用10μg/ml ConA活化。接种96孔培养板,0.1毫升/孔,加入不同浓度受试药液0.1毫升/孔,设平行3孔。同时设ConA刺激物对照组、空白细胞对照组、溶媒对照组,37℃、5%CO2中培养60h。各孔加5mg/m l MTT 20μl培养4h。弃上清,细胞用 SDS液(0.1毫升/孔)裂解,培养24h后测定OD550值,计算细胞存活率。(2)HaCaT细胞增殖试验:对数生长期HaCaT细胞常规消化后按5×105/ml接种96孔板。细胞贴壁后加入不同浓度的受试物作用48h。每孔加5mg/ml MTT 20μl后再孵育4h,去上清后加入150μl DMSO,测定 OD550值,计算细胞存活率。(3)细胞因子体外诱导试验:①IL-8:对数生长期HaCaT细胞,按3×105/m l接种96孔板,用含10%胎牛血清DMEM培养8h,更换无血清培养基作同步化处理过夜。加入不同浓度rhTNF-α刺激48h。收集细胞上清,离心后ELISA检测,确定最适诱导浓度;②TNF-α:对数生长期HaCaT细胞,按1×106/ml接种直径3cm的培养皿,培养过夜后在312nm UVB窄波照射仪上分别按96.6mJ/cm2和124.2mJ/cm2剂量照射。补充培养基后继续培养24h,上清经ELISA检测后确定最适照射剂量;③IL-1:用含5%胎牛血清的Hanks液注入C57BL/6小鼠腹部制备腹腔巨噬细胞。按2×106/ml接种24孔培养板,1毫升/孔,贴壁培养4h后加 LPS(10μg/ml)刺激 48h,收集上清供ELISA检测。(4)药物影响试验:HaCaT细胞或小鼠腹腔巨噬细胞按上述方法接种后加入不同浓度药液,预处理120min后分别用25ng/ml rhTNF-α,或124.2mJ/cm2的窄波UVB照射 ,或10μg/ml LPS诱导,合并药物处理,24或48h后收集上清供ELISA检测。实验设溶媒对照组、无药对照组和空白细胞对照组。(5)ELISA测定IL-8、TNF-α和IL-1β水平:按试剂盒说明操作。先用细胞因子标准品测定标准曲线,再将不同稀释度的待检样品进行测定,根据OD450换算细胞因子蛋白含量。
结 果
1.受试物对小鼠T淋巴细胞增殖的影响:结果见图1。在0.05 ~0.39μg/m l浓度范围,盐酸13 - 己基小檗碱明显抑制小鼠T淋巴细胞增殖,并有剂量依赖性趋势。对照药丙酸氯倍他索在0.1μg/m l的抑制率可达80%以上。
2.受试物对HaCaT细胞增殖的影响:表1显示,作用48h后盐酸13-己基小檗碱在0.05~0.78μg/ml范围内对细胞活力影响较小(抑制率<15%),而在1.56 ~6.25μg/ml对 HaCaT 细胞增殖影响较大(抑制率>60%)。对照药雷公藤内酯醇在≥10-1μg/ml、他克莫司在≥100μg/ml时的抑制率在20%以上。
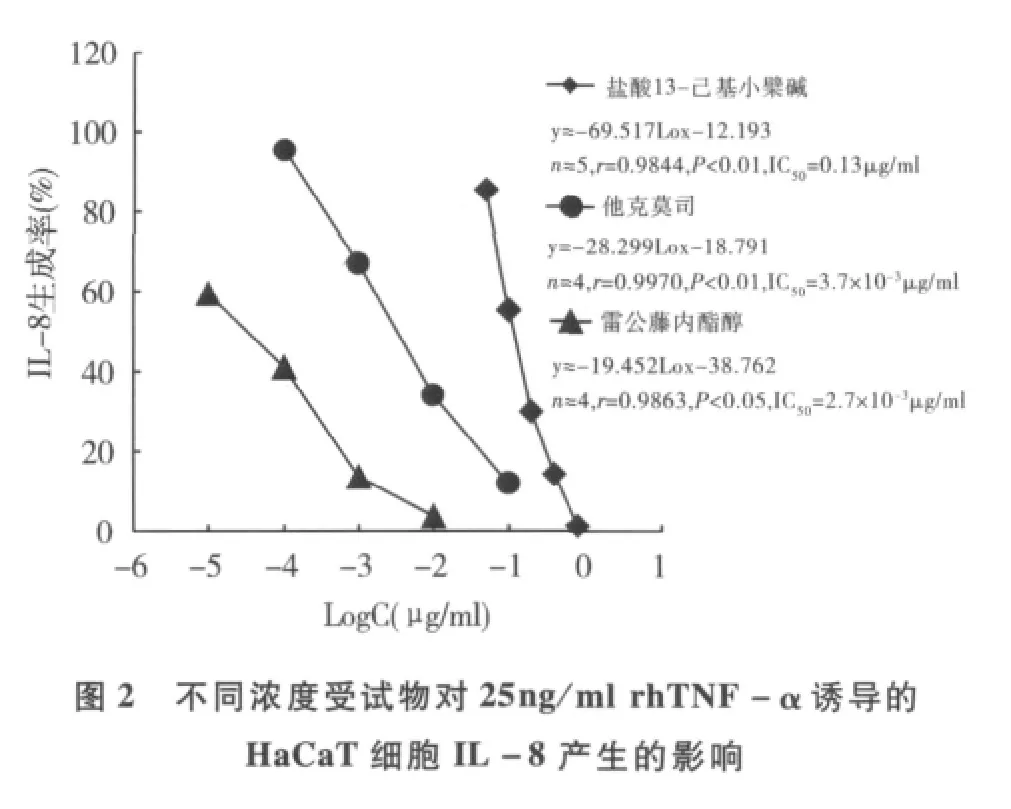
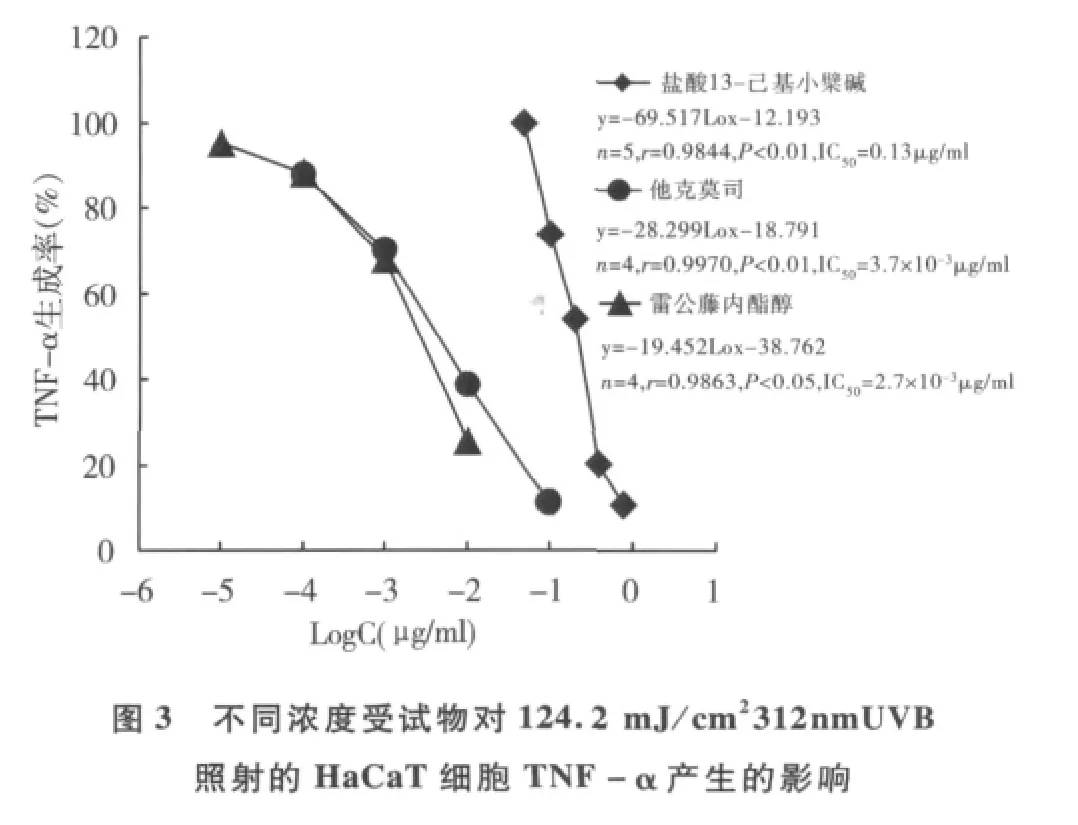
3.细胞因子的体外诱导:(1)HaCaT细胞在自然状态下产生基础水平的IL-8,在25、50和100ng/ml rhTNF-α刺激48h后,IL-8的生成明显增加(P<0.01),约为基础量的4~5倍,3个rhTNF-α浓度组间无明显差异。(2)采用 312nm UVB 96.6和124.2mJ/cm2两种剂量照射后,HaCaT细胞TNF-α产生明显增加,其中124.2mJ/cm2剂量组的生成量高达447pg/ml(P<0.01)。(3)小鼠腹腔巨噬细胞用10μg/ml LPS刺激48h后,IL-1β表达水平可上调至3276pg/ml(P<0.01)。基于以上结果,在后续药物实验中选择25ng/ml rhTNF-α、124.2mJ/cm2UVB 和10μg/ml LPS分别作为 IL-8、TNF-α和 IL-1β的刺激条件。
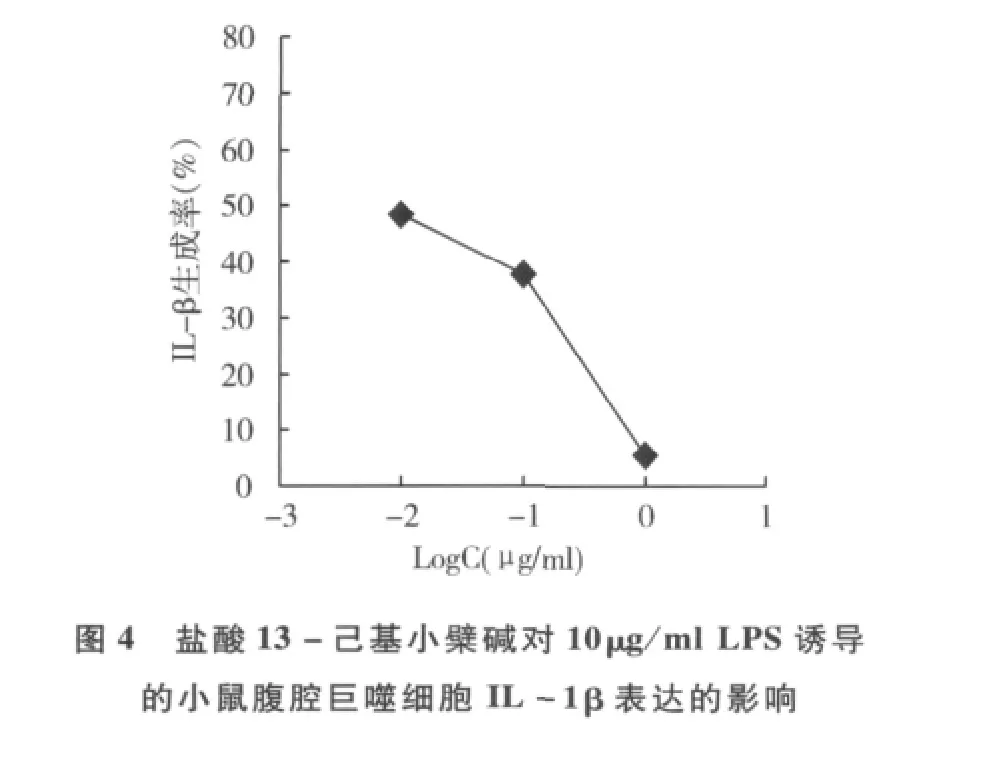
4.受试物对细胞因子产生的影响:图2和图3显示,0.05 ~0.78μg/ml浓度范围的盐酸13 - 己基小檗碱剂量依赖性地抑制25ng/ml rhTNF-α诱导的HaCaT细胞IL-8的上调作用和124.2mJ/cm2窄波UVB照射后引起的TNF-α表达,对照药他克莫司和雷公藤内酯醇的剂量依赖性抑制作用明显。对10μg/ml LPS刺激引起的小鼠腹腔巨噬细胞IL-1β的表达,盐酸13-己基小檗碱在0.01μg/ml时的抑制率可达50%,并显示量-效趋势(图4),0.1μg/ml丙酸氯倍他索的抑制率为94%。
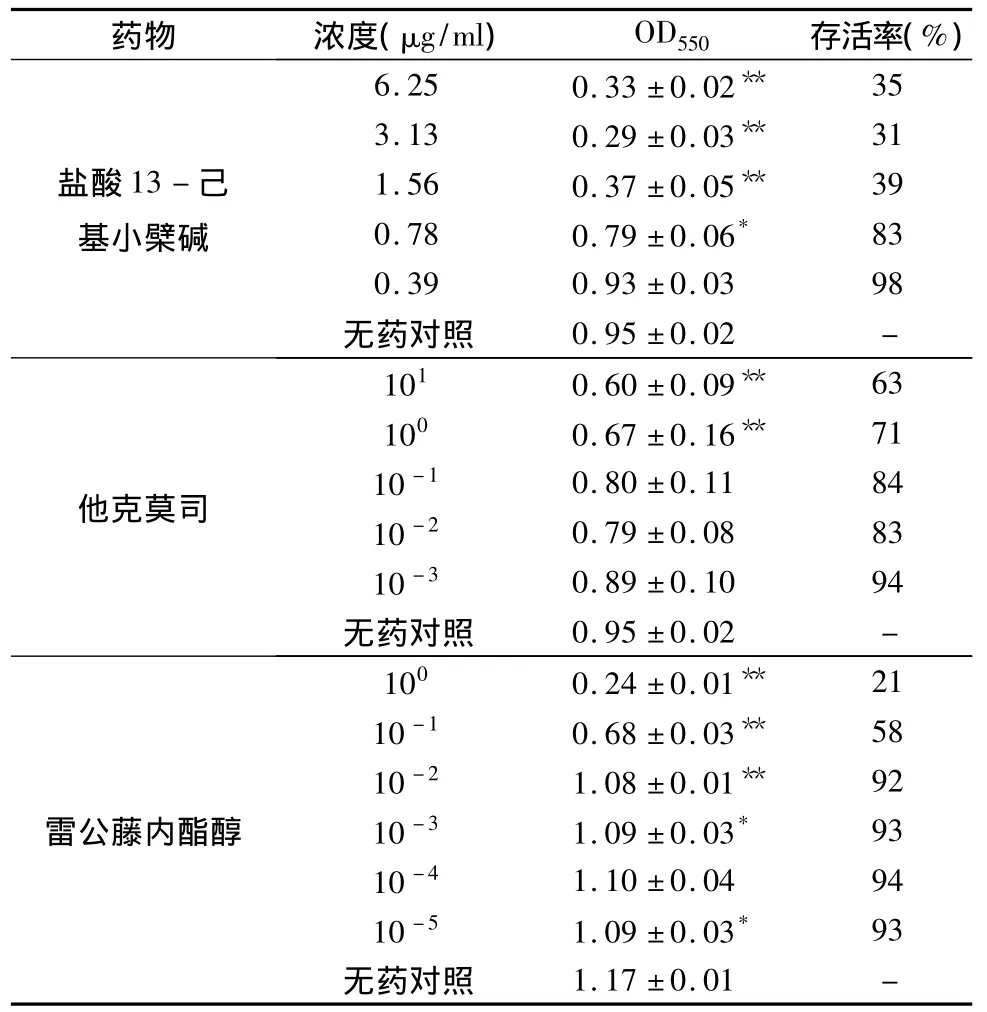
表1 不同浓度受试物作用48h对HaCaT细胞活力的影响(x±s)
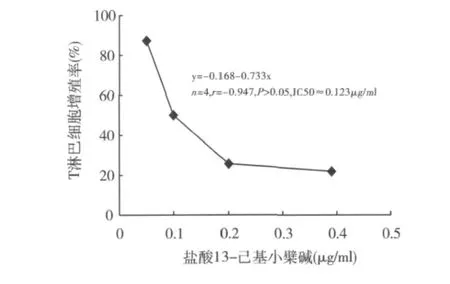
图1 不同浓度盐酸13-己基小檗碱处理后对10μg/m l ConA刺激的小鼠T淋巴细胞增殖的影响
讨 论
皮损中活化的T淋巴细胞浸润是炎症性皮肤病的典型标志。Kastelan等[5]认为,皮肤局部聚集的具有特殊活性的CD4+T细胞及其分泌的Th1型细胞因子是触发银屑病复杂的级联反应的关键。本研究表明盐酸13-己基小檗碱对小鼠T淋巴细胞增殖有明显抑制作用(IC50≈0.123μg/ml),提示该化合物可通过抑制T淋巴细胞活化而可阻断后续的免疫-炎症效应。表皮角质形成细胞是炎症性皮肤病局部治疗的直接靶细胞。结果表明,高浓度组(>0.78μg/ml)对HaCaT角质形成细胞增殖有明显影响,而低浓度组(≤0.78μg/ml)的直接影响较小,亦提示此浓度是后续细胞因子试验的上限浓度。TNF-α是皮肤免疫和炎症过程中具有重要作用的初级细胞因子,与其他细胞因子相互促进与抑制,形成一个自我维持的炎性过程,并且能诱导角质形成细胞分泌IL-8,触发皮损局部的免疫炎症反应[6]。IL-8是多功能性趋化因子,可诱导中性粒细胞趋化,促进HaCaT细胞增殖,同时还能促进其他细胞因子的产生。本研究中,静息状态的 HaCaT细胞在外源性 rhTNF-α和312nm UVB刺激下,IL-8和TNF-α产生分别增加数倍和数十倍,盐酸13-己基小檗碱能明显抑制它们的产生(IC50分别为0.13 和0.21μg/ml),提示该作用可能是化合物抗炎作用的重要环节。体内IL-1β主要由活化的单核-吞噬细胞产生,通过活化NF-κB等途径促进T细胞与血管内皮细胞间的黏附,导致T细胞溢出血管进入皮肤,同时它也是白细胞的强趋化剂。盐酸13-己基小檗碱在0.01~1.00μg/ml浓度范围对小鼠腹腔巨噬细胞IL-1β产生的抑制率超过50%,进一步反映了该化合物通过抑制炎症介质的产生而发挥抗炎效应的特征。
本研究中用于对照研究的他克莫司为大环内酯类新型免疫抑制剂,具有免疫抑制和抗炎作用,在治疗特应性皮炎和银屑病等炎症性皮肤病中有确切疗效[7,8]。雷公藤在临床治疗严重型银屑病等疾病具有特色,雷公藤内酯醇是雷公藤抗炎免疫活性的代表化合物。以上两种药在本研究中的阳性结果进一步证实了它们的功效。通过抑制IL-8、TNF-α和IL-1β的产生,继而可影响炎症细胞聚集等皮肤炎症后续事件,表明了盐酸13-己基小檗碱具有治疗炎症性皮肤病的潜力。该化合物为非甾体结构,其对激素依赖性皮炎具有特殊意义,我们以往的研究已经证实该化合物对NF-κB信号途径的活化有明显的干预作用,有关它的抗炎机制的深入研究正在进行之中[4]。
(志谢:中国药科大学李耐三教授提供研究样品,在此表示感谢)。
1 O'Neill LA.Targeting signal transduction as a strategy to treat inflammatory diseases[J].Nat Rev Drug Discov,2006,5(7):549 - 563
2 Albanesi C,Scarponi C,Giustizieri ML,et al.Keratinocytes in inflammatory skin diseases[J].Curr Drug Targets Inflamm Allergy,2005,4(3):329-334
3 吴建兵,李新宇,郑家润,等.小檗碱衍生物HB-13体外抗单纯疱疹病毒的研究[J].中华皮肤科杂志,2007,40(11):671-673
4 姜辉,李新宇,涂红琴,等.HB-13和HP-13对HaCaT细胞NF-κB活化和p38MAPK磷酸化的影响[J].中华皮肤科杂志,2009,42(5):339-342
5 Kastelan M,Massari LP,Pasic A,et al.New trends in the immunopathogenesis of psoriasis[J].Acta Dermatovenerol Croat,2004,12(1):26-29
6 李新华,张开明,刘玉峰.肿瘤坏死因子α对银屑病患者角质形成细胞白介素8产生的影响[J].中华微生物学和免疫学杂志,2005,25(12):992
7 Wollenberg A,Reitamo S,Girolomoni G,et al.Proactive treatment of atopic dermatitis in adultswith 0.1%tacrolimus ointment[J].Allergy,2008,63(7):742-750
8 Carroll CL,Clarke J,Camacho F,et al.Topical tacrolimus ointment combined with 6%salicylic acid gel for plaque psoriasis treatment[J].Arch Dermatol,2005,141(1):43-46

