Bcl-2在成釉细胞分化、分泌过程中的表达研究
于西佼,唐开亮,杜 毅,李 纾
(山东 济南 250001:1.济南市口腔医院牙体牙髓科;2.山东大学省口腔生物医学重点实验室)
Bcl-2是目前已被确认的凋亡调控抑制蛋白,Tsujimoto等[1](1984)从人14号和18号染色体易位的滤泡性淋巴瘤中分离出的一种原癌基因,编码Mr 26000蛋白,分布于线粒体内膜、细胞膜、细胞核膜和内质网膜上。Bcl-2可促进细胞的存活而减少凋亡的发生,抑制多种基因诱导的细胞凋亡,并在不影响细胞增殖的情况下增强细胞存活力,参与细胞增殖和凋亡动态平衡的调控。
本研究通过制备不同发育阶段的BALB/C小鼠下颌第一磨牙牙胚标本,采用TUNEL法和PV免疫组织化学技术检测凋亡调控抑制蛋白Bcl-2在成釉细胞分化、分泌过程中的表达;透射电镜观察细胞超微结构的变化,以期探讨Bcl-2和细胞凋亡在该过程的可能作用。
1 材料和方法
1.1 主要试剂和仪器
鼠PCNA单克隆抗体、PV免疫组化两步法试剂盒、DAB显色剂(北京中杉);多聚赖氨酸(Sigma美国);RM2135切片机(LEICA,德国);OLYMPUS CX71显微镜和照相系统、JEM-1200EX透射电镜(日本)。
1.2 标本制备
取出生后 2、5、7、9、14 d 不同发育阶段的BALB/C小鼠下颌第一磨牙牙胚(山东大学动物中心提供)25只,分别于麻醉后用新鲜配置的40 g/L多聚甲醛内固定,解剖分离下颌骨,40 g/L多聚甲醛 4℃下再固定1 d、100 g/L EDTA脱钙1~2个月,梯度乙醇脱水、石蜡包埋,近中远中向5 μm连续切片,行HE和免疫组化。
1.3 免疫组化
采用PV免疫组化法对Bcl-2表达进行组织定位。常规石蜡切片脱蜡、水化至水,30 mL/L过氧化氢液室温孵育10 min以灭活内源性过氧化物酶活性,滴加Bcl-2单克隆抗体(1∶100稀释),37℃温箱孵育1 h。PBS洗2 min×3次,滴羊抗鼠IgG抗体-HRP多聚体,37℃孵育20 min,PBS漂洗,DAB液显色,蒸馏水冲洗,苏木素复染30 s,常规脱水、透明、中性树胶封片,显微镜下观察并照相。(阳性表达呈棕黄色)。阴性对照片用PBS分别代替一抗或二抗,以成骨肉瘤组织作阳性对照。
1.4 原位末端标记(TdT-mediated-dUTP nick end labeling,TUNEL)法检测细胞凋亡
石蜡切片常规脱蜡、水化至水,30 mL/L过氧化氢液温处理7 min以灭活内源性过氧化物酶。DDW(double distilled water)冲洗,0.1 mol/L PBS液(pH 7.4)2 min × 3 次;用 16.2 μg/mL 蛋 白 酶 K(10 mmol/L Tris/HCI pH 7.4)在37℃温箱孵育消化10 min,DDW冲洗,PBS洗2 min ×3次;每个标本加入20 μL的TUNEL反应液(1号液与2号液按1∶9混合配制,1号液为末端脱氧核酸转移酶TdT,2号液为核苷酸混合液)放于湿盒中37℃ 温箱孵育60 min,DDW冲洗,PBS洗2 min ×3次;此时在荧光显微镜下观察并分析结果后,加入酶标记的抗荧光素抗体转化剂-POD(3号液),湿盒内37℃温箱孵育30 min,DDW冲洗,PBS洗2 min ×3次;正常山羊血清室温处理10 min以减少非特异性结合,PBS洗 2 min×3次;加入DAB显色剂镜下显色,DDW终止显色反应,冲洗,苏木精复染30 s,自来水冲洗5 min,常规脱水封片,镜下观察并照相。以2号液代替TUNEL反应液作阴性对照。
1.5 透射电镜观察
将分离的含下颌第一磨牙区的下颌骨于25 mL/L戊二醛固定液中4℃下初固定2 d,初步修剪标本,100 g/L EDTA 脱钙1 周,0.1 mol/L PBS 液(pH 7.4)冲洗后10 g/L 锇酸后固定2 h,经梯度乙醇(300、500、700、850、950 mL/L无水乙醇×3次)脱水后,换环氧乙烷过渡(环氧乙烷:包埋剂 =3∶1、1∶1、1 ∶3 及纯包埋剂浸透),逐步过渡到Spurr包埋剂中包埋,然后升温聚合、修块切片,碱性品红-亚甲蓝染色1~2 min,水冲后,显微镜下观察定位,进一步修块后,80 nm超薄切片,醋酸双氧铀、柠檬酸铅双重染色,JEM-1200EX透射电镜观察并拍照。
2 结果
小鼠出生后第2、5天,成釉细胞处于分化期,内釉上皮分化成为成釉上皮,细胞器重新定位,细胞核逐渐远基底膜排列,超微结构可见胞浆内有高尔基复合体和线粒体(图1),可观察到成釉细胞增生的核分裂(图2);免疫组化结果显示Bcl-2阳性表达(图3),TUNEL检测结果发现部分细胞胞核阳性表达,提示有细胞凋亡的存在(图4)。
小鼠出生后第7、9天处于分泌期,成釉细胞已开始分泌,可见新形成的釉质,胞核远基底排列,胞核附近可见大量线粒体,胞质内可见大量高尔基复合体和粗面内质网(图5)。胞浆呈Bcl-2强阳性表达(图6);TUNEL检测发现有少量成釉细胞胞核阳性表达(图7)。
出生后第14天釉质发育完成,成釉细胞变短,细胞间隙变大,细胞器数量减少,核膜逐渐不清,异染色体增加,核糖体脱颗粒水肿,呈现凋亡征象(图8),胞浆则未见Bcl-2阳性表达(图9)。
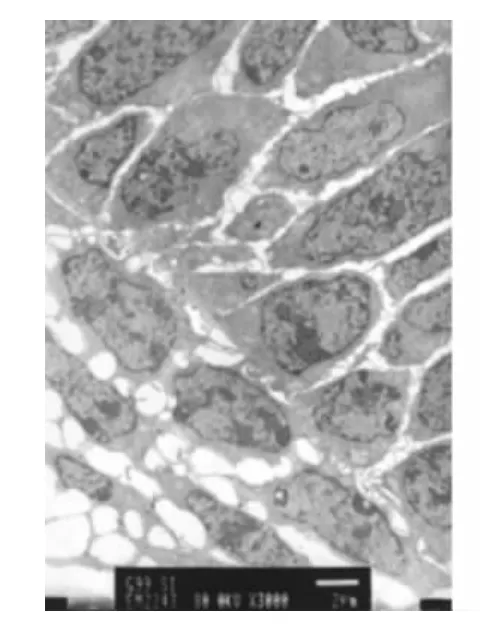
图1 成釉细胞分化期,胞核大,胞浆可见到高尔基复合体和线粒体(透射电镜,×3000)
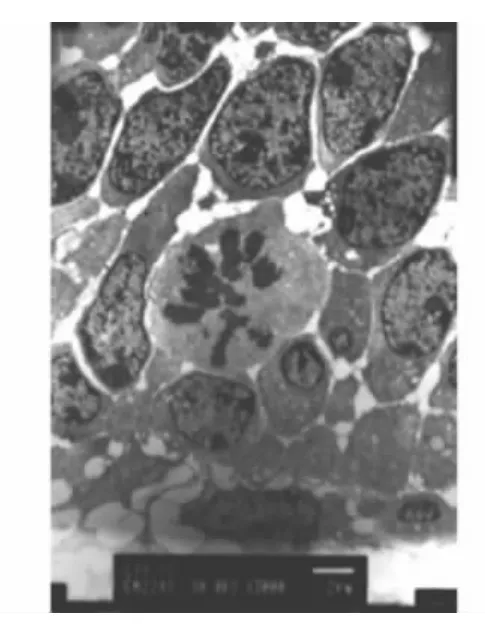
图2 成釉细胞分化期,细胞可见核分裂征象(透射电镜,×3000)
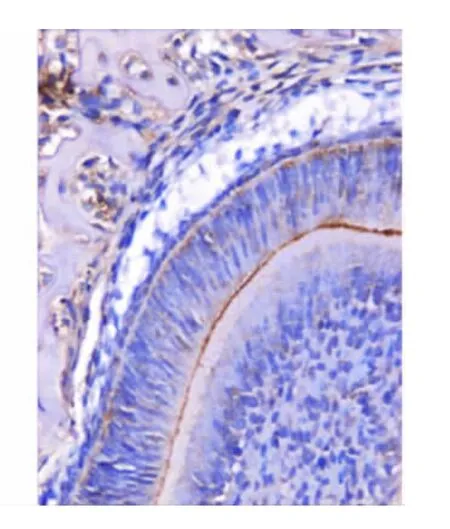
图3 出生后第2天,成釉细胞分化期,内釉上皮细胞胞核尚未远基底排列,细胞呈Bcl-2阳性表达(免疫组化,×20)
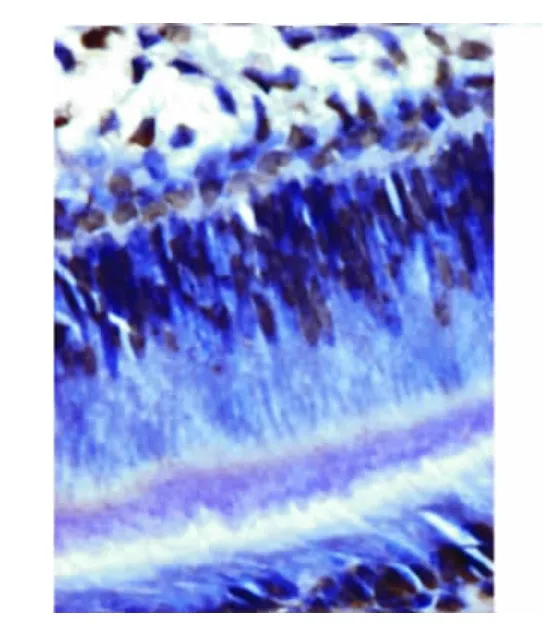
图4 出生后第5天,成釉细胞分化期,胞核开始远基底排列,TUNEL检测结果发现部分成釉细胞胞核阳性表达(×40)
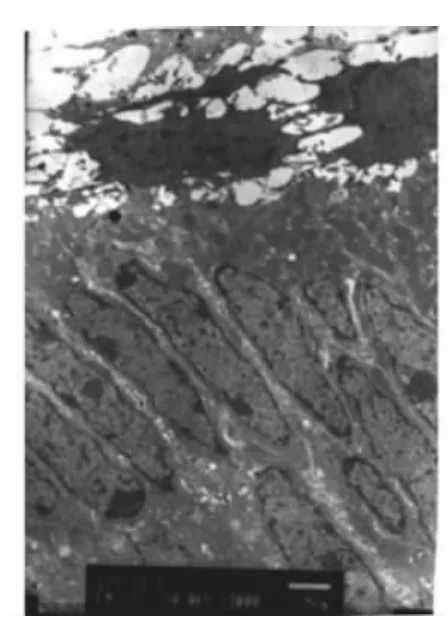
图5 出生后第7天,成釉细胞分泌期,胞质内可见大量线粒体、高尔基复合体和粗面内质网(透射电镜,×3000)
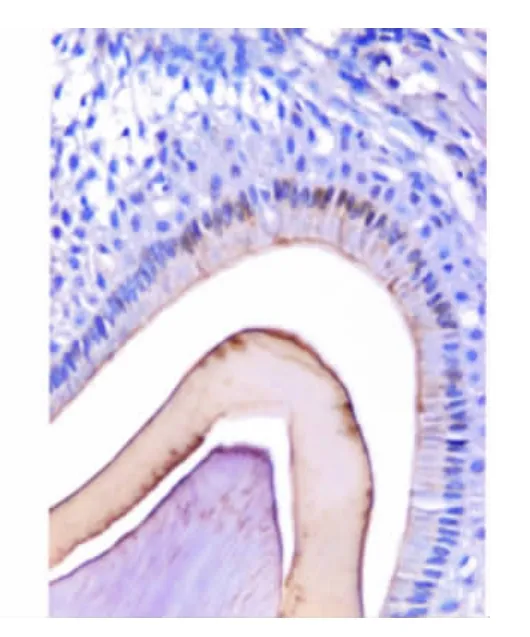
图6 出生后第9天,成釉细胞分泌期,细胞胞质呈棕黄色,Bcl-2阳性表达(免疫组化,×20)

图7 出生后第7天,成釉细胞分泌期,釉质开始形成,胞核远基底排列,TUNEL检测结果发现部分成釉细胞胞核呈棕黄色,可见细胞凋亡阳性表达(×40)

图8 出生后第14天,釉质发育完成,细胞器数量减少,核膜逐渐不清,异染色体增加(透射电镜,×3000)
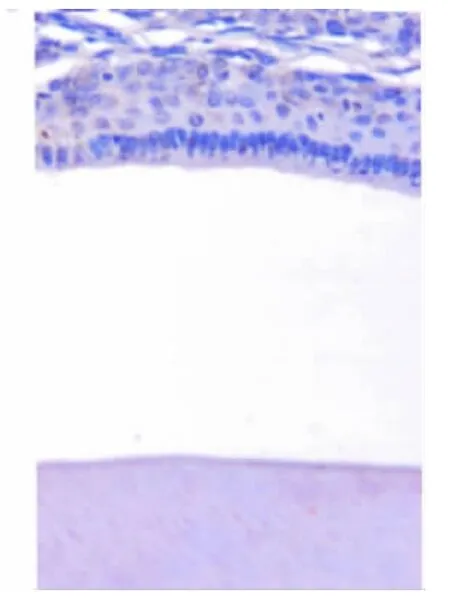
图9 出生后第14天,釉质发育完成,细胞变短,细胞呈Bcl-2阴性表达(免疫组化,×20)
3 讨论
在胚胎发育中,组织发育总是在细胞迁移、诱导、增殖和凋亡变化中完成,并处于动态的平衡。细胞凋亡(apoptosis)又称编程性细胞死亡(programmed cell death,POD),是生命过程中不可缺少的一种细胞自我调节机制和多细胞生物藉以生存的重要细胞代谢方式,在组织形态发生过程中起到重要的塑型作用,是机体维持细胞群体数量稳定的重要手段[2]。Bronckers 等[3]研究证实,细胞凋亡可存在于釉质发育的各个阶段,包括成釉细胞的分化期、分泌期、转变期等。
本研究中观察到处于分化期、分泌期的成釉细胞中都呈Bcl-2阳性表达,并在釉质分泌的高峰期即小鼠出生后第9天呈强阳性表达。在分化期,内釉上皮逐渐分化为成釉上皮,为分泌期做细胞准备,超微结构观察可见明显的细胞核分裂,此时细胞增殖分化活跃,而且TUNEL检测发现部分细胞胞核阳性表达,提示细胞凋亡的同时存在;Bcl-2的阳性表达则表明其参与成釉细胞分化期的细胞凋亡调控。Bcl-2可促进细胞的存活而减少凋亡的发生,抑制多种基因诱导的细胞凋亡,平衡细胞增殖和凋亡。分泌期是釉质发育的最关键阶段,超微结构观察发现成釉细胞内有大量参与蛋白合成的高尔基复合体、粗面内质网以及提供细胞能量的线粒体,表明细胞分泌功能活跃。但TUNEL检测结果发现分泌期部分细胞胞核呈阳性表达,说明此阶段也存在细胞凋亡;而且此阶段成釉细胞对Bcl-2的阳性表达增强,提示Bcl-2可以在成釉细胞数量不能明显增加的情况下,增强细胞存活力,延长功能细胞寿命,从而保证足够的成釉细胞来完成分泌功能。而到釉质发育完成后,成釉细胞明显变短,超微结构观察发现成釉细胞间隙增大,细胞器减少,细胞核糖体脱颗粒,部分核膜不清,凋亡征象明显,与Bcl-2的阴性表达相一致。此阶段成釉细胞大量减少,最终与中间层、星网状层以及外釉上皮结合形成缩余釉上皮。
研究提示:细胞凋亡是釉质发育形成过程中的一种有效机制,以之清除生命周期结束或功能消失的成釉细胞,Bcl-2对细胞凋亡的调控,一方面保证足够的细胞完成分化后发挥分泌功能,又限定进入下一阶段的细胞数目,从而维持组织本身细胞数目上内环境的稳定[4]。然而Bcl-2对细胞凋亡的调控机制目前尚未完全明了,细胞凋亡失调(凋亡不足或凋亡过度)是否可成为某些疾病的重要发病机制尚需进一步的深入研究[5]。
[1]Tsujimoto Y,Finger LR ,Yunis J,et al.Cloning of the chromosome breakpoint of neoplastic B cells with the t(14;18)chromosome translocation[J].Science,1984,226(4678):1097-1099.
[2]Reed JC.Bcl-2-family proteins and hematologic malignancies:history and future prospects[J].Blood,2008,111(7):3322 -3330.
[3]Bronckers AL ,Goei SW,Dumont E ,et al.In situ detection of apoptosis in dental and periodontal tissues of the adult mouse using annexin-V-biotin[J].Histochem Cell Biol,2000,113(4):293-301.
[4]Smith CE.Cellular and chemical events during enamel maturation[J].Crit Rev Oral Biol Med,1998,9(2):128 -161.
[5]Tanner EA,Blute TA,Brachmann CB,et al.Bcl-2 proteins and autophagy regulate mitochondrial dynamics during programmed cell death in the Drosophila ovary[J].Development,2011,138(2):327-338.

