3种ELISA试剂盒对牛新孢子虫血清抗体比较检测
季新成 哈 森 于学辉 史 茜
(新疆出入境检验检疫局 新疆乌鲁木齐 830063)
1 前言
新孢子虫病是由犬新孢子虫(Neospora Caninum)寄生于牛、羊、犬等多种动物体内引起的一种原虫病。虽然该病是多种家畜共患,但对牛的危害尤为严重,主要造成母牛流产、产死胎以及新生儿的运动神经系统疾病。该病可垂直传播,带虫母牛可将虫体直接传给新生犊牛[1-2]。新孢子虫病呈世界性分布,已成为世界奶牛流产寄生虫病研究的热点[3]。
酶联免疫吸附试验(ELISA)是检测新孢子虫血清抗体的常用方法,目前已有多种检测该病的商品化ELSIA试剂盒,但各品牌良莠不齐,质量如何,目前还没有一个明确的评价。为了保证检测质量,更好的选择适用于实验室检测的试剂盒,本研究用目前国内市场常用的3种试剂盒分别对澳大利亚、新西兰、乌拉圭和我国新疆的牛血清进行了比较检测,以便为试剂盒的选用提供参考。
2 材料与方法
2.1 材料
2.1.1 血清
已知阳性血清、阴性血清各5份:购自美国IDVET公司各2份,3种商业化的ELISA试剂盒自带各1份;
被检血清157份:其中2010年11月从澳大利亚进口牛血清41份,2011年4月从新西兰进口牛血清40份,2011年5月从乌拉圭进口牛血清30份,2010年采自中国新疆46份。
2.1.2 试剂盒
3种商业化的ELISA试剂盒:①瑞典Svanova公司,间接ELISA试剂盒,批号P09566-AG463,适用于检测牛血清或牛奶中犬新孢子虫抗体;②美国IDEXX公司,间接ELISA试剂盒,批号P06662,适用于检测牛血清中犬新孢子虫抗体;③美国VMRD公司,竞争ELISA试剂盒,批号P10302-007,适用于检测牛血清和山羊血清中犬新孢子虫抗体。
2.1.3 主要仪器及耗材
Elx800酶标仪,Eppendorf各型号微量加样器。
2.2 方法
分别进行诊断相对敏感性试验、诊断相对特异性试验、重复性试验、检测低限测定,并对样品进行检测。试验的操作与结果判定均按照试剂盒说明书进行。
2.2.1 诊断相对敏感性试验
本试验除对5份已知新孢子虫阳性血清检测外,还以其中的2个试剂盒检测均为阳性的样品认定为真阳性,用另1个试剂盒进行检测,确定该试剂盒的诊断相对敏感性。
对经3个试剂盒检测均为阳性的4份血清用阴性牛血清进行2的倍数共5个系列的稀释后,每1个稀释度作为1份独立样品进行检测,确定试剂盒的检测低限。
2.2.2 诊断相对特异性试验
本试验除对5份已知阴性血清检测外,还以其中的2个试剂盒检测均为阴性的样品认定为真阴性,用另1个试剂盒进行检测,确定该试剂盒的诊断相对特异性。
2.2.3 重复性试验
选择10份样品进行4次重复检测,计算测定结果的变异系数,确定试剂盒的重复性。
2.2.4 对样品的检测
用3个试剂盒分别对157份牛血清进行检测,比较试剂盒之间的符合率。
3 结果
3.1 诊断相对敏感性试验和诊断相对特异性试验
按以下公式分别计算诊断相对敏感性(DRSe)和诊断相对特异性(DRSp):
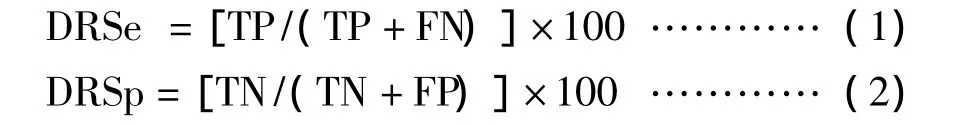
结果见表1、表2、表3,各试剂盒诊断相对敏感性和诊断相对特异性差异显著(P<0.01)。

表1 Svanova试剂盒诊断相对敏感性和诊断相对特异性检测结果

表2 IDEXX试剂盒诊断相对敏感性和相对特异性结果

表3 VMRD试剂盒诊断相对敏感性和相对特异性结果
3.2 检测低限试验
根据试剂盒检测低限试验结果绘制折线图,为了便于比较,IDEXX试剂盒S/P值用百分数表示,结果见图1。

图1 3个试剂盒对4份阳性血清系列稀释后检测折线图
结果显示,对样品1和样品2,IDEXX试剂盒和VMRD试剂盒检测灵敏度基本一致,较Svanova试剂盒检测低限高1-2个滴度;对于样品3,Svanova试剂盒检出限最高,VMRD试剂盒最低,相差2个滴度;对于4号样品,VMRD试剂盒与Svanova试剂盒检出限一致,较INDEXX高1个滴度。从本次检测4份样品来看,难以比较哪个试剂盒具有更高的检出限。
3.3 重复性试验
选择10份样品进行4次重复检测,3个试剂盒变异系数均在10%以内。
3.4 国内外血清样品检测
3.4.1 3个试剂盒对不同国家样品检测结果
用3个试剂盒分别对采自澳大利亚、新西兰、乌拉圭和中国新疆的牛血清进行检测,结果见表4。
结果表明,除VMRD和IDEXX 2个试剂盒对新疆46份血清检测阳性率相同外,3个试剂盒对澳大利亚牛血清阳性检出率较低,从0%至4.9%,对4个国家的牛血清平均阳性检出率分别为6.7%(新西兰)、2.4%(澳大利亚)、26.6%(乌拉圭)和25.3%(中国新疆),不同试剂盒对同一国家样品检测阳性率差异极显著。
同一地区不同试剂盒阳性检出率同行比较,无相同小写字母表示差异极其显著(P<0.01)。

表4 3个试剂盒对不同国家样品检测分类统计
3.4.2 试剂盒符合率检测
对4个国家共157份样品用3个试剂盒分别检测,比较试剂盒之间的符合率,结果表明,Svanova与VMRD 2个试剂盒之间符合率为65.8% -95.1%,对乌拉圭样品检测的符合率较低,对澳大利亚样品检测符合率较高;Svanova与IDEXX 2个试剂盒之间符合率为70.7% -97.6%,对乌拉圭样品检测的符合率较低,对澳大利亚样品检测阳性符合率较高;IDEXX与VMRD 2个试剂盒对4个国家的样品检测符合率均较高,为90.0% -97.6%。见表5。

表5 3个试剂盒对不同地区样品检测符合率分类统计
不同试剂盒对同一地区血清用检测符合率比较,不同大写字母表示差异极显著(P<0.01)。
4 讨论
由于各种商品化的ELISA检测试剂盒质量不一,并且因个体差异等原因,适用于一个国家或地区样品的检测试剂盒,不一定能够适用于另个一国家样品的检测[4]。因此,实验室使用检测试剂盒前,做好评估工作至关重要。敏感性和特异性是评估试剂盒的2个重要指标,所选择的参考动物对所有宿主的代表程度和所检测目标动物群的环境因子,对阐述试验结果有很大影响。本研究以澳大利亚、新西兰、乌拉圭和中国的牛血清作为被检对象,参考标准[5]对国内常用的3种检测新孢子虫血清抗体试剂盒进行了比较检测,所选样品具有一定的代表性。已有报道表明,上述3个试剂盒均具有较好的敏感性和特异性,可作为检测新孢子虫病的有效方法[6-8]。所以,本研究除对5份已知阳性血清和阴性血清外进行检测外,还以其中的2个试剂盒检测均为阴性或阳性的血清定为真阴性或真阳性,用来对另一个试剂盒进行评估,可进一步增加结果的准确性。
对4个国家共157份样品用3个试剂盒分别检测,比较试剂盒之间的符合率。结果表明,各个试剂盒对不同国家样品检测的符合率不同,IDEXX与VMRD 2个试剂盒检测符合率较高;对不同国家的样品而言,3个试剂盒对澳大利亚和新西兰样品检测符合率较高,为90% -97.6%;对乌拉圭样品检测的符合率较低,为65.8% -94.1%。从3个试剂盒操作程序来看,IDEXX和VMRD操作时间较短,从样品稀释开始,整个检测时间约2h,但VMRD采用cELISA,不需样品稀释,可以提高诊断的特异性和敏感性[5,9]。
用3个试剂盒对澳大利亚、新西兰和乌拉圭2010年底至2011年初进口牛血清进行了新孢子虫血清抗体检测。虽然澳大利亚血清用Svanova试剂盒检测为阴性,新西兰血清用VMRD试剂盒检测为阴性,但已有报道表明,澳大利亚和新西兰都有新孢子虫病的发生和流行[10,11]。3个试剂盒对所检测的4个国家血清平均阳性检出率分别为6.7%(新西兰)、2.4%(澳大利亚)、26.6%(乌拉圭)和24.6%(中国新疆),但不同试剂盒对同一国家样品检测阳性率差异极显著。
注:本研究结果只针对本批试剂盒和所采集的样品进行了探索性的研究,结果不作为商业评价标准。
[1]De Oliveira V S,Alvarez-Garcia G,Ortega-Mora,et al.Abortions in bovines and Neospora caninum transmission in an embryo transfer center[J].Vet Parasitol,2010,173(3 -4):206 -210.
[2]Reiterova K,Spilovska S,Antolova,et al.Neospora caninum,potential cause of abortions in dairy cows:the current serological follow - up in Slovakia[J].Vet Parasitol,2009,159(1):1 - 6.
[3]张昌盛,刘群.奶牛新孢子虫病血清流行病学调查[J].中国兽医杂志,2006,42(6):3-5.
[4]徐朝哲.进出境动物检疫手册(第一版)[M].北京:中国标准出版社,2011:200-203.
[5]SN/T 2435-2010出入境动物检疫诊断试剂盒质量评价规程[S].
[6]Timothy V,Bruce A M.Validation of a commercially available monoclonal antibody-based competitive-inhibition enzymelinked immunosorbent assay for detection of serum antibodies to Neospora caninum in cattle[J].J Clin Microbiol,2001,39(11):3851-3857.
[7]Williams D J L,Davison H C,Helmick B,et al.Evaluation of a commercial ELISA for detecting serum antibody to Neospora caninum in cattle[J].Veterinary Record,1999,145(20):571-575.
[8]Jenny Frosslinga,Ann Lindberg,Camilla Bjorkman,et al.Evaluation of an iscom ELISA used for detection of antibodies to Neospora caninum in bulk milk[J].Preventive Veterinary Medicine,2006,74(2 -3):120 -129.
[9]Juko U,Kazunori IKE,Tetsro K.Monclonal antibodies prevention invasion of Nespofa caninum tachyzoites in host cells[J].J Vet Med Sci,2001,66(11):1355 -1358.
[10]Wouda W,Bartels C J M,Moen A R,et a1.Characteristics of Neospora caninum-associated abortion storms in dairy herds in the Netherlands(1995 to 1997)[J].Theriogenology,1999,52(2):233-245.
[11]罗洪林,黄雏义,夏萌.新孢子病研究概况[J].中国动物检疫,2004,21(12):42 -44.

