SIVmac239感染恒河猴急性期回肠派氏淋巴结中淋巴细胞亚群的变化
刘克剑,丛喆,吴芳新,王卫,熊竞,魏强,秦川
(中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京100021)
SIVmac239感染恒河猴急性期回肠派氏淋巴结中淋巴细胞亚群的变化
刘克剑,丛喆,吴芳新,王卫,熊竞,魏强,秦川
(中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京100021)
目的分析SIVmac239感染早期中国恒河猴回肠派氏淋巴结淋巴细胞数量及亚群的变化,探讨这些变化与疾病进展的可能关系。方法以静脉注射SIVmac239制备恒河猴AIDS模型,对回肠派氏淋巴结进行CD4和CD8免疫组化标记,分离Peyer’s集合淋巴结淋巴细胞,分别标记CD3、CD4、CD8、CD28、CD95单克隆抗体,以流式细胞仪检测T细胞及其亚群的表达情况。结果SIVmac239感染急性期中国恒河猴Peyer淋巴结中CD4+/CD8 +比值持续下降,记忆性细胞比例升高,但Peyer淋巴结形态及CD4+T细胞数量未见明显变化,CD8+T细胞从第5天开始持续升高。结论SIVmac239感染急性期,中国恒河猴回肠派氏淋巴结形态及CD4+T细胞数量基本维持,向记忆性细胞的转化增加,但是CD4+/CD8+比值下降。
AIDS;派氏淋巴结;T淋巴细胞;恒河猴
在我们长期进行的灵长类艾滋病动物模型研究中发现,不同动物疾病进程表现不十分一致,除了个体遗传差异等因素影响,也可能与病毒早期和机体相互作用相关,因此,了解肠道粘膜组织在AIDS发病过程中的重要作用对疾病的发生、发展至关重要。
肠道粘膜组织的免疫系统主要由两部分构成,分别是免疫诱导部位,主要是有结构的淋巴组织,如派氏淋巴结(peyer’s patch,PP)和免疫效应部位,主要是分布在粘膜固有层中弥散的淋巴组织。目前AIDS研究中关于粘膜部分主要集中在固有层,而派氏淋巴结的资料相对较少,缺乏系统性研究。据文献推测艾滋病病毒的宿主侵入、早期控制、疾病转归等与PP直接相关。基于此,本文对SIVmac239感染早期的中国恒河猴回肠肠道PP中免疫细胞数量及分群的变化做初步研究,分析可能的对疾病进程的影响。
1 材料和方法
1.1 实验动物与模型制备
健康恒河猴9只,购自北京协尔鑫生物资源研究所(合格证编号:SCXK(京)2005-2005),实验前体重为3~5 kg,动物实验在本所P3实验室进行[SYXK(京)2009-0003];实验动物经IFA法检查排除猴免疫缺陷病毒(SIV)、猴逆转录D型病毒(SRV-1)和猴T淋巴细胞性I型病毒(STLV-1)的感染。其中猴489、3-2、3-3、3-4、3-5静脉感染1000 TCID501mL SIVmac239,其余4只作为正常对照,定期采样,测定血浆病毒载量及细胞变化。
1.2 样品采集
1.2.1 外周血分别于感染前及感染后第0,7,14,28天采集实验猴EDTA抗凝血,测定血浆病毒载量、血常规及流式检测[1]。
1.2.2 肠道组织采集及病理制片分别于第0,1,3,5,7,14天剖腹手术截取10 cm回肠肠段(0 d取4只动物,其余时间点一只),分离PP淋巴细胞,其余经4%中性甲醛固定24 h,修块,4%福尔马林再固定24 h,包埋、切片。
1.2.3 PP淋巴细胞分离肠段纵向剖开,解剖镜下用眼科剪剪下派氏淋巴结[2],置于预冷的含5%胎牛血清的PRMI-1640(R-5)培养基中。剪碎,用冷的PBS(不含钙镁离子)冲洗两次。研磨,70 μm孔径细胞筛过滤(BD,Cat#352350)。4℃2000 rpm离心10 min,重悬,调整细胞浓度为1×106cell/mL。
1.3 免疫组化
组织切片用抗CD4、CD8抗体进行标记。具体步骤如下:PBS冲洗,2 min×3次。滴加一抗,37℃孵育2 h,PBS冲洗,2 min×3次。滴加试剂1(中杉金桥,PV-9000),37℃孵育20 min,PBS冲洗,2 min ×3次。滴加试剂2(中杉金桥,PV-9000),37℃孵育20 min,PBS冲洗,2 min×3次。DAB溶液显色。自来水充分冲洗、复染、脱水、透明、封片,镜下观察,计数(每个样本取3个高倍视野,计算平均值)。
1.4 流式检测
取细胞悬液100 μL,置于流式管中,标记抗CD3、CD4、CD8、CD28,CD95抗体,室温避光作用15 min。用10%胎牛血清RPMI 1640培养基洗2次,悬浮于500 μL的pH7.2 PBS中,BD FACA-CANTO FACS仪上分类计数。
2 结果
2.1 SIVmac239感染猴血浆病毒载量结果
血浆病毒载量结果显示,全部攻毒的动物在攻毒后第7天可检测出血浆病毒载量,载量峰值位于1×105到1×107copies/mL之间,表明这些动物在实验进行中的28 d内被病毒感染并且病毒能进行有效复制。
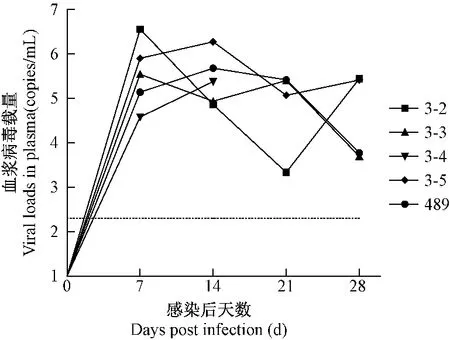
图1 SIVmac239感染猴血浆病毒载量结果Fig.1The changes of viral loads in plasma of SIVmac239-inoculated rhesus monkeys
2.2 SIVmac239感染猴肠道PP淋巴结CD4+T淋巴细胞免疫组化结果
0 d结果显示,健康中国恒河猴派氏淋巴结滤泡中心发育完好,CD4+细胞主要分布于淋巴鞘,在滤泡中心也有零星分布,大小正常,形态完整;感染猴在SIVmac239感染后1,3,5 d派氏淋巴结与正常恒河猴派氏淋巴结一样T细胞分布于淋巴鞘,形态完整,CD4+T淋巴细胞在局部细胞密度与正常对照组未见明显区别(彩插5图2 A,C)。7,14 d派氏淋巴结中心区域淋巴细胞有所增加,CD4+T淋巴细胞在局部细胞密度有所增大(彩插5图2 A,C)。CD8+细胞主要分布于淋巴鞘,在滤泡中心也有零星分布,大小正常,形态完整;数目随时间增加而增多(彩插5图2 D)。
2.3 SIVmac239感染猴肠道PP淋巴结CD4+/ CD8+T细胞比值的变化
在SIVmac239感染后,免疫组化计数结果:动物的PP CD4+/CD8+T细胞比值减少。由感染前的0.90左右降到感染后5 d的0.55,第7天为的0.39,第14天为0.37(彩插5图2 A)。流式细胞检测结果:动物的PP CD4+/CD8+T细胞比值减少。由感染前的1.00左右降到感染后5 d的0.25,仅为正常值的25%,第7天为正常值的40%,第14天仅为正常值的3%(彩插5图2 B)。
2.4 SIVmac239感染猴回肠派氏淋巴结中记忆性T细胞的变化
恒河猴感染SIVmac239早期PP淋巴结中Naive CD4+T细胞所占的比例随着时间有所增加,从正常的27%升至第14天的85.5%。同时伴随着TCM的持续下降,从正常恒河猴的71.5%下降至第5天的53.1%,第14天时更是降至9.5%。
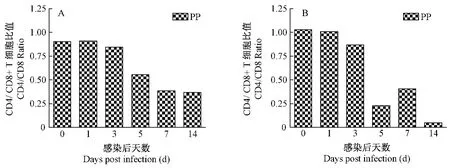
图3 SIVmac239感染后急性期不同天数回肠内PP CD4+/CD+8比值
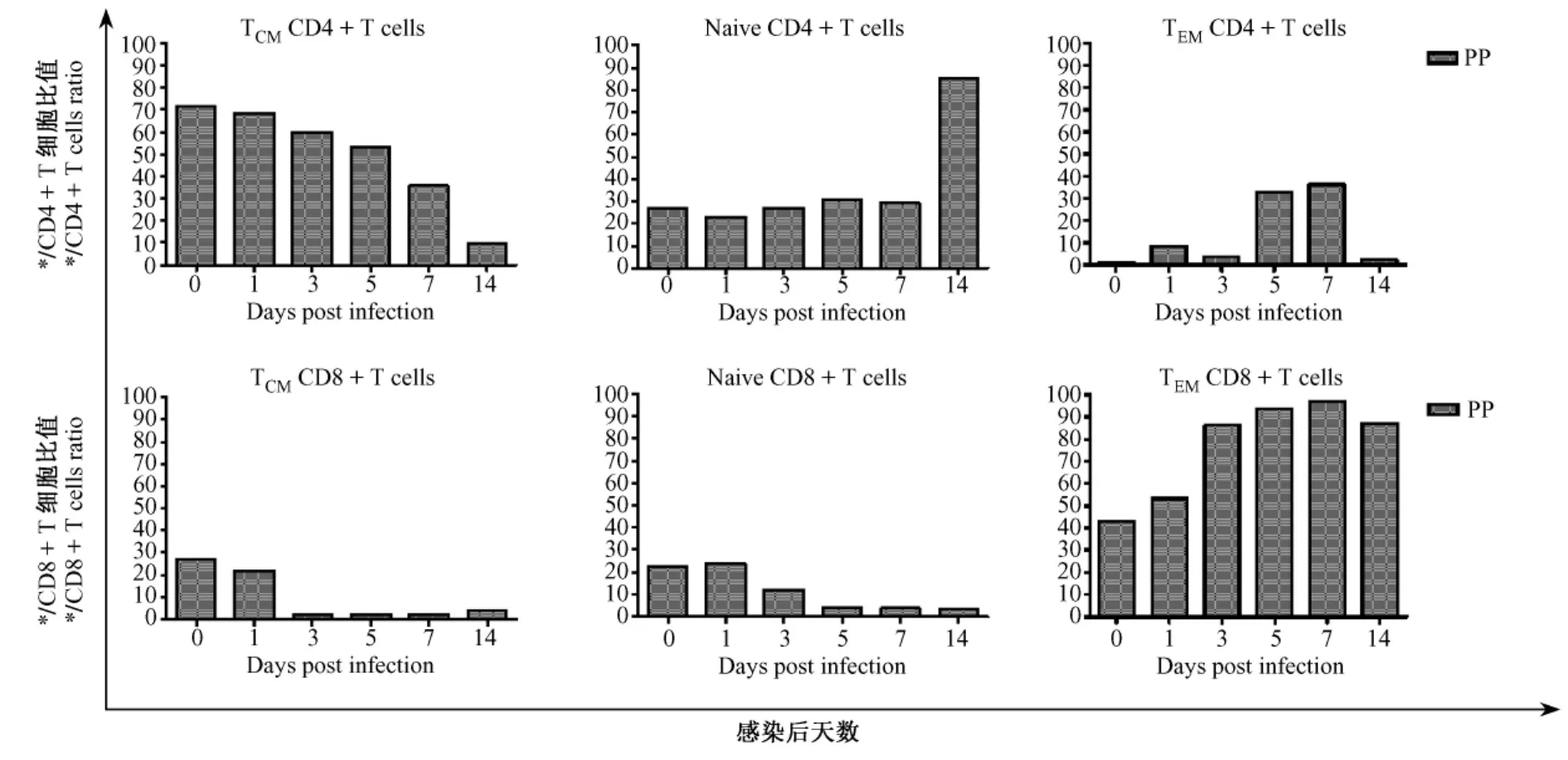
图4 SIVmac239感染急性期恒河猴回肠PP,CD4+/CD8+T Naïve与记忆性CD4+/CD8+T比例的变化Fig.4The changes of Naïve,Tcm,Tem,CD4+/CD8+T cells in PP of Chinese-origin rhesus monkeys infected intravenously with SIVmac239
与此相反,正常猴回肠PP淋巴结中TEM仅占1%左右,感染后略有增加,在5 d、7 d达到峰值,约为30%到40%,到第14天时则重新下降至2.3%。
Naive CD8+T比例第3天下降至正常值(22.2%)的一半左右,之后持续下降,一致维持至14 d均无明显变化;TcM与Naive情况相似,感染后3 d即从正常的27.3%降到2.0%,持续到14 d; TEMCD8+T细胞在7 d内比例逐渐升高(43%-97%),到14 d一直维持在较高水平。
3 讨论
消化道是HIV及其相关病毒的侵犯目标,HIV在消化道粘膜中攻击目标主要是CD4+T淋巴细胞,在整个感染过程中起着重要作用,与外周血液相比,一般认为在感染过程中,粘膜CD4+T淋巴细胞的损耗出现得更早、更剧烈,肠道中最丰富的CD4 +T淋巴细胞存在于肠道固有层并且多处于激活状态,所以感染及消耗的细胞也主要在固有层。固有层之外,肠道内的效应部位,PP由于其结构与功能均与固有层有所不同,所以派氏淋巴结内的CD4 +T细胞在感染初期的表型与形态与固有层也是否有所区别,为本文关注内容之一。
PP是沿小肠纵向分布,位于粘膜下层,肉眼可见的微小的集合淋巴组织[3]。在一般情况下,PP集中于小肠末端部分(特别是回肠),PP由上皮下圆顶区、滤泡区和滤泡旁区组成。T细胞位于滤泡旁区,主要为CD4+T和CD8+T细胞,表达T细胞受体,其中有中心记忆性和初始T淋巴细胞[4,5]。
在免疫反应中,首先,初始T细胞进入PP,成为记忆/效应性T细胞后,从PP粘膜通过传出淋巴结和外周血移植向效应部位[6]。HIV优先感染激活的CD4+T细胞,根据效应部位与诱导部位的差异,在感染早期,粘膜CD4+T细胞的严重损耗,但本文对感染早期PP的免疫组化及流式检测表明,PP中CD4+T细胞的减少及破坏在SIVmac239感染的14 d内程度是很轻微的,如图2所示。虽然流式结果显示在感染早期PP CD4+/CD8+T淋巴细胞比值有所下降,这提示了在CD4+数目没有明显降低的情况下,CD8+T细胞的数目增多,针对PP CD8+细胞的免疫组化结果支持这一推断,如图3。所以CD4+T细胞的稳定与CD4+/CD8+T淋巴细胞比值的下降不矛盾。某些研究发现,HIV感染晚期在派氏淋巴结中有与其他淋巴组织类似的T细胞变化,主要是CD4+T细胞数目的减少。结合感染初期PP中CD4+T淋巴细胞相对完好的状况,如果能有效减缓PP中CD4+T细胞的损耗将有助于延缓AIDS的进程。
HIV-1感染后的T细胞免疫应答在感染早期,至少在感染之后的10 d内,机体外周血中检测不到明显的T细胞应答,病毒在这段时间内大量扩增,在不同的靶细胞中潜伏,为病毒的长期持续性感染奠定了基础。感染10 d后(2~3周),随着病毒的进一步扩增,产生大量的T细胞免疫反应,病毒载量随着CD8+T细胞免疫反应的出现与升高开始下降,并逐步到达一个稳定点(set point)。与此相似,来自恒河猴外周血的数据也表明,针对SIV的外周血特异性T细胞应答主要发生于感染14天以后[7]。但在SIVmac239感染早期的恒河猴回肠PP中,7 d之内既能检测到活跃的细胞免疫应答,表现为效应记忆性CD4+T和CD8+T淋巴细胞比例的逐步升高,说明在感染很早期病毒复制活跃的部分(比如肠道粘膜)已经有活跃的免疫应答,血液中检测结果的延迟说明血液可能并不是了解病毒感染早期机体生物事件的有效窗口。目前有关于粘膜的研究,比如对粘膜固有层的研究表明,固有层含有各种表型的T细胞,包括大量的CD4+T细胞,在正常的人类及非人灵长类当中,固有层CD4+ T细胞与CD8+T细胞的比率与外周血及淋巴结相似,但粘膜中表达CCR5的CD4+T细胞比例更大,拥有记忆表型并表达细胞激活的标志物,并且大部分CD4+T细胞也在原位产生细胞因子,提示这些细胞是激活的并最终分化的细胞,也是HIV/SIV感染的极好靶标。所以在固有层,感染3~4 d后即可检出大量的受感染细胞,并且SIV感染猴的粘膜效应位点CD4+T细胞剧烈而迅速的损耗[3]。作为目前研究AIDS最实用的模型,SIV感染恒河猴肠道组织中早期T细胞免疫反应的变化为研究HIV感染者疾病的发生发展规律提供了线索。
而同样作为粘膜免疫系统的构成部分,免疫诱导部位的PP,其CD4+T细胞数目变化与固有层相比却在急性期未见明显变化。而在免疫表型方面,由于HIV-1可优先感染HIV-1特异性CD4+T细胞,随着病情的进展,HIV-1特异性CD4+T细胞会逐渐减少乃至完全耗竭。HIV-1特异性CD4+T细胞的主要功能在于维护HIV-1特异性CD8+T细胞的功能上,而不是在直接抗击HIV-1中。既往的研究也表明,CD4+T细胞在CD8+T细胞免疫反应的激活,记忆性CD8+T细胞的维持以及CD8 +T细胞的功能成熟等过程中起重要的作用。相应地,HIV-1感染所导致CD4+T细胞的耗竭,可导致HIV特异性的记忆CD8+T细胞的成熟障碍以及HIV-1特异性CD8+T细胞的功能受损[8-9]。如图3所示,效应记忆性CD8+T细胞在感染14d后在PP中比例的下降与效应记忆性CD4+T细胞的下降趋势相同,且效应记忆性CD4+T细胞下降比例更为明显,从侧面证明,在感染早期的PP效应记忆性CD4+T细胞的丢失可能是导致效应记忆性CD8+T细胞比例下降的原因。
综上所述,关于SIV感染急性期不同时间PP淋巴细胞的变化,目前尚未见相关报道。本研究中正常对照组中国恒河猴PP中CD4/CD8细胞约等于1。与正常对照组相比,SIVmac239感染的中国恒河猴PP中CD4/CD8+T细胞比值显著降低,但同时PP中CD4+T细胞的数量及形态几乎没有变化,而同时期其它研究表明固有层中的CD4+数量急剧下降且大量凋亡及坏死,说明在感染急性期PP中的CD4+可能得到循环血中T细胞的补充,从而维持其形态及功能。因此PP中CD4+T细胞数量和功能在感染早期对维持粘膜局部的免疫功能发挥影响。SIVmac239感染急性期PP中CD4+T细胞数量及形态的维持,以及向记忆性表型的转化提示,PP在感染早期对补充因感染损失的淋巴细胞起重要作用,同时,对病毒及机体相互作用后最终造成不同感染程度可能产生一定影响。
[1]丛喆,李兆忠,魏强等.SYBR Green I实时荧光定量RTPCR测定猴免疫缺陷病毒(SIV)RNA拷贝数方法的建立[J].中国实验动物学报,-2006,14(4):271-275.
[2]Michael Vajdy,Ronald S.Veazey,Heather K.Knight et al.Differential effects of Simian Immunodeficiency Virus infection on immune inductive and effector sites in the rectal mucosa of rhesus macaques[J].Am J Pathol,2000,2(157):485-495.
[3]Makala LH,Suzuki N,Nagasawa H.Peyer’s patches:organized lyniphoidstrueturesfortheinductionofmucosalimmune responses in the intestine[J].Pathobiology,2003,70(2):55-68.
[4]Picker LJ,Watkins DI.HIV pathogenesis:the first cut is the deepest[J].Nat Immunol,2005,6(5):430-432.
[5]Veazey RS,DeMariaM,ChalifouxLV,etal.The gastrointestinal tract as a major site of CD4+T cell depletion and viral replicationin in SIV infection[J].Science,1998,280 (17):427-431.
[6]Horton H,Vogel T,O’Connor D,et al.Analysis of the immune response and viral evolution during the acute phase of SIV infection[J].Vaccine,2002,20(15):1927-1932.
[7]Shacklett BL,Ling B,Veazey RS,et al.Boosting of SIV-specific T cell responses in rhesus macaques that resist repeated intravaginal challenge with SIVmac251[J].AIDS Res Hum Retroviruses,2002,18(14):1081-1088.
[8]Maziana SK.LiuCH,TzianabosAO,eral.An immunomodulatorymoleeuleofsylnblotiebacteriadirects matturation of the host immununesystem[J].Cell,2005,122 (l):107-18
[9]Rakoff-Nahoum S,PaglinoJ,Eslami-VarzanehF,Edberg SRecognition of commensal microflora by toll-like receptors is required for intestinal homeostasis[J].Cell,2004,118(2): 229-41
The Changes of Lymphocytes from Ileum Peyers Pacth from Rhesus Monkeys at the Earliest Period with SIVmac239 Infection
LIU Ke-jian,CONG Zhe,WU Fang-xin,WANG Wei,XIONG Jing,WEI Qiang,QIN Chuan
(Key Laboratory of Human Diseases Comparative Medicine,Ministry of Health;Institute of Medical Laboratory Animal Science,Chinese Academy of Medical Sciences;Key Laboratory of Human Diseases Animal Models,State Administration of Traditional Chinese medicine,Beijing 100021,China)
ObjectiveTo analyze the changes of lymphocytes from ileum Peyers pacth from Chinese rhesus monkeys at acute period with SIVmac239 infection.Methods9 rhesus monkeys were used and 5 were infected with SIVmac239 via intravenous injection.The tissues or lymphocytes from ileum Peyers pacth lymph nodes from rhesus monkeys at acute period were collected and analyszed with CD4+,CD8 immunohistochemistry and flow cytometry T-cell subsets labeling with CD3,CD4,CD8,CD28,CD95 monoclonal antibodies respectively.ResultsObviously declined CD4+/CD8+ratio and increased memory cells(CD4+&CD8+)ratio and CD8+T cells were detected in Peyers lymph nodes,but CD4 counts had no significant change in Peyers lymph nodes.ConclusionDeclined CD4+/CD8+ ratio and increased memory cells(CD4+&CD8+)ratio were found in Peyers lymph nodes from rhesus macaques at acute period with SIVmac239 infection,however,the meaning and possible affection to disease need further study.
AIDS;Peyer’s Patch;T cell;Reshus monkeys
R373.33R332
A
1671-7856(2012)06-0025-05
10.3969/j.issn.1671-7856.2012.06.007
2010-08-20
“十二五”国家科技重大专项课题(2012ZX10004-501);协和青年基金(SIV感染早期粘膜屏障结构的改变)。
刘克剑,男,博士生,从事实验动物病毒学研究工作。
秦川,教授,博士生导师,研究方向:重大传染病发病机制。E-mail:qinchuan@pumc.edu.cn。
魏强,教授,博士生导师,研究方向:艾滋病模型及应用。E-mail:weiqiang@cnilas.pumc.edu.cn。

