非晶态Pt壳层Ni@Pt纳米粒子的甲醇电催化氧化动力学
刘世斌,马艳华,卫国强,张忠林,郝晓刚,段东红
(太原理工大学 洁净化工研究所,太原 030024)
非晶态金属原子排列的无序性使其表面原子具有配位不饱和度高、键位密度大的特点,十分有利于反应分子的配位吸附,且能够有效防止晶态金属结构常有的崩塌现象,是一种高活性高稳定性的催化材料,因此受到了人们广泛的关注[1-2]。
目前,人们已经通过多种方法制备了非晶态金属纳米粒子。Baiker等人[3]制备了Pd-Zr非晶态纳米合金,并将其用于CO氧化反应,在反应过程中锆被氧化为ZrO2,实验证明非晶态合金活性比通过注入法制备的Pd-ZrO2合金提高了1个以上的数量级,非晶态合金对于CO的高氧化活性主要归因于其较大的比表面积,以及O与缺陷组分之间的紧密联系。T.Martinek等人[4]在研究非晶态Cu-Zr合金在丙醇氧化脱氢过程中发现,在催化过程中Cu的表面积增加了约1个数量级,1-丙醛的形成与Cu0的数量有关。Van Wonterghem等人[5]用化学还原法制备了非晶态合金Ni-P,其催化活性和选择性都远较晶态的纳米Ni高得多,以至于极易被空气氧化失活。
已有的非晶态金属催化剂的研究主要集中于含有B、P、Zr元素的纳米合金粒子,而单质的非晶态纳米金属却极难获得,有关电催化性能的研究鲜见报道。另外,由于合金本身对金属的性能要求较高,既不能被空气氧化而失去活性,也不能在溶液中被溶解,所以许多活泼金属受到了限制。核壳型纳米金属在这方面具有很大的优势。单亚拿等人[6]用化学镀法合成了核壳型的Fe@Ni纳米复合粉体,壳层金属Ni-P呈非晶态,壳层金属的保护作用减弱了Fe纳米粒子的氧化程度,提高了金属稳定性。
本文结合非晶态金属和核壳型纳米金属的优点,利用连续化学还原法制备了非晶态金属壳层的核壳型纳米粒子,并通过电化学法对其甲醇氧化动力学过程进行了研究。
1 实验部分
1.1 催化剂的制备
以制备Ni10Pt1样品为例。首先将0.0475g六水氯化镍和0.2625g四辛基溴化铵加到10mL四氢呋喃溶剂中。在超声波震荡器中均化30min,待氯化镍完全溶解后,以一定速度加入5.5mL三乙基硼氢化锂,溶液随即变成黑色,表明此时形成了镍纳米粒子。待反应30min之后,将一定比例的氯化铂溶液缓慢滴加到上述溶液中,继续恒温反应1 h,Ni@Pt纳米粒子形成。将制得的悬浊液置于高速离心机6000r/min下进行固液分离,去掉上清液留下沉降物,用四氢呋喃重新分散,再次离心分离,再去掉上清液留下沉降物,如此反复2次。此后用乙醇按上述步骤反复洗涤3次,洗涤后的黑色粉末放入真空干燥箱80℃干燥12h,转至管式炉于N2和H2气氛中400℃ 热处理1h,自然冷却至室温,所得黑色粉末即为Ni@Pt核壳型纳米粒子。最后,将纳米粒子用玛瑙研钵充分研磨后,置于干燥器中保存备用。其它比例的纳米粒子NixPty(其中,x∶y是Ni和Pt的原子数比,x=2,5,15,20;y=1)可通过改变PtCl2的加入量来制取。
1.2 工作电极的制备
使用前将玻碳电极表面用Al2O3悬浮液研磨5 min,然后依次用丙酮、双氧水以及乙醇清洗以除去电极表面的杂质,然后60℃下烘干备用。称取2mg催化剂和3mg XC-72碳粉,加入5mL超纯水,用超声波细胞粉碎器超声均化为均匀的悬浊液。用移液器移取6.0μL悬浊液涂覆于清洁的玻碳电极表面,60℃下烘干,再在催化剂表面覆盖7.2μL质量浓度为0.275g/L的Nafion溶液,最后放于干燥箱中80℃烘干,制得薄膜工作电极。
1.3 催化剂的物理表征
采用北京电子显微镜中心型号为Titan 80-300的球差校正透射电子显微镜(aberration-corrected HRTEM)观察颗粒的形貌及微观结构,分辨率为0.08nm,加速电压为300W。采用日本Rigaku公司生产的型号为D/max-2500型X射线衍射仪(XRD)测定颗粒的晶形结构,辐射源为Cu Kα(λ=0.154056nm),管电压为40kV,管电流为100 mA,扫描速度(2θ=5o~85o)为:8(°)·min-1。采用美国LEO438VP型X射线能谱分析(EDS)测定颗粒的元素组成及比例,电子束电流密度为40A/cm2,加速电压100kV。采用 VG Scientific ESCALab 250i-XL型X射线光电子能谱仪(XPS)测定颗粒表面元素组成及价态,激发源为Al KαX射线,功率约300W,扫描时的步长为0.05eV。
1.4 催化剂的电化学表征
电化学测试是在三电极体系中进行,电化学工作站的型号是VMP-2多通道电位仪,工作电极是直径为6mm的玻碳电极,对电极为铂片,参比电极为Hg/Hg2SO4(MSE)。甲醇电催化氧化反应的电解质溶液为0.5mol/L H2SO4+x mol/L CH3OH(x=0.2,0.5,1.0)溶液,以市售E-TEK 40%碳载铂催化剂作为实验对比样品。测试前向电解液中通氮气30min,以除去溶解氧和CO2,所有实验均在25℃下进行。
2 结果与讨论
2.1 Ni@Pt的物理表征结果
图1-a为Ni15Pt1单个颗粒的Aberration-corrected HRTEM照片。由图可以看出,所制样品的结构为核壳型,中间深色部分为核芯,周边浅色部分为壳层,核芯的直径约为10nm,壳层的厚度约为1~2nm。图1-b为图1-a的快速傅立叶变换图(FFT),从图中可以看出明显的“光晕”,说明在颗粒的整体表面上金属呈非晶态。图1-c和1-d是图1-a中所选区域的反傅立叶变换图(Inverse FFT),可以清楚地看出,晶格条纹不连续,错乱排列,图1-d中还可以看出许多不同晶格条纹的原子簇。上述图片表明,通过连续两步还原法能够制备出非晶态金属核壳型纳米粒子。主要原因可能是受Ni晶格的影响,在Pt原子组装初期既不能够按照Ni晶格的方式排列,也不能够按照金属Pt晶格的方式排列,只能形成小尺度的原子簇,这些原子又以混乱的方式排布,并不能够形成有序状态,另外,反应温度较低,这种亚稳状态能够稳定存在,从而呈无序的状态。
图2是不同原子数比的Ni@Pt核壳纳米粒子的 XRD图谱。谱图在44.3°,51.7°,76.4°三处的衍射峰分别对应于(fcc)Ni(111)、(200)和(220)晶面的衍射峰,在39.9°和46.8°处的峰分别为 Pt(111)和Pt(200)晶面衍射峰。随着Pt含量的减少,Pt的晶体衍射峰强度逐渐减小,当Ni与Pt原子数比大于10后,图中几乎观察不到Pt的衍射峰,结合HRTEM测试结果分析,原因可能是壳层Pt呈现为非晶态。但当原子数比小于5时出现Pt的晶体衍射峰,说明随着Pt含量的增加,壳层金属Pt逐渐以晶态形式存在。从图中还可看出,随着壳层厚度的逐渐减小,Ni的晶体衍射峰发生了微小负移,这可能因为Ni对Pt的电子诱导效应随着壳层厚度的减小而增强,使得Ni的晶格膨胀,晶体体积变大。
表1为不同原子数比的Ni@Pt纳米粒子的EDS测试结果。从表中可以看出,三个样品里都只含有Pt和Ni两种元素,没有其它的元素。纳米粒子中Ni与Pt的实测原子数比值与理论比值呈相同的变化趋势,并且测出的Ni和Pt的原子数比与前驱体原子数比相近。因EDS探测深度约为6~10 nm,所测数据是粒子整体的原子数比。

图1 Ni15Pt1纳米粒子的Aberration-corrected HRTEM照片
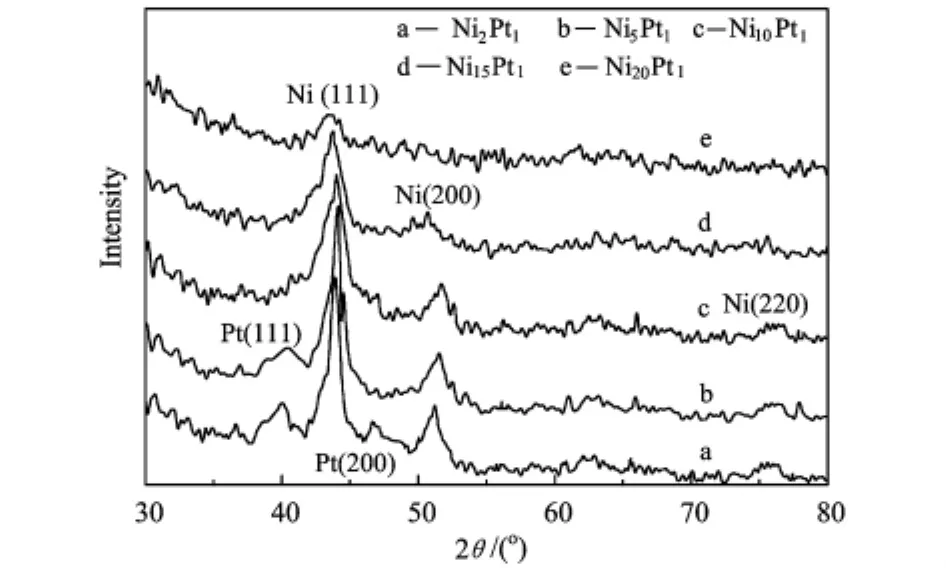
图2 Ni@Pt纳米粒子的XRD谱图
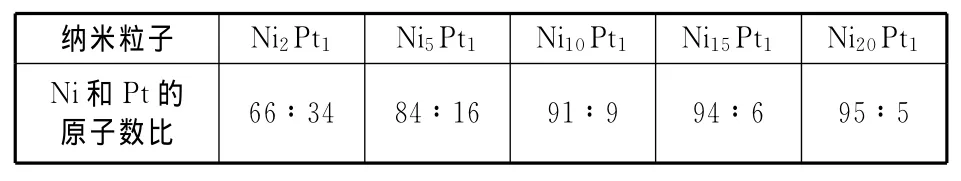
表1 Ni@Pt纳米粒子的EDS测试结果
表2是Pt 4f结合能及不同价态Pt的原子数比。可以看到,5个样品的表面Pt0和Pt2+的原子数比随着Pt壳层厚度的减小按晶态和非晶态壳层呈现出两种趋势,晶态壳层呈逐渐上升的趋势,而非晶态壳层呈下降的趋势。这是因为,随着Pt含量的减小,壳层厚度变薄,核芯Ni对壳层Pt产生的电子诱导效应变大,Ni的价电子向Pt价电子轨道层转移,壳层Pt的电子密度增大,表面的Pt0含量相对提高,而Pt2+的含量相对降低。对于非晶态金属Pt壳层样品,本应随Pt壳层变薄,电子诱导效应增强达到最大,Pt0含量相对增大,但事实却相反,这可能与非晶态Pt的原子簇结构、尺度、电子态等方面有关,当壳层变很薄时,原子簇的平均原子数减小,尺度减小,含Ni核芯电子效应的影响范围受Pt原子簇的阻滞作用较快衰减,因而出现了Ni和Pt原子数比为15∶1的样品的Pt0含量高于Ni和Pt原子数比为20∶1的样品。从Ni和Pt的原子数比来看,XPS测得的Ni和Pt原子数比明显比EDS测得的值要低,这是因为颗粒的粒径较小,EDS测得的Ni和Pt的原子数比是纳米粒子的整体原子数比,XPS测得的Ni和Pt的原子数比是颗粒近表层的原子数比,两组数据的差异进一步证明,实验所制样品是Ni@Pt核壳型纳米粒子。
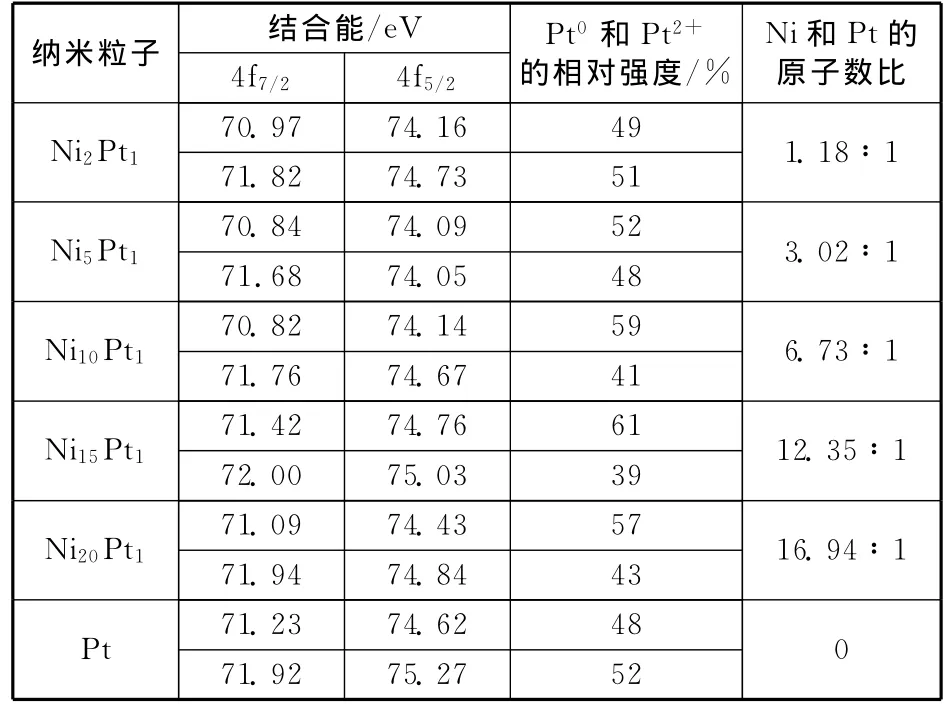
表2 Ni@Pt纳米粒子的Pt4f的电子结合能与Ni和Pt原子数比
2.2 原子数比对Ni@Pt纳米粒子上氧吸附电量影响
根据不同纳米粒子在硫酸溶液中的循环伏安图计算出在0.00~0.47V范围内的氧吸附峰面积,结合扫描速率可得出电量Qa,数据见表3。因为在低指数面上,铂表面的活性位与氧的吸附面积成正比,所以可以预测出纳米粒子之间在电化学活性位数量上的关系[7]。我们知道,若以质量为计算基准得出的电流密度会明显受到取样误差的影响,因此,本文衡量不同纳米粒子的甲醇电氧化催化活性将以电量Qa(类同于活性比表面积)为基准。
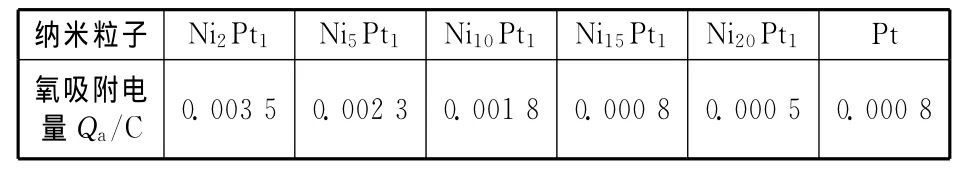
表3 硫酸溶液中Ni@Pt纳米粒子上氧吸附电量Qa
2.3 Ni@Pt纳米粒子上甲醇氧化的Tafel常数
图3是甲醇电氧化正向峰电位EP与lnv的关系图。在整个电极反应过程中,无明显的逆向还原峰,随着扫描速度的增加,正向氧化峰电位发生正移,这一结果说明了甲醇在电极上电催化氧化过程为完全不可逆的电极反应。不可逆过程EP与lnv符合以下关系[8-10]:
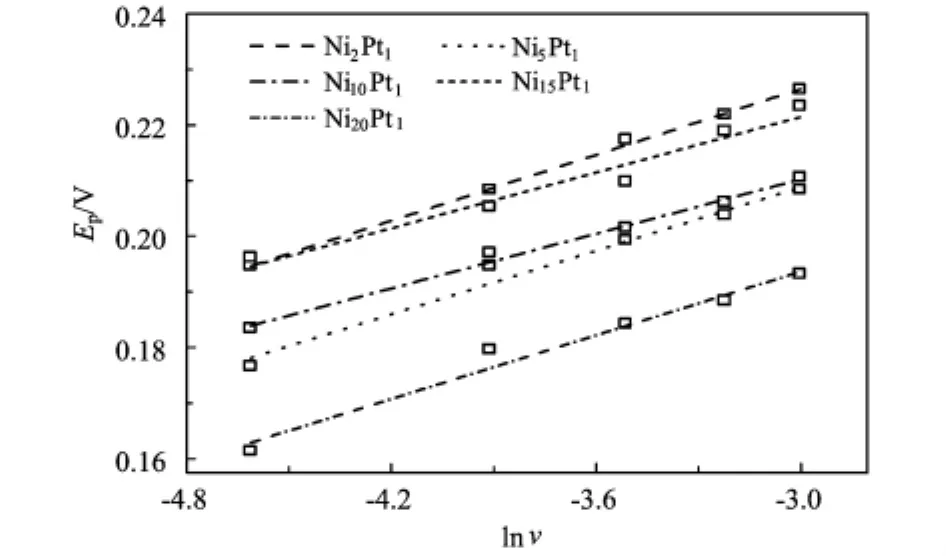
图3 不同纳米粒子上甲醇电氧化峰电位EP对lnv的关系曲线

式中:EP为峰电位,即正向峰电流所对应的电位;α,ρ为传递系数;D为电极反应扩散系数;v为扫描速度;n电极反应中的电子数;F为法拉第常数;R为气体常数;k0为标准速率常数。
由塔菲尔斜率b=2.3RT/αnF可得:
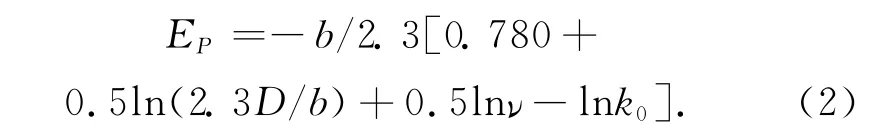
由图3可求出电极反应的Tafel斜率b,见表4。
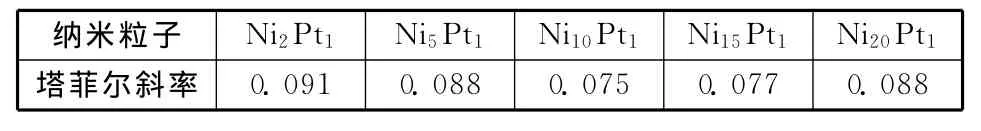
表4 Ni@Pt纳米粒子上甲醇电氧化的Tafel常数
由表4可以看出,不同Pt壳层厚度的纳米粒子的Tafel斜率不同,由Tafel半经验公式ηact=a+blgJ可知,斜率b越小,活化过电位随着电流密度的增大而增加的幅度就越小。由实验数据计算的b值见表4,表中可以看出,随着壳层厚度的减小,晶态壳层Pt纳米粒子b值呈下降趋势,这是因为核芯Ni对壳层Pt的电子诱导效应增强,Pt0的比例升高,Pt的电子态密度增大,有利于反馈键的形成,从而降低了中间物COads的吸附能,降低了COads氧化活化过电位;而非晶态壳层Pt纳米粒子b值呈升高趋势,在Ni和Pt原子数比为10∶1和15∶1时,电子效应达到最佳,b值达到最小,这是因为随着Pt含量的减少,核芯表面Pt原子簇的平均原子数减小,尺度也减小,Ni核芯对Pt的电子效应的影响范围也逐渐减小,当Ni与Pt的原子数比进一步达到20∶1时,电子效应影响范围急剧减小,Pt0的比例趋同于Ni2Pt1,使得b值大幅度升高。从整体上看非晶态纳米粒子的b值比晶态纳米粒子的要低,而且非晶态纳米粒子在Ni与Pt的原子数比适宜时,才能表现出高的活化能力。
2.4 Ni@Pt纳米粒子上甲醇电氧化的反应级数
图4为甲醇浓度与氧化峰电流密度的对数关系图,纵坐标的电流密度是以表3中的Qa为基准得出来的。从图中可以得出甲醇的反应级数,见表5。
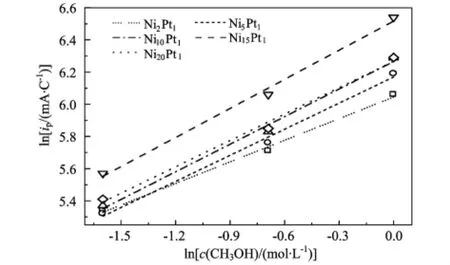
图4 甲醇浓度与氧化峰电流密度的对数关系
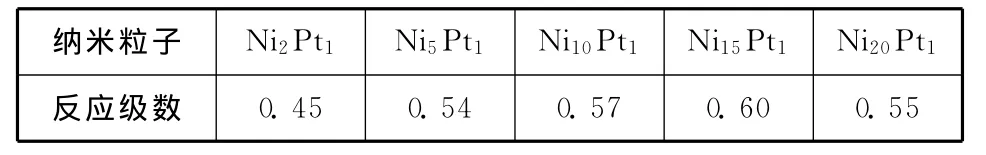
表5 Ni@Pt纳米粒子上甲醇电氧化反应级数
Wu等人[11]发现甲醇在Pt催化剂上反应过程中的控制步骤是含碳中间物与含氧中间物种相互作用,通过脱H后生成最终产物,即:
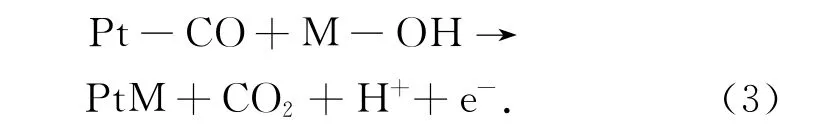
由表5可以看出,晶态壳层Pt纳米粒子反应级数呈上升趋势,这是因为核芯Ni对壳层Pt的电子诱导效应随着壳层厚度的减小而增强,Pt0含量升高,Pt的电子态密度增大,有利于反馈键的形成,从而增强了中间物COads的吸脱附能力,减弱了(3)反应的限制程度,提高了整个反应速度,并显现出甲醇吸附过程对总反应过程的限制效应,甲醇的反应级数提高;而非晶态壳层Pt纳米粒子反应级数呈先升高后降低的趋势,这是因为随着Pt含量的减少,壳层中Pt原子簇的平均原子数减小,尺度也减小,非晶态Pt的配位键不饱和程度逐渐增大,与中间物COads的结合能也呈由低向高增强的趋势,在Ni和Pt原子数比为10∶1和15∶1时,中间物COads在纳米粒子表面的吸脱附能力达到适中,当Ni与Pt的原子数比进一步减小达到20∶1时,非晶态的配位键不饱和程度急剧增大,中间物COads在Pt表面的吸附能力太强,反应(3)对总反应过程的限制程度恢复到Ni5Pt1的水平。从整体上看非晶态Pt壳层纳米粒子上反应级数比晶态型纳米粒子的要高,当Ni和Pt原子数比为15∶1时,甲醇反应级数最大。
3 结论
1)采用连续两步化学还原法制备出了非晶态金属Pt壳层的Ni@Pt核壳纳米粒子,平均粒径约为12nm,壳层厚度约为1~2nm。核芯金属Ni呈面心立方(fcc)晶型,表面主要以Ni(111)晶面为主。但当Ni和Pt原子数比<10,壳层厚度>2nm时,表面的Pt原子呈晶态。
2)通过甲醇氧化正向峰电位EP与lnv的关系计算出的塔菲尔斜率b值均较小,说明活化过电位随着电流密度的增大而增加的幅度小。其中,Ni与Pt原子数比为10∶1的Ni10Pt1,塔菲尔斜率b值最小。
3)通过甲醇反应级数的测定,证明非晶态纳米粒子上甲醇反应级数较大,反应中间体COads的吸附能减小,其氧化的活化能降低,对甲醇电氧化反应速率的限制减弱。当Ni与Pt的原子数比为15∶1时,反应级数达到最大。
[1]王正品.金属功能材料[M].北京:化学工业出版社,2004:201-202.
[2]Mitsuhiro H,Keiko A,Masafumi M,et al.Amorphous titanium oxide electrode for high-rate discharge and charge[J].Power Sources,2004,126:139-143.
[3]Baiker A,Gasser D,Lenzner J,et al.Oxidation of carbon monoxide over palladium on zirconia prepared from amorphous PdZr alloy I.Bulk structural,morphological,and catalytic properties of catalyst[J].J Catal,1990,126:555-571.
[4]Martinek T,Molnar A,Katona T,et al.Amorphous alloy catalysis IX.Isomerization and hydrogenation of allyl alcohol over an amorphous copper-zirconium alloy[J].J Mol Catal A:Chem,1996,112:85-92.
[5]Van Wonterghem V,Morup S,Koch C J W,et al.Formation of ultra-fine amorphous alloy particles by reduction in aqueous solution[J].Nature,1986,322:622-623.
[6]单亚拿,史桂梅,张金虎,等.化学镀法合成Fe/Ni纳米复合粉体[J].沈阳建筑大学学报(自然科学版),2008,24(4):629-632.
[7]Zhou Zhi-You,Huang Zhi-Zhong,Chen De-Jun,et al.High-lndex faceted platinum nanocrystals supported on carbon black as highly efficient catalysts for ethanol electrooxidation[J].Angew Chem Int Ed,2010,49:411-414.
[8]王林山,李瑛.燃料电池(第二版)[M].北京:冶金工业出版社,2005:169-172.
[9]杨辉,李长志,陆天虹,等.甲醇在铂微粒修饰的聚硫电极上的电催化氧化[J].物理化学学报,1997,6:542-546.
[10]刘永辉.电化学测试技术[M].北京:北京航空学院出版社,1987:7-12.
[11]Wu Gang,Li Li,Xu Boqing.Effect of electrochemical polarization of PtRu/C catalysts on methanol electrooxidation[J].Electrochimica Acta,2004,50:1-10.

