流式细胞术分析五味子乙素促进阿霉素内化的实验研究
孙德一 张铎 王海杰 李妍
1.延边大学医学部药学院,延吉,133002
2.吉林医药学院免疫学与病原学教研室,吉林,132013
3.吉林医药学院药学院,吉林,132013
流式细胞术分析五味子乙素促进阿霉素内化的实验研究
孙德一1张铎2王海杰3李妍2
1.延边大学医学部药学院,延吉,133002
2.吉林医药学院免疫学与病原学教研室,吉林,132013
3.吉林医药学院药学院,吉林,132013
[目的] 建立流式细胞术分析肿瘤细胞内阿霉素分布的方法,并研究低浓度五味子乙素对K562细胞内化阿霉素的影响。[方法] 体外培养猪内皮细胞(pEC),以20μmol/L阿霉素处理2、4和6小时;或加入不同浓度阿霉素(0、10、20、 40、80和100μmol/L)处理4小时。培养K562细胞,以5μmol/L阿霉素处理2、4和6小时;或加入不同浓度阿霉素(0、2.5、5、10和20μmol/L)处理4小时。采用不同浓度(0、25、50和100μmol/ L)五味子乙素(Sch B)与阿霉素联合处理K562细胞4小时。收集细胞,采用流式细胞术分析阿霉素的特异荧光 。[结果] 固定浓度处理pEC(20μmol/L)和K562(5μmol/ L)后检测,发现细胞内荧光强度随时间延长而增加,两种细胞4小时组荧光强度分别达到6小时组的96.93%和95.23%/。在直方图上,阴性和阳性细胞群界限分明。阿霉素(2.5、5和10μmol/L)单独处理细胞的荧光强度分别为26.78±3.34、64.70±6.24和118.35±9.67;添加25μmol/L Sch B实验后荧光强度增加到43.45±4.25、103.74±7.36和146. 69±8.32,Sch B显著增加了K562细胞内阿霉素的分布(p<0.05)。[结论] 建立的方案可快速测定细胞内的阿霉素分布;低浓度Sch B促进肿瘤细胞内化阿霉素。
流式细胞术;阿霉素;五味子乙素
flow cytometry;adriamycin;schisandrin B
阿霉素(acriamycin)是临床广泛应用的抗癌药,为血液系统肿瘤、乳腺癌,肝癌和胃癌等高发肿瘤的一线化疗药。但与其他化疗药类似,原发和继发耐药问题严重。阿霉素的耐药机制复杂,但最常见的为多药耐药基因产物P糖蛋白(P-glycoprotein,P-gp)等过度表达所导致[1]。五味子乙素(schisandrin B,Sch B)为五味子干果实中提取的木脂素类有效成分,可通过诱导细胞凋亡,阻滞细胞周期而抗肿瘤[2]。其体外抑制肿瘤的IC50为10~60μmol/L,但近年研究发现,低浓度的Sch B(≤30μmol/ L)可增强红白血病、乳腺癌和肝癌等肿瘤对阿霉素、紫杉醇等P-gp底物类药物的敏感性[3]。因此,测定Sch B对肿瘤细胞内化药物的效率将有助研究其增敏机制,并为建立合理药物联合方案提供依据。
1.材料与方法
1.1 猪内皮细胞(p i g endotheliocyte, pEC )和人红白血病细胞K562由本室保存,小牛血清购自浙江黄岩四季青公司,F12和1640培养液购自Gibco公司,其他试剂为国产分析纯。Sch B购自中国药品生物制品检定所,阿霉素为Farmitalia Carlo Eeba公司产品。流式细胞仪型号EPICS XL,由Beckman Coulter公司生产。
1.2 细胞培养与药物处理
pEC细胞贴壁生长,采用含10%小牛血清F12培养液,在5%CO2、饱和湿度和37℃条件下培养。按1×105/ml接种细胞于培养瓶,恢复贴壁生长后,加阿霉素至20μmol/L,设不加阿霉素对照组,分别培养2,4和6小时后收集细胞;分别加阿霉素至0、10、20、40、80和100μmol/L,培养4小时收集细胞。K562为悬浮生长细胞,采用含10%小牛血清1640培养液培养。接种K562细胞,加阿霉素至5μmol/L,同时设不加阿霉素的对照组,分别培养2,4和6小时后收集细胞。接种K562细胞,加入阿霉素至0、2.5、5、10、20和40μmol/ L,培养4小时收集细胞。为观察五味子乙素对K562内化阿霉素的影响,按如下分组并处理4小时后收集:加阿霉素至终浓度为0、2.5、5和10μmol/L;相同的阿霉素浓度,分别加Sch B 至终浓度为25、50和100μmol/L。
1.3 流式细胞术分析
收集细胞后PBS洗2次后,立即用流式细胞仪第二荧光通道(FL2)检测,收集数据后采用CXP软件(Beckman coulter,USA)分析各组细胞的荧光强度。
1.4 统计学处理 以3次实验的平均值±标准差来表示最终结果。单独阿霉素处理组与阿霉素联合Sch B组间相同浓度点的比较采用t检验。数据用SPSS15.0软件做统计分析, 检验水准α=0.05。
2.结果
2.1 流式细胞术分析阿霉素在细胞内分布
流式细胞术分析阿霉素特异荧光方案:在前向散射光(FS)为横坐标、侧向散射光(SS)为纵坐标的散点图设门A,选择分析细胞群(图1-A);在F2为横坐标的单参数直方图中,以不添加阿霉素对照组99%细胞为阴性设门B,B门内细胞占选定细胞A的99.0%以上;特异荧光阳性门为C(图1-B),用平均(Mean,M)荧光强度来代表阿霉素在细胞内的分布。采用该方案分析20μmol/L 阿霉素处理K562细胞4小时的药物分布:99%以上细胞在C门内,与对照组比较,平均荧光强度为209.55(210.12-0.57)(图1-C)。

图1 流式细胞术分析细胞内阿霉素特异荧光
阿霉素(20μmol/L)处理PEC细胞2、4和6小时,细胞内荧光强度随时间延而增加(图2-A)。2和4小时荧光平均值分别为6小时组82.80%和96.93%,即作用4小时细胞内化药物已近该浓度下的极限。不同浓度药物(10、20、40、80和100μmol/L)处理4小时后,细胞内的阿霉素平均特异荧光强度分别为41.79、71.35、103.03、123.49和129.52,即低浓度下(≤40μmol/L,细胞内阿酶素分布随外液浓度增加而明显增加;在40~100μmol/L间,阿酶素内化增幅平缓(图2-B)。
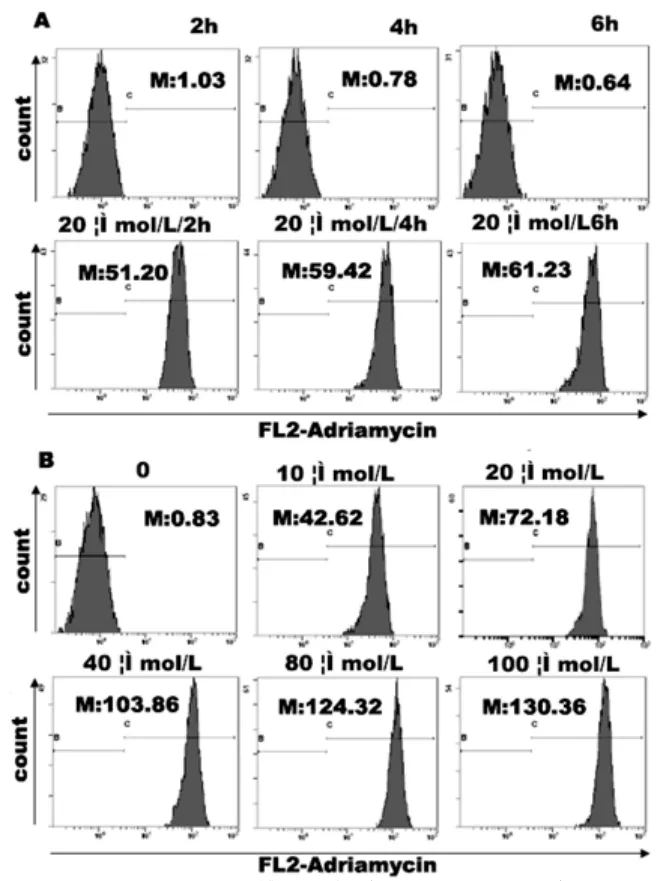
图2 处理时间和药物浓度对批pEC细胞阿霉素分布的影响
不同时间和浓度的阿霉素处理K562细胞后流式细胞术分析,发现其趋势与批pEC细胞相同:固定的药物处理2和4小时,其荧光强度分别为6小时组的72.89%和95.39%(图3-A)。0、2.5、5、10和20μmol/L处理4小时,细胞内阿酶素分布随细胞外液浓度增加而明显增加;而浓度在20~40μmol/L间,阿霉素内化的增幅平缓(图3-B)
图3 不同浓度阿霉素对K562细胞阿酶素荧光的影响
2.2 五味子乙素促进K562细胞内化阿霉素
2.5、5 和10 μmol/L阿霉素单独处理4小时,K562细胞内阿霉素的荧光强度分别为26.78±3.34、64.70±6.24和118.35±9.67;添加25μmol/L Sch B的实验组,荧光强度分别增到43.45±4.25、103.74±7.36和146.69±8.32,Sch B显著增加了K562细胞内阿霉素的分布(p<0.05)。50和100μmol/L Sch B组的阿霉素的荧光强度高于阿霉素单独作用组和25μmol/L Sch B,但50和100μmol/L Sch B组间无显著差异(图4)。以上结果表明,低浓度的Sch B即可促进阿霉素的内化。
3.讨论
阿霉素为分子量 543.52的大环内酯类药物,是P-gp的靶分子。当肿瘤原发为P-gp高表达,或化疗药物诱导其表达增加后,可加速阿霉素等大环内酯类药物被“药泵”运出细胞的效率,从而产生耐药[4]。因此,检测细胞内药物浓度对研究其耐药机制、筛选增敏药物和预测疗效有重要意义。利用阿霉素发射的红色荧光,我们分析了浓度和处理时间对细胞内药物分布的影响。药物处理4小时荧光强度随药物浓度增加而增强;同时发现荧光在直方图中峰值集中,阴性和阳性细胞群界限分明。因此,所建立的方案操作简单、标本量小,用来分析药物浓度具有独特优势。
研究报道,低浓度的Sch B可增强红白血病、乳腺癌和肝癌等肿瘤对阿霉素、紫杉醇等P-gp底物类药物的敏感性。本研究测定了不同浓度Sch B对K562细胞内化阿霉素的影响。发现,低浓度的Sch B即可显著增强阿霉素在细胞内的分布。化疗药物均有毒副作用,降低药物用量可减轻毒副作用[5]。将Sch B与阿霉素联合应用,可通过促进药物内化而形成协同作用。本研究所建立的阿霉素检测方法,以及低浓度的Sch B促进药物内化的证据,为筛选阿霉素的增敏药物,建立合理的药物联合方案提供依据。
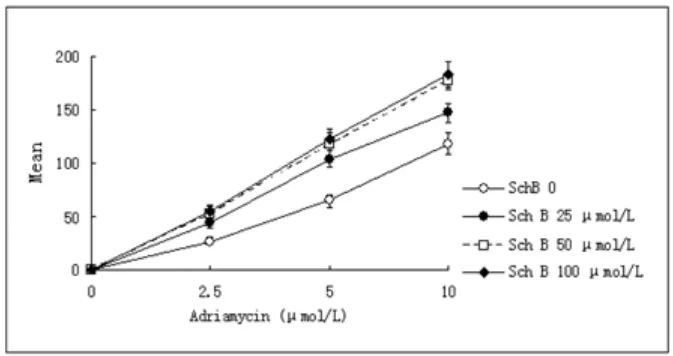
图4 不同浓度阿霉素对K562细胞内化阿霉素的影响
[1]梁军,宋晓玉,刘志新,李月珍. 五味子乙素对人胃癌细胞株MGC-803凋亡的影响.中国老年病学杂志,2011,31(1):88~90.
[2]苗迎秋,李志,高文仓. 阿霉素诱导的卵巢癌耐药细胞P- 糖蛋白的表达. 大连医科大学学报,2010,32(1):35~40.
[3]李凌, 王弢,许志良,俞颖,陈卫,陈菲. 五味子乙素对转染多药耐药1基因的MCF-7细胞的多药耐药逆转作用. 中华医学杂志,2005,85(23):1633~1637.
[4]孙华, 刘耕陶.五味子果仁醇提取物含药血清逆转肿瘤多药耐药及抑制耐药糖蛋白( P-gp)的作用.中国新药杂志,2009,18(12):1130~1135.
[5]傅军,俞杰,徐宏彬,李玲. 中医药辅助实体肿瘤化疗增效减毒的系统性评价.中医药导报,2010,16(10):108~112.
Analyzing the promotion of internalization of adriamycin by schisandrin B through flow cytometry
Sun Deyi 1, Zhang Duo 2, Wang Haijie 3, Li Yan 2
1. The Department of Pharmacy in The Medical College of Yanbian Univercity,Yanji, 1330022. The Department of Immunology and Etiology of Jilin Medical College,Jilin, 132013
3. The Department of Pharmacy of Jilin Medical College,Jilin, 132013
Objective: To establish a method to analyze content of adriamycin in tumor cells by flow cytometry (FCM)and to analyze the effect of internalization of adriamycin into tumor cells promoted by schisandrin B. Method: Pig endothelia cells (pEC)were cultured with or without 20μmol/L adriamycin for indicated time ( 2, 4and 6hours), or in the presence of different concentration (0,10,20,40and 80μmol/L )of adriamycin for 4hours. Human erythroleukemia cells K562were cultured with or without 5μmol/L adriamycin for indicated time (2, 4and 6hours), or in the presence of different concentration (0, 2.5, 5, 10and 20μmol/ L )of adriamycin for 4hours. K562cells were treated by different concentration of adriamycin in the presence of schisandrin B (0,25,50and 1005μmol/L). The specific red fluorescence of adriamycin in those cells were detected by FCM. Result: The fluorescence in pEC and K562cells treated by determined concentration of adriamycin (10μmol/L or 5μmol/L)increased timedependently. Compared with cells treated for 6hours, cells treated for 4hours presented almost 96.93% and 95.23of fluorescence. Fluorescence positive and negative cells were distinct well in the histograms. The fluorescence in K562cells treated by adriamycin ( 2, 5and105μmol/ L)along were 26.78±3.34、64.70±6.24and 118.35±9.67.The addition of 25μmol/ L Sch B promoted the internalization of adriamycin to 43.45±4.25、103.74±7.3and 146.69±8.32( p<0.05). Conclusion: The method to analyze content of adriamycin in tumor cells by FCM was established .It was confirmed that lower concentration of Sch B could promoted the internalization of adriamycin .
10.3969/j.issn.1001-8972.2012.07.092
吉林省教育厅十二五科研基金(编号2011420)
,李妍(1972-),女,博士,副教授,从事细胞与分子免疫学研究工作。

