青岛地区兔肺炎克雷伯氏菌分离鉴定
王召朋 柴同杰 牟特 吕长辉
青岛地区兔肺炎克雷伯氏菌分离鉴定
王召朋①柴同杰②*牟特①吕长辉②
(①青岛康大外贸集团公司 胶南 266400 ②山东农业大学动物科技学院)
对青岛地区某兔场病死兔的病变器官组织进行细菌分离和纯培养,对所分离的细菌进行形态特征、理化性质和16SrRNA序列的分子鉴定和测序,人工感染以及药敏试验,判定为肺炎克雷伯氏菌。代表菌株16SrRNA序列长度1414bp,与GeneBank登录号为EU360123.1的肺炎克雷伯氏菌16SrRNA序列同源性100%,人工感染小鼠24h全部死亡,对供试的诺氟沙星等药物高度敏感,对供试的强力霉素等中毒敏感,对头孢拉定等耐药。应用筛选的敏感药物,并采取综合防治措施,使疫情得到了有效控制。
肉兔 肺炎克雷伯氏菌 分离 药敏试验
肺炎克雷伯氏菌属肠杆菌科克雷伯氏属,是一种常见的条件性致病菌,广泛分布于动物的消化道以及水、土壤和谷物中,可引起人畜发生肺炎、腹膜炎、子宫炎以及腹泻,甚至发生败血症。近年来现代养殖业生产方式得到迅猛发展,但由于养殖户的管理水平、养殖场的硬软件设施跟不上规模扩大的需要等原因,已经有多起有该菌引起的家畜感染的报道。
青岛某兔场在入冬后,部分母兔及仔兔发生腹泻病死亡,临床症状主要表现为腹胀,轻度腹泻,粪便呈深褐色水样,病例解剖发现盲肠、小肠浆膜充血出血,充满气体,肠内为深褐色或红褐色水样内容物,使用庆大霉素、安普霉素等抗生素治疗无效,且发病率和死亡率升高。为有效控制该病,对病死兔进行了剖检采样和病原分离鉴定,并进行了动物实验和药敏试验,筛选出有效药物,及时进行防治。
1 材料和方法
1.1 试剂 DHL琼脂、营养琼脂、脱纤维羊血、麦康凯琼脂、普通肉汤和生化鉴定管购自北京陆桥技术有限责任公司;药敏纸片购自杭州微生物试剂有限公司;细菌基因组DNA提取试剂盒、PCR预混料购自天根生化科技有限公司;Marker2000购自Taraka公司;DNA回收试剂盒购自OMEGA公司。
1.2 病原分离培养 取病死兔病变组织,无菌操作划线接种DHL琼脂平皿、血琼脂平皿、营养琼脂平皿和麦康凯琼脂平皿,至37℃温箱培养18~24h,观察结果。
1.3 染色及显微观察 将分离培养出的可以菌进行革兰氏染色,显微镜观察菌体形态。
1.4 生化试验 可疑菌普通肉汤纯培养物进行三糖铁、V-P、硝酸盐还原、M.R、西蒙氏柠檬酸盐、丙二酸盐、尿素酶、赖氨酸脱羧酶、鸟氨酸脱羧酶、葡萄糖、乳糖、靛基质、半固体动力生化试验。
1.5 动物试验 试验用小白鼠8只,分试验组和对照组,每组4只。将可疑菌普通肉汤培养物试验组每只腹腔注射0.1ml,对照组每只腹腔注射生理盐水作为对照,饲养观察。对发病及死亡小鼠进行解剖和病原菌分离培养。
1.6 分子生物学鉴定 用细菌基因组DNA提取试剂盒提取的DNA作为模板,引物采用16SrRNA通用引物,上、下游引物序列分别为:5'-AGAGTTTGATCCTGGCTCAG-3'和5'-ACGGCTACCTTGTTACGACTT-3',由上海生物工程公司和成。PCR反应体系25µl:1.0ml的模版DNA,10×PCR buffer (Mg2+free)2.5ml,MgCl2(2.5mmol/L)2ml,dNTP(2.5mmol/L)1.3ml,上下游引物(25µmol/L)各1ml,Taq DNA聚合酶(5U/µl)0.2µl;最后用灭菌双蒸水补足到25ml。PCR基本反应程序为94℃5min、94℃1min、55℃ 1min、72℃70s,共进行32个循环,最后于72℃延伸7min。PCR产物经10g/L琼脂糖电泳后,按OGEMA凝胶回收试剂盒回收目的片段,送上海生物工程公司测序。
1.7 药敏试验 取普通肉汤24h纯培养物1ml均匀涂布于营养琼脂平皿上,贴上药敏纸片,置于37℃温箱培养24h后观察试验结果。
2 结果
2.1 病原分离培养结果 在不同培养基上均长出了较大的粘液状菌落,相邻菌落易融合成浓汁样,接种针挑取时可拉出丝。在DHL琼脂平皿上菌落淡粉色、大而隆起、光滑湿润;在麦康凯琼脂平皿上菌落呈红色;在营养琼脂平皿上菌落乳白色、大而隆起,光滑湿润;在血琼脂平皿上不溶血。
2.2 染色镜检结果 革兰氏染色阴性,短杆菌,单个或成双排列,有荚膜,无芽孢。
2.3 生化试验结果 三糖铁37℃温箱培养24h,斜面产酸,底层产酸产气,硫化氢阴性。其他理化性质见表1。

表1 生化试验结果
2.4 动物试验结果 普通肉汤培养物接种小鼠后,试验组4只小鼠24h内全部死亡,对照组小鼠全部健活。死亡小鼠肺脏、肝脏细菌分离培养后染色镜检,得到与接种细菌相同的菌株。
2.5 分子鉴定结果 PCR扩增产物经1%琼脂糖凝胶电泳结果(图1)。
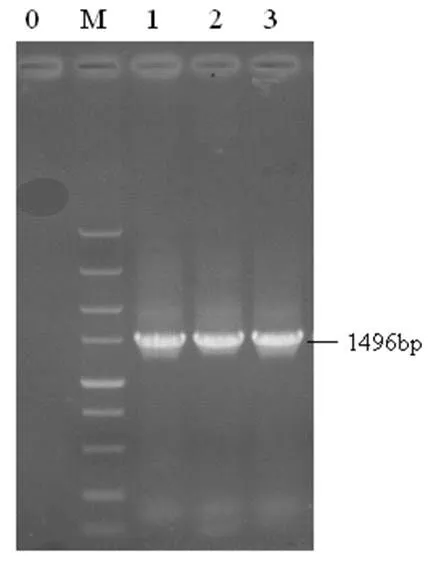
图1 PCR鉴定结果
(M: DL5000,0:阴性对照,1-3:待测菌株)
测序后经BLAST分析测序结果表明:该菌株16SrRNA与肺炎克雷伯氏菌(GeneBank中的序列注册号EU360123.1)的同源性最高,达100%。
2.6 药敏试验结果 药敏结果判定依据为《抗菌药物药敏纸片判断标准》。此次分离出的肺炎克雷伯氏菌对诺氟沙星等药物高度敏感,对强力霉素等中度敏感,对头孢拉定等耐药,具体结果见表2。

表2 药敏试验结果 (mm)
3 讨论
从本次发病临床症状、病理变化、镜检观察和生化特性分析,与肺炎克雷伯菌高度相似,通过分子生物学鉴定,结果表明病原菌与肺炎克雷伯氏菌同源性达到100%,从而证明了该菌即为肺炎克雷伯氏菌。通过染色镜检、生化鉴定等常规检测方式与分子生物学鉴定的对比,分子生物学鉴定准确性最高,操作简便快捷。
肺炎克雷伯氏菌作为家兔体内常在菌群,易引起家兔呼吸和消化系统疾病,且多为散发性病例,而像本次较大规模发病,引起断奶前仔兔大量腹泻死亡的病例报道较少。此次除肺炎克雷伯氏菌外,还分离到了致病性大肠杆菌,发病初期临场症状与大肠杆菌病较接近,但用药后病情没有改善,发病率和死亡率升高,临床症状也发生变化,加大用药量也无明显改善。说明此次肺炎克雷伯氏菌发病是由于气候变化、仔兔体质较弱及其他疾病等因素引起的,同时因该菌具有较强的耐药性,用药后仔兔肠道内菌群失调,也是爆本发病的一个主要原因。
肺炎克雷伯氏菌可以产生各种使抗生素失活的酶,这是造成该菌具有耐药性的原因,而且临床分离的菌株大多为多重耐药性菌株,给生产中防治该病造成了很大的困难,同时对养殖人员的健康也构成了一定的威胁。因其耐药的特性,预防成为了防治该病的主要手段,增强家兔免疫力,减小或避免各种应激,减少抗生素的滥用,都有利于预防该病的发生。一旦发生本病,早期诊断和有效药物的及时使用,是治疗本病的主要方法。针对此次肺炎克雷伯氏菌病,除使用有效抗生素外,还配合使用了肠道微生态制剂,提高体质和免疫力,使病情很快得到了控制。
[1] 叶应妩, 王毓三. 全国临床检验操作规程[M]. 第4版. 南京: 东南大学出版社. 1997.
[2] 唐毅, 张芬, 孙翰昌等. 白鲢肺炎克雷伯氏菌的分离鉴定[J]. 西南大学学报. 2007. 29(6): 73-76.
[3] 陶锦华, 李康然, 韦平等. 石龟肺炎克雷伯氏菌感染的诊断与防治[J]. 广西畜牧兽医. 2002. 18(6): 20-21.
[4]. 叶巧真, 何建国, 邱德全等. 中华鳖白底板病和红底板病细菌的分离鉴定及致病性[J]. 微生物学通报. 2000.27(6): 407-413.
[5] 马磊, 万莉, 颜其贵等. 竹鼠克雷伯氏菌的分离鉴定[J]. 中国人兽共患病学报. 2011. 27(9): 825-828.
[6] 黑根WA, 布隆纳尔DW, 吉莱斯皮JH等. 家畜传染病[M].第1版. 北京: 农业出版社, 1988.
[7] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 第2版. 北京: 科学出版社, 2001.
[8] Brisse S, Duijkeren E. Identification and antimicrobial susceptibility of 100 Klebsiella animal clinical isolates[J]. Veternary microbiology. 2005, 105(3-4): 307-312.
[9] Greisen K, Loeffelholz M, Purohit A, et al. PCR primers and probes for the 16SrRNA gene of most species of pathogenic bacteria, including bacteria found in cerebrospinal fluid[J]. Journal of clinical microbiology. 1994, 32(2): 335.
(2012–03–08)
通讯作者
S852.61+2
A
1007-1733(2012)05-0016-03

