马氏珍珠贝蛋白降解与抗氧化性关系的研究
赖晨戎,夏克胜,崔 春,赵谋明
(华南理工大学轻工与食品学院,广东广州 510641)
马氏珍珠贝蛋白降解与抗氧化性关系的研究
赖晨戎,夏克胜,崔 春,赵谋明*
(华南理工大学轻工与食品学院,广东广州 510641)
以马氏珍珠贝肉为原料固体发酵制备米曲霉,采用还原力、DPPH自由基清除力、氧自由基清除能力(ORAC)三种指标评价酶解过程中抗氧化性的变化。利用总氮、氨氮、肽含量以及色泽表征蛋白质降解规律,并进一步探究其蛋白降解规律与抗氧化活性之间的内在联系。结果表明,酶解液的抗氧化性随酶解时间的延长大体呈现增加的趋势,酶解36h后,还原力增加到初始的2.20倍;DPPH自由基清除力增加至初始的1.55倍;ORAC最大达到2834.67μmol Trolox/g,是等质量的谷胱甘肽的1.13倍。总氮增加到初始的1.89倍,氨氮增加到初始的2.57倍。在颜色变化方面,色深物质和色率均随着酶解时间的延长而增加。通过相关性分析发现氨氮的变化与抗氧化性之间有显著的相关性。
马氏珍珠贝肉,酶解,蛋白质降解,抗氧化性
马氏珍珠贝(Pinctada martensii),又称合浦珠母贝,是培养海水珍珠的重要贝类,广泛分布于我国广东、广西和海南的沿海[1]。目前,珍珠贝肉的利用率低,具有的价值未得到充分利用。利用酶技术对其进行加工处理是开发其潜在价值的重要手段之一。如章超桦等[2]研究发现马氏珍珠贝肉酶解蛋白具有抗疲劳功能。陈美花等[3]研究发现运用美拉德反应可以改良马氏珍珠贝酶法抽提物的风味。Katano S等[4]采用碱性蛋白酶水解马氏珍珠贝肉,研究发现水解产物具有抗高血压活性。但是,酶制剂的用量大、酶解的成本高、水解度低、酶解产物的功能性较弱等技术难题制约了蛋白质酶解技术在马氏珍珠贝肉的深加工中的应用[5]。以马氏珍珠贝肉为原料通过制曲-酶解可获得水解度高、生理活性高的酶解液。同时,近年来在抗氧化性机理方面的研究主要集中在颜色的变化、抗氧化肽这两个方面。如孙玲等[6]研究发现若稻米的种皮颜色越深,则其生物抗氧化物质含量越高,生物抗氧化能力越强。王惠英等[7]研究了L-赖氨酸与D-核糖的模式美拉德反应及其褐变产物抗氧化性。如韩国的Se-Kwon K等[8]利用废弃鱼皮制得抗氧化肽。程云辉[9]和王双玉等[10]分别从麦胚蛋白、玉米醇溶蛋白中也得到了抗氧化活性肽。关于以马氏珍珠贝肉为原料通过制曲-酶解得到的产物的抗氧化性以及相关机理方面还没有系统的研究报道。实验以马氏珍珠贝肉为原料通过米曲霉固体制曲-酶解制备酶解液,对酶解过程的总氮、氨氮、颜色、抗氧化性的变化等进行了比较深入的研究,并探讨其蛋白降解规律与抗氧化活性之间的关系,为珍珠贝肉的高效利用提供理论和方法指导。
1 材料与方法
1.1 材料与设备
马氏珍珠贝肉 面粉市售;曲精(沪酿3.042孢子粉) 孢子发芽率≥80%,孢子数≥300亿/g干基,水分≤10%;Trolox、标准肽样品Cytochrome C(分子量为12500)、Aprotinin(分子量为6500)、Vitam in B12(分子量为1355)、Oxidized glutathione(分子量为612)、Glycylglycylglycine(分子量为189) 由Sigma公司提供;其他试剂均为 分析纯。
MJ-176NR搅拌机 日本Panasonic公司;ZJPA1230霉菌培养箱 上海智城分析仪器制造有限公司;THZ-82A恒温振荡器 常州澳华仪器有限公司;UV-2100分光光度计 Unico(上海)仪器有林大机械有限公司;KDN-2C定氮仪 上海纤检仪器有限公司;DFT-200手提式高速万能粉碎机 温岭市林大机械有限公司;M inolta CR-400色差计 日本大阪Konica Minolta Sensing公司;GL-21M高速冷冻离心机 长沙湘仪离心机仪器有限公司;Varioskan Flash多功能酶标仪 芬兰Thermo Scientific公司;快速蛋白质纯化系统 美国Amersham Biosciences公司。
1.2 实验方法
1.2.1 马氏珍珠贝肉的发酵和酶解工艺[5]取新鲜的马氏珍珠贝肉约4000g,在121℃加热10m in后得到熟贝肉。取熟贝肉添加25%(w∶w)面粉,接入0.5‰(以混料后总物质重量计,w∶w)米曲精制曲,25~35℃培养44h后得到成曲。取成曲100g,以料液比1∶2.5(w∶w)加去离子水摇匀,恒温53℃搅拌水解,分别于1、2、4、8、12、24、36h取样,并在沸水浴中灭酶20min,离心(4℃、6000r/m in、15m in),取上清液,为所得酶解产物。其中未水解样(0h)是成曲常温混水后摇匀,离心得到的液体,即成曲的水溶性提取物。
1.2.2 抗氧化性测定方法
1.2.2.1 清除DPPH自由基的测定方法[11]酶解0、1、2h分别稀释50、100倍;4、8h分别稀释50、100、200倍;12、24、36h分别稀释100、150、200倍。分别测DPPH自由基清除能力,求出不同酶解时间段的IC50值。
1.2.2.2 还原力的测定方法[11]酶解1、2、4、8、12、24、36h的样品分别稀释10倍,分别测定还原力。
1.2.2.3 氧自由基清除能力(ORAC)的测定方法[12]酶解0h稀释500倍;1、2h稀释1000倍;4、8h稀释2000倍;12、24、36h稀释3000倍,分别测定ORAC值。
1.2.3 含氮量测定方法
1.2.3.1 总氮的测定 凯氏定氮法,参照GB 5009.5-2010。
1.2.3.2 氨基酸态氮的测定 甲醛滴定法,参照GB/T 5009.39-2003。
1.2.4 分子量测定 凝胶色谱法,色谱条件:Amersham蛋白质分析纯化系统,Superdex_peptide_10/300_GL分离柱,洗脱液为0.25mol/L NaCl,pH 7.2磷酸盐缓冲液,洗脱流速为0.5m L/m in,检测波长为214nm。标准肽样品与洗脱液体积拟合直线方程为lgM=-0.1499V+ 5.6297(R2=0.9957),式中:lgM为标准肽分子量的对数;V为洗脱液体积。
1.2.5 颜色测定
1.2.5.1 色率的测定[13]参考孙宇霞的方法,使用最小二乘方回归法得到标准方程:
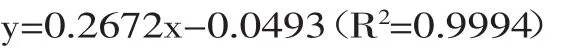
式中:y为色率;x为吸光度A值。
测定时将样品稀释10倍,用分光光度计,在520nm波长下,以蒸馏水做空白,测出吸光度A值,将A值乘以稀释倍数10后,代入上述方程得色率。
1.2.5.2 色深物质定量测定[14]参考李莹等的方法,将样品稀释10倍,测定其在420nm处的吸光值A420nm。色深物质定量对比时计算公式:
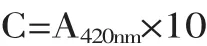
式中:C为色深物质定量值;10为稀释倍数。
1.2.5.3 红色指数和黄色指数的测定 参考郑海燕[15]和秦祖赠[16]的方法,将样品稀释10倍,分别在波长460、510、610nm下测得光密度值D1、D2和D3。其中,红色指数由10×lg(D2/D3)表示;黄色指数由10×lg(D1/D3)表示。
1.2.6 实验重复三次,采用SPSS 13.0和Excel 2007进行数据统计分析。
2 结果与讨论
2.1 不同时间段的酶解液中总氮和氨氮的分析

图1 酶解产物中总氮和氨氮的变化Fig.1 The change of total nitrogen and ammonia nitrogen in hydrolysate
由图1可知,随着酶解时间的延长,酶解产物的总氮和氨氮含量均呈上升趋势,总氮由0h的0.0067g/m L增加至36h的0.0127g/m L,增加了0.89倍。氨氮的含量也由0h的0.0024g/m L逐渐增加至36h的0.0062g/m L,增加了1.57倍。其中,酶解8h前,总氮和氨氮的含量均增加较快。分别增加了0.75、1.02倍。这是由于大分子蛋白质在酶的作用下,被剪切为多肽和氨基酸而溶于水。酶解8h后,总氮含量基本保持稳定,因为大部分不溶性蛋白质已转化为可溶性多肽和氨基酸,剩下的含氮物质较难溶于水中。而氨氮含量仍保持较快的速度增加,主要由于酶以可溶性多肽为底物将其进一步降解为氨基酸和小分子肽[17]。
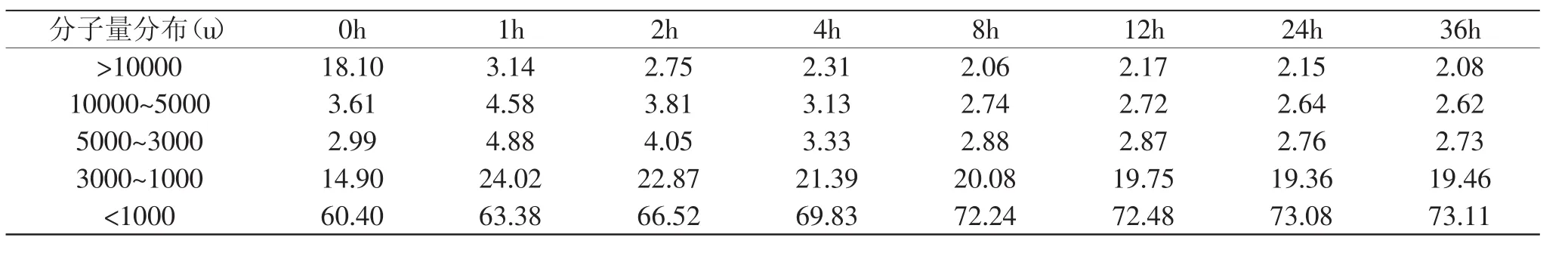
表1 不同酶解液的分子量分布百分比(%)Table 1 Molecularweight distribution percentage of hydrolysate(%)
2.2 不同时间段的酶解液中分子量分布

图2 酶解液的分子量分布图Fig.2 Molecular weight distribution of hydrolysate
由图2和表1可知,酶解液在凝胶柱上的保留体积大部分大于17.54m L(分子量为3000u),这表明酶解液中的肽类分子量以3000u以下的为主。不同时间段的酶解液肽分子量的大体变化趋势是:随着酶解时间的延长,大分子质量的肽含量逐渐减少,小分子质量的肽含量、氨基酸等物质逐渐增加,肽峰呈现向后推移的趋势。未酶解的样品(0h)中蛋白质分子量主要集中在<1000u的分子量段上,其占总量的60.40%;酶解1h后,分子质量>10000u的肽含量比值显著减少,由18.10%降至3.14%,而分子质量在3000~ 1000u的肽含量比值显著增加,由14.90%增加到24.02%,可见酶解1h内,分子量>10000u的肽大部分被酶剪切成1000~3000u的肽段;随着酶解时间的延长,分子量>10000u的肽一直被降解,酶解时间达8h后,分子量>10000u肽含量基本保持在2.00%的水平;分子量<1000u的肽段在酶解过程中一直保持增加的趋势,酶解时间在0~8h时,此区间肽段含量增加速率较快,由0h的60.40%增加至8h的72.24%,而酶解时间达到8h后,其含量增加趋势变缓。
2.3 不同酶解时间对酶解液颜色的影响
色率是用来评价酶解液颜色深浅的指标。酶解前2h,色率逐渐下降,随后,色率随酶解时间的延长而不断增加。酶解36h时,色率达到5.61。在整个酶解过程中,色深物质含量变化随着酶解时间的延长也呈现增加的趋势,且色深物质和色率具有极显著的相关性(R2=0.992)。红色指数是反映酶解液中红色的强弱。红色指数越大,红色色调越深。黄色指数是反映酶解液中黄色的强弱,黄色指数越大,黄色色调越明显。在酶解过程中,红色指数和黄色指数都基本保持稳定。色率的增加可能主要是由于色深物质的增加。色深物质不断增加的原因可能是酶解过程中酶解液的还原糖与氨基酸、肽及蛋白质进行美拉德反应[13]或者是酶解液中肌血球素和黑色素发生了氧化作用[18]。在酶解前期色率的下降可能主要因为初期酶解液中色深物质的不断积累和消耗,色泽前体物质的不断溶出和消耗的动态变化引起了样品在可见光下的吸光度有所变化。

表2 不同酶解时间对酶解液颜色的影响Table 2 Effectof differenthydrolysis time on hydrolysate’s color
2.4 不同酶解时间对酶解液的抗氧化性的影响
2.4.1 不同酶解时间对酶解液还原力的影响 在一般情况下,物质的还原能力与抗氧化能力呈正相关。研究表明,抗氧化物质通过提供电子可阻断Fe2+向Fe3+的转变,表现出一定的还原能力。在波长700nm处测定的吸光度越大,则样品的还原能力越强。如图3所示,0h样液的还原力是1.01,随着酶解时间延长逐渐增加。其中,在1~2h过程中,还原力增加较快,增加了51%,到达酶解24h时还原力达到最高点,为2.22,增加了1.2倍。酶解24h后,还原力基本保持稳定。这可能是因为酶解24h后酶的剪切作用使得具有抗氧化性的基团已经充分暴露。
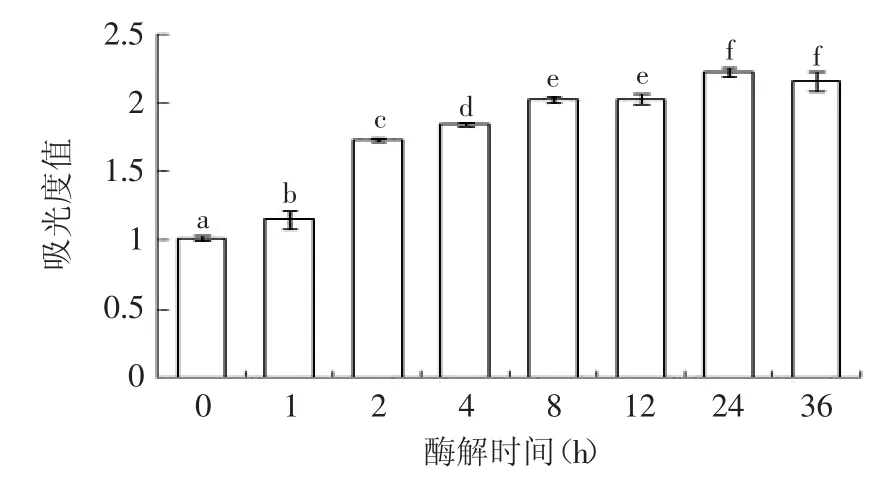
图3 不同酶解时间对酶解液还原力的影响Fig.3 Effectof differenthydrolysis time on hydrolysate’s reducing power
2.4.2 不同酶解时间对酶解液清除DPPH自由基能力的影响 二苯代苦味酰肼自由基(DPPH自由基)是一种比较稳定的脂溶性自由基,其N上有一个游离电子。若某物质能够清除它,则表示这个物质具有降低羟基自由基、烷基自由基或者过氧自由基的有效浓度或具有打断脂质过氧化链反应的作用[19]。因此,DPPH自由基清除模型是一种广泛用于评价抗氧化剂自由基清除能力的快速方法。图4中可看出随着酶解时间的延长,IC50值从0h的0.802mg/m L降到36h的0.518mg/m L,下降了35.41%。在酶解2~4h内,IC50值变化明显,下降了25%。酶解4h后,IC50值下降变缓。本研究中的酶解液的DPPH自由基清除力明显高于已有报道[20]中马氏珍珠贝肉双酶水解产物的DPPH自由基清除力(即使浓度高达5mg/m L时,对DPPH自由基的清除力仍低于50%),也显著高于另一报道[21]中四种商业酶(木瓜蛋白酶、胃蛋白酶、复合蛋白酶、Alcalase 2.4L)的马氏珍珠贝肉残渣酶解产物DPPH自由基清除力(对DPPH自由基的清除力始终低于40%)。

图4 不同酶解时间对酶解液清除DPPH自由基能力的影响Fig.4 Effect of differenthydrolysis time on hydrolysate’s DPPH radical scavenging activity
2.4.3 不同酶解时间对酶解液氧自由基清除能力(ORAC)的影响 氧自由基清除能力(ORAC)的测定是以偶氮类化合物AAPH作为过氧自由基来源,以Sodium Fluorescein(FL)作为荧光指示剂,以抗氧化剂Trolox作为标准,用来定量样品的抗氧化能力。由图5中可以看出,随着酶解时间的延长,不同时间段的酶解液的Trolox当量大体变化趋势是逐渐增强的。从酶解0h的1094.65μmol Trolox/g逐渐增加至36h的2834.67μmol Trolox/g,此时达到最高值,是0h的2.59倍。36h酶解液的Trolox当量是等质量的谷胱甘肽的1.13倍,远高于已有报道[22]中的花生蛋白酶解物的Trolox当量(ORAC值是1943.6μmol Trolox equivalent/g peptid)和另一报道[23]中的商业酶(A lcalase)酶解大豆分离蛋白的酶解产物Trolox当量(ORAC值是1900.48μmol Trolox equivalent/g peptid)。结合还原力和DPPH自由基清除力可知,尽管对抗氧化性的评价方法不同,但体现出酶解过程中酶解液的抗氧化能力变化趋势大体一致。

图5 不同酶解时间对酶解液氧自由基清除能力(ORAC)的影响Fig.5 Effectof differenthydrolysis time on hydrolysate’s oxygen radical absorbance capacity(ORAC)
2.5 颜色、氨氮和抗氧化性指标间的相关性分析

表3 颜色、氨氮和抗氧化性的相关性分析Table 3 The correlation analysis between color,ammonia nitrogen and antioxidantactivity
由表3可知,酶解液中颜色的变化和抗氧化性之间无显著的相关性,而氨氮含量的变化与抗氧化性各项指标之间有显著的相关性。
3 结论
本实验结果显示,在酶解过程中,抗氧化性大体呈现增加的趋势。还原力、DPPH自由基清除力和ORAC值均有不同程度的增加。酶解液具有较强的还原力、清除DPPH自由基和抑制过氧自由基的能力。其中,36h酶解液的ORAC值是等质量的谷胱甘肽的1.13倍。酶解时间达到24~36h时,抗氧化能力达到最高值,因此深度酶解有利于酶解液中抗氧化性的提高。随着酶解时间的增加,色深物质大致呈现增加的趋势。总氮、氨氮含量也在酶解过程中呈现增加的趋势。通过相关性分析发现,氨氮含量的变化与抗氧化性之间具有显著的相关性,颜色的变化和抗氧化性之间的相关性不显著。
[1]曹占旺,王大鹏,甘西.马氏珠母贝及海水珍珠的研究进展[J].广西农业科学,2009,40(12):1618-1622.
[2]章超桦,刘亚,杨萍,等.马氏珠母贝肉酶解蛋白抗疲劳功能的初步研究[J].中国海洋药物杂志,2006,25(4):46-47.
[3]陈美花,励建荣,吉宏武,等.马氏珠母贝酶法抽提物美拉德增香工艺研究[J].食品工业科技,2010,31(5):289-292.
[4]Katano S,Oki T,Matsuo Y,et al.Antihypertensive effect of alkaline protease hydrolysate of the pearl oyster Pinctada fucata martencii& separation and identification of angiotensin-I converting enzyme inhibitory peptides[J].Journal of Molecular Catalysis B-enzymatic,2002,17(2):65-74.
[5]夏克胜,赵谋明,崔春,等.马氏珍珠贝肉固体发酵制曲条件的优化[J].现代食品科技,2011,27(12):1472-1475.
[6]孙玲,陈俊秋,张名位,等.稻米种皮颜色与其生物抗氧化性的关系[J].中国粮油学报,2002,17(4):25-27.
[7]王惠英,孙涛,周冬香,等.L-赖氨酸与D-核糖的模式美拉德反应及其产物抗氧化性能研究[J].食品科学,2008,29(5):112-115.
[8]Kim SK,Kim Y,Byun HG,etal.Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska Pollack skin[J].Agricultural and Food Chemistry,2001,49(4):1984-1989.
[9]程云辉,王璋,许时婴.酶解麦胚蛋白制备抗氧化肽的研究[J].食品科学,2006,27(6):147-151.
[10]王双玉,李坤,阚国仕,等.玉米抗氧化肽的制备及其对小鼠急性酒精性肝损伤的保护作用[J].食品研究与开发,2007,28(3):29-33.
[11]游丽君.泥鳅蛋白抗氧化肽的分离纯化及抗疲劳,抗癌功效研究[D].广州:华南理工大学,2010.
[12]续洁琨,姚新生,栗原博.抗氧化能力指数(ORAC)测定原理及应用[J].中国药理学通报,2006,22(8):1015-1021.
[13]孙宇霞.酱油色率的检测方法[J].江苏调味副食品,2006,23(6):29-30.
[14]李莹,刘敏,崔春,等.酱油抗氧化能力评价及聚类分析[J].食品与发酵工业,2008,34(1):14-19.
[15]郑海燕.酱油中红色指数的测定方法[J].中国调味品,1999(1):27-29.
[16]秦祖赠,陈永梅,粟春富.焦糖色素黄色指数的测定[J].中国调味品,2003(7):37-39.
[17]崔春.海产低值鱼深度酶解工艺与机理研究[D].广州:华南理工大学,2005.
[18]Benjakul S,Morrissey MT.Protein hydrolysates from Pacific whiting solid wastes[J].Agriculturaland Food Chemistry,1997,45(9):3423-3430.
[19]姚倩,孙涛,徐轶霞,等.壳聚糖/壳寡糖衍生物的制备及其抗氧化性能研究[J].食品与生物技术学报,2009,28(2):188-191.
[20]曹文红,章超桦,吴红棉,等.几种南海贝类酶解产物的生物活性及其分子量分布研究[J].食品与机械,2009,25(2):52-57.
[21]曹文红,吴红棉,范秀萍,等.马氏珠母贝酶解产物清除自由基活性的研究[J].食品研究与开发,2009,30(1):13-17.
[22]任娇艳,郑赛晶,刘百战,等.花生抗氧化肽的制备及其在卷烟滤嘴中的应用[J].现代食品科技,2011,27(9):1084-1089.
[23]曹亚兰,赵谋明,郑赛晶,等.以ORAC法为评价指标优化制备大豆抗氧化肽[J].食品与发酵工业,2011,37(10):149-153.
Research of the relationship between protein degradation’s laws and antioxidant activity of Pinctada martensii
LAIChen-rong,XIA Ke-sheng,CUIChun,ZHAO M ou-m ing*
(College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510641,China)
Aspergillus oryzae was cultivated w ith Pinctada martensii on solid culture medium,then it was hyd rolysed.Reducing power,DPPH radical scavenging ac tivity,oxygen radical absorbance capacity(ORAC)were used to evaluate the hyd rolysate’s antioxidant activity.Total nitrogen,ammonia nitrogen,pep tide and color were used to stand for the laws of p rotein deg radation,the relationship between p rotein deg radation’s laws and hyd rolysate’s antioxidantactivity was also researched.The results showed that the antioxidantactivity of the fluid showed an increasing trend with the increasing hyd rolysis time,the reducing power was 2.20 times as much as before.DPPH radical scavenging ac tivity was 1.55 times as much as before.ORAC reached the maximum of 2834.67μmol Trolox/g(36h),which was 1.13 times as much as the equalquality of the g lutathione. The totalnitrogen was 1.89 times as much as before,the ammonia nitrogen was 2.57 times as much as before. As for the change of colour,both of dark substance and the rate of color showed an increasing trend w ith the increasing hyd rolysis time.According to the correlation analysis,the relevance between the change of ammonia nitrogen and the antioxidant activity was significant.
Pinc tada martensii;hyd rolysate;p rotein degradation;antioxidant activity
TS254.9
A
1002-0306(2012)20-0123-05
2012-05-24 *通讯联系人
赖晨戎(1989-),女,硕士,研究方向:食品生物技术。
广东省中国科学院全面战略合作项目(2010A090100023);广东省水产蛋白改性技术研究团队专项(2011A020102005);广东省教育部科技部企业科技特派员行动计划专项项目(2009B090600120)。

