海沃德猕猴桃巯基蛋白酶的催化特性
张 倩,陈 彦,2,*,林晓艳,2,林金凤
(1.西南科技大学材料科学与工程学院,四川绵阳 621010;
2.生物质材料教育部工程研究中心,四川绵阳 621010)
海沃德猕猴桃巯基蛋白酶的催化特性
张 倩1,陈 彦1,2,*,林晓艳1,2,林金凤1
(1.西南科技大学材料科学与工程学院,四川绵阳 621010;
2.生物质材料教育部工程研究中心,四川绵阳 621010)
对以海沃德猕猴桃残次果提取的巯基蛋白酶进行了动力学研究,考察了一些外加剂对酶活的影响,同时初步探讨了酶液的稳定性。结果表明:以酪蛋白为底物的猕猴桃巯基蛋白酶的 Km值为6.56×10-3mmol,Vmax为163.93mg·mL-1·min-1;在其底物浓度为1.0g/L时,该酶的最适温度和pH分别为55℃和5.5;L-半胱氨酸、2-巯基乙醇、硫代硫酸钠、EDTA以及葡萄糖等外加剂对酶具有明显的激活效果,且EDTA的激活作用最强;抗坏血酸、碘乙酸和过氧化氢等外加剂对酶则具有抑制作用。在最适酶促反应条件下,于4℃温度存放的酶液活性随时间延长呈急剧的降低,并以pH为3.5存放条件下的降低最少,约可保存80%的酶活性。
猕猴桃,巯基蛋白酶,催化,抑制剂,激活剂
1959年Arcus从猕猴桃果实中首次分离获得猕猴桃蛋白酶,因其分子中含有巯基,故也称猕猴桃巯基蛋白酶(Thiol Protease,TP),其在许多功能特性方面与同属巯基蛋白酶的木瓜蛋白酶、菠萝蛋白酶等类似[1]。国内外对其分子量、等电点、Km值、催化功能基团、机理及激活动力学、胍脲和SDS导致的构象与活力变化等进行了较为广泛的研究[1,2-5]。TP可用于降解奶过敏原α乳白蛋白和β乳球蛋白[6],亦可代替木瓜蛋白酶、菠萝蛋白酶等用于生产果冻、啤酒澄清、美容祛斑、农残洗涤等食品、医药和化工等领域[7-9]。海沃德(Hayward)猕猴桃(Actinidia chinensis Planch.)在猕猴桃生产中占有较大的比重,无论是产中还是产后均有大量的残次果,如何针对其开展相关的利用研究,提高资源效益是一个重要的研究课题[10-12]。针对海沃德猕猴桃残次果巯基蛋白酶进行相关动力学及稳定性研究可为其资源开发提供依据与参考,目前未见相关报道。
1 材料与方法
1.1 材料与仪器
pHS-25数显pH计 上海理达仪器厂;Allegra 64R高速冷冻离心机 美国贝克曼库尔特;SHA-B水浴恒温振荡箱 金坛市医疗仪器厂;MD10-14透析袋 直径为16mm,压平宽度为25mm,截留分子量为14000ku,北京瑞达恒辉科技发展有限公司; SHZ-D(Ⅲ)循环真空泵 巩义市英峪予华仪器厂; U-3900紫外可见分光光度计 日本日立科技公司; RE52CS旋转蒸发器 上海爱明仪器有限公司; LGJ-18真空冷冻干燥机 北京松源华兴科技发展有限公司。
1.2 实验方法
1.2.1 酶提取方法 参照文献[13]法修改,即取猕猴桃汁,以1∶6的汁液比加入5%的乙醇液并在25℃下水浴振荡40min经旋转减压蒸发除去溶剂,将pH调至6并用饱和度为80%硫酸铵进行沉淀,最后将沉淀高速离心后的固态部分装入透析袋透析浓缩,再真空冷冻干燥得猕猴桃蛋白酶。
1.2.2 标准曲线 精密称取已在105℃干燥至恒重后的酪氨酸,并用0.1mol/L盐酸液配100μg/mL的酪氨酸标准储备液,对其进行波长扫描。以储备液配0~100μg/mL的11个等梯度酪氨酸标准工作液并在最大吸收波长处测其吸光度,以酪氨酸量为横坐标,吸光值为纵坐标绘制标准曲线。
1.2.3 酶活相关定义 以特定条件下每分钟水解酪蛋白生成1μg酪氨酸所需的酶量为一个活力单位(U),以单位酶的活力即酶比活表示酶蛋白活性大小(U/μg)。
1.2.4 酶活测定 用分光光度法[9],即称1.2.1所得酶0.015g,以磷酸缓冲液定容25mL后移取20mL定容至100mL放置(供试酶液),移取供试酶液1mL置于具塞试管中,加外加剂1mL后在(40±0.2)℃水浴中保温10min,再移取同温保存的酪蛋白液5mL混匀反应10min后加同温保存三氯乙酸溶液5mL终止反应并摇匀过滤,以供试酶液、外加剂和三氯乙酸的乙酸-乙酸钠缓冲液等反应10min后加酪蛋白液的滤液作对照,0.1mol/L盐酸液为空白,在最大吸收波长测定其吸光度。酶比活计算式为:
(2)Do not say that for which you lack adequate evidence.

式中,A为供试酶反应混合液与对照液的吸光度差;AS和CS分别为酪氨酸标准液的吸光度与浓度(μg/mL);12为反应混合液毫升数,1为供试酶液毫升数;n为供试酶的酶液稀释倍数;10为反应时间(min);m为供试酶质量(μg)。
1.2.5 酶动力学 分别以不同pH的磷酸缓冲液、温度、底物浓度等对提取的TP进行基础动力学研究。
1.2.6 酶稳定性 测定TP溶于不同pH缓冲液并在特定温度下放置一定时间或一定温度条件放置不同时间的酶活。
1.2.7 外加剂的影响 测定添加2-巯基乙醇、L-半胱氨酸、葡萄糖、硫代硫酸钠、AA、EDTA、碘乙酸和过氧化氢等后酶的活力。
2 结果与分析
2.1 最大波长的测定
对酪氨酸标液在200~400nm范围内进行扫描,结果如图1所示。
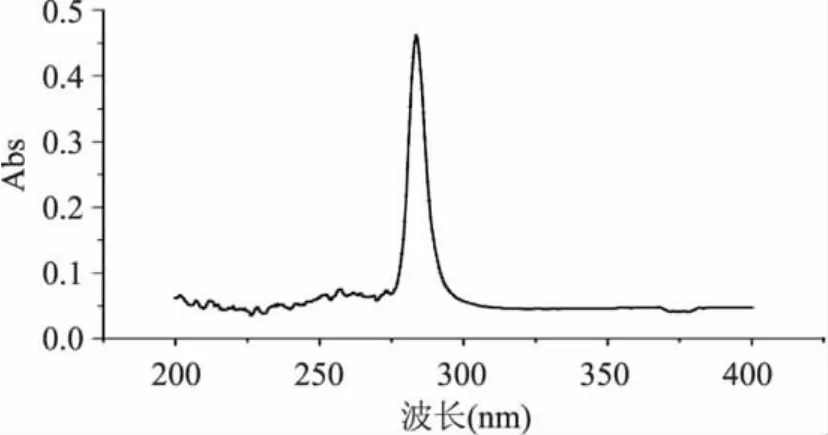
图1 酪氨酸吸光度扫描光谱Fig.1 Tyr absorbency scanning spectrum
由图1可看出,酪氨酸标准液的最大吸收波长为282.5nm。以此波长测定酪氨酸工作液所得标准曲线回归方程为y=0.0004x-0.0011,其相关系数为0.9968。
2.2 反应条件
2.2.1 pH 以40℃的温度对猕猴桃巯基蛋白酶在pH 2.5~7.0范围内的酶活进行实验,其结果见图2。
由图2可看出,TP酶活在pH 5.5时最大,达到108U/μg,其他pH下的酶活均较小且相差不大。与以牛血红蛋白为底物获得的毛花猕猴桃(Actinidia eriantha)酶最适pH为3.8有较大差异[14],其原因一是底物种类和浓度不同引起的,另外则可能与TP来源于不同的猕猴桃等因素有关,有待进一步探讨。

图2 猕猴桃蛋白酶比活与pH的关系Fig.2 Relationship between specific activity of TP and pH
2.2.2 温度 对40~75℃的酶液酶活(pH 5.5)测定结果见图3。
由图3可看出,在40~65℃的温度范围内,其酶活除55℃最高外其余均处于次高且相近的水平,在温度超过65℃后的酶比活则急剧地降低至基本丧失(75℃对应的负值意味酶被高温完全破坏)。与毛花猕猴桃酶最适温度43℃不同[14],是否与酶来源、底物、激活剂、抑制剂等因素有关还有待研究。
2.2.3 底物浓度 在pH 5.5和55℃的温度下测定不同底物浓度下的酶活,其Lineweaver-Burk曲线与回归曲线如图4所示。
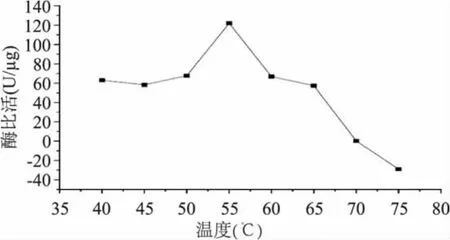
图3 猕猴桃蛋白酶比活与温度的关系Fig.3 Relationship between specific activity of TP and temperature
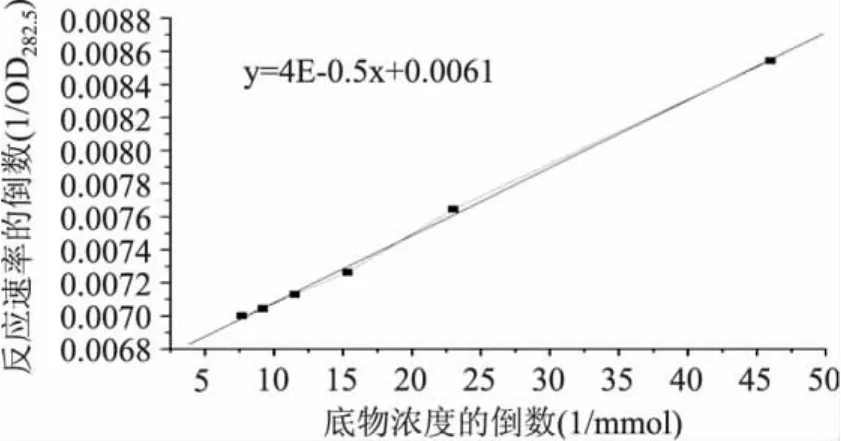
图4 底物浓度对酶反应速率影响的双倒数曲线Fig.4 Effect of the substrate concentration on the enzyme reaction rate
由图4酪蛋白底物对酶反应速率影响的双倒数曲线可求得,猕猴桃巯基蛋白酶的Km为 6.56×10-3mmol,Vmax为163.93mg·mL-1·min-1。此与毛花猕猴桃蛋白酶对牛血红蛋白底物的Km值5.56×10-3mmol较接近[14]。
2.3 酶稳定性
2.3.1 时间稳定性 在4℃下放置不同时间酶液恢复至最佳酶促反应条件(55℃和pH 5.5)下的酶活力,酶活变化见图5。

图5 猕猴桃蛋白酶比活与时间的关系Fig.5 Relationship between specific activity of TP and time
由图5可看出,随存放时间的延长酶活力呈较快的降低趋势,经96h后仅保存约50%的酶活性。有可能是高水分环境增加了酶结构的柔性而致酶缓慢地发生自身水解和构象变化,进而使酶的巯基、氨基、色氨酸残基和组氨酸残基等也被逐渐暴露致酶失活不断加深[15-16]。
2.3.2 pH稳定性 将调不同pH的酶液于4℃放置1h后再调至最佳酶促反应条件下进行酶活测定,结果见图6。
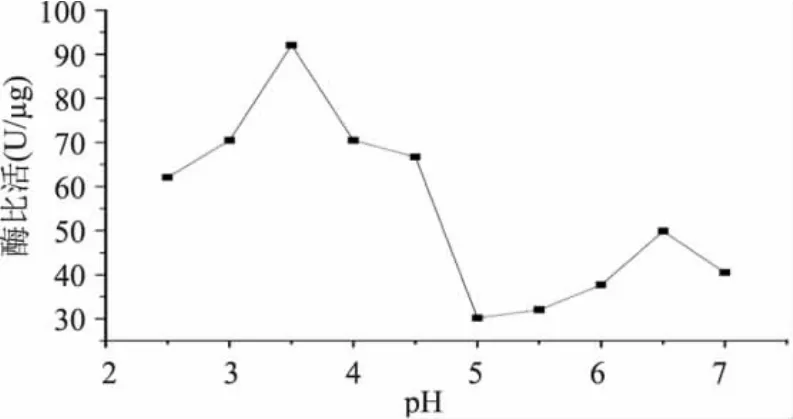
图6 pH对猕猴桃蛋白酶稳定性的影响Fig.6 Effect of the stability of TP with different pH
由图6可看出,在不同pH的溶液中的猕猴桃蛋白酶的活力保存率有较大差异,其中,在pH 3.5左右酶活力保存率最大,约可达最大酶活的80%,但最适pH条件下的酶活力保存率约为25%。总之,较酶反应最适pH更低的条件(pH在2.5~4.5之间)有利于TP的活性保持,可能这种条件更利于TP结构的稳定[15-16]。
2.4 外加剂的影响
几种外加剂对酶活的影响分别见表1和图7。

表1 外加剂对猕猴桃蛋白酶活的影响Table 1 The effect of differente additives to the activity of TP
由表1可看出,L-半胱氨酸、硫代硫酸钠、2-巯基乙醇、葡萄糖、EDTA对TP有一定的激活作用,且以EDTA的激活作用最强,AA、碘乙酸和过氧化氢对TP有抑制作用,且过氧化氢的抑制作用最强。其可能原因是硫代硫酸钠可对游离的巯基进行保护[16],2-巯基乙醇能够将酶分子中的二硫键还原成自由巯基,与AA对菠萝蛋白酶活没有提高相一致[15],其机理有待进一步探讨。

图7 猕猴桃蛋白酶比活与EDTA浓度的关系Fig.7 Relationship between specific activity of TP and EDTA concentration
由图7可看出,不同的EDTA浓度对酶活的影响不同,酶活在低浓度时随EDTA浓度的增大而增大,且在EDTA浓度为0.1mol/L时达最大,之后则随浓度继续增大而酶活急剧下降。适量的EDTA并不影响酶分子且还可螯合金属离子而使其酶活增大,当EDTA过量,则其电荷使酶分子过分伸展,而不利于其催化作用的发挥[17]。
3 结论
海沃特猕猴桃巯基蛋白酶在pH为5.5、温度为55℃和EDTA浓度为0.1mol/L条件下的酶活最大,以酪蛋白为底物测得的Km值为6.56×10-3mmol,其Vmax值为163.93mg·mL-1·min-1。
在4℃存放的猕猴桃巯基蛋白酶液,其酶活随时间延长急剧降低,但适宜的酸性环境利于减缓酶活降低。2-巯基乙醇、L-半胱氨酸、硫代硫酸钠、葡萄糖、EDTA等对TP有一定的激活作用,而AA、碘乙酸和过氧化氢则对TP有一定的抑制作用。
[1]林沁瑛,陈素丽,黄琼英.中华猕猴桃蛋白酶分离提纯及性质研究[J].厦门大学学报,1986,25(4):347-353.
[2]冯成利,左玉萍,党蕊叶.猕猴桃蛋白酶提取的工艺技术研究[J].西北农业学报,2006,15(6):127-129.
[3]林沁瑛,颜思旭.十二烷基硫酸钠对猕猴桃蛋白酶的变性作用[J].厦门大学学报:自然科学版,1988,27(6):694-698.
[4]林沁瑛,陈素丽,刘红,等.中华猕猴桃蛋白酶催化功能基团的研究[J].厦门大学学报:自然科学版,1987,26(3): 348-353.
[5]颜青,林青松,颜思旭.中华猕猴桃蛋白酶经有机溶剂处理后的激活动力学行为[J].厦门大学学报:自然科学版,1996,35(5):448-451.
[6]Lourdes Va'zquez-Lara,Salvador R Tello-Solı's,Lorena Go'mez- Ruiz,et al.Degradation of α - lactalbumin and β-lactoglobulin by actinidin[J].Food Biotechnology,2003,17 (2):117-128.
[7]G I Katsaros,G Tavantzis,P S Taoukis.Production of novel dairy products using actinidin and high pressure as enzyme activity regulator[J].Innov Food Sci Emerg,2010,11(1): 47-51.
[8]梁楚泗,黄维南,李璞君,等.中华猕猴桃综合利用的研究—(1)中华猕猴桃蛋白酶的研制及其在啤酒工业上的应用[J].食品与发酵工业,1989(1):76-82.
[9]M Aminlari,S S Shekarforoush,H R Gheisari,et al.Effect of actinidin on the protein solubility,water holding capacity,texture,electrophoretic pattern of beef,and on the quality attributes of a sausage product[J].Journal of Food Science,2009,74(3): C221-C226.
[10]郑晓琴,陈彦,李明章,等.猕猴桃加工技术发展现状及四川猕猴桃产业近况[J].资源开发与市场,2009,25(6): 531-533.
[11]朱鸿云.我国猕猴桃发展现状、问题及解决途径[J].林业科技开发,1997(4):11-12.
[12]王岸娜,吴立根,王晓曦.猕猴桃加工、研究现状[J].果蔬深加工,2006,22(3):67-70.
[13]王岸娜,刘小彦,吴立根,等.猕猴桃蛋白质的分离及类型鉴定[J].河南科技大学学报:自然科学版,2009,30(3): 25-29.
[14]梁楚泗,李树瑜,杨政蓓.毛花猕猴桃蛋白酶的提纯和性质[J].植物资源与环境,1999,8(3):1-6.
[15]潘江球.影响菠萝蛋白酶活力主要因素的研究[D].海口:华南热带农业大学,2003.
[16]欧英杰.菠萝蛋白酶酶活力影响因素及测定酶活力方法的研究进展[J].广东化工,2010,37(5):49-51.
[17]孙国梁.生姜蛋白酶的提取及其在肉类嫩化中的应用[D].泰安:山东农业大学,2008.
Catalytic characteristics and stability of thiol protease from Hayward kiwifruit
ZHANG Qian1,CHEN Yan1,2,*,LIN Xiao-yan1,2,LIN Jin-feng1
(1.School of Material Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China;
2.Engineering Research Center of Biomass Materials,Ministry of Education,Mianyang 621010,China)
The kinetics of thiol protease(TP)from defective Hayward fruits were investigated,as well as the impact of some additives on the activity and stability of enzyme solution.The results showed that Kmvalue of TP was 6.56× 10-3mmol,casein as substrate,and its Vmaxwas 163.93mg·mL-1·min-1.The optimum conditions of TP reactions were 55℃ and pH 5.5 at 1.0g/L casein concentration.The additives such as L-cysteine,2-mercaptoethanol (2-ME),sodium thiosulfate,EDTA and glucose had significant promotion effect on TP activity,among which EDTA exhibited the best activation.However,the addition of ascorbic acid(AA),iodoacetic acid and hydrogen peroxide had inhibitory effect.Under the optimum enzymatic reaction conditions,the activity of protease had a sharp drop when storage time of protease solution increased at 4℃.The drop was least when pH was 3.5,and about 80%of the activity could still be reserved.
kiwifruit;thiol protease;catalysis;inhibitor;activator
TS255.1
A
1002-0306(2012)06-0205-04
2011-06-10 *通讯联系人
张倩(1986-),女,在读硕士研究生,研究方向:应用化学。
四川省科技厅科技支撑项目(2011NZ0004)。

