臭椿多倍体诱变的初步研究
岳建芳
(山西林业职业技术学院,山西 太原 030009)
一般所讲的多倍体(polyploid)是指染色体数目在3(3x)或3以上(>3x)的个体。多倍体包括同源多倍体和异源多倍体,前者指增加的染色体来源于同一物种,如马铃薯、香蕉、苜蓿、长山药等;后者则指增加的染色体来源于不同的物种或属,如红花、栗子、小黑麦、菊花等。臭椿[Ailanthus altissima(Mill.)swingle.]又名臭楮,落叶乔木,高达 20 m,树皮平滑有直纹。单数羽状复叶,互生,长45 mm~60 mm.花小,绿色,杂性,花瓣5片;翅果长椭圆形,淡黄绿色,花期4月至5月,果熟期8月至9月。
1 材料与方法
1.1 试验材料准备
试验材料为苦木科(Simaroubaceae)臭椿属(Ailanthus)臭椿,种子采于山西林业职业技术学院东山实验林场。选用大田土6份配比充分腐熟的马粪4份为培养土,用50%多菌灵可湿性粉剂对培养土进行消毒,用量50 g/m3.苗床宽1.5 m,整平。将消毒后的营养土装入规格为10 cm×10 cm的塑料营养钵中,再将营养钵放于苗床上,排列整齐,浇透水,备用。用凉水浸种1 d,第2天均匀播于营养钵中,每个钵中播3粒种子,之后覆土、浇水。
1.2 药剂制备
1)0.4%秋水仙碱母液的配制。将1 g秋水仙碱用少量95%的分析纯酒精充分溶解,再加入249 mL水。
2)0.2%秋水仙碱溶液+1.0%琼脂凝胶的配制。取200 mg琼脂溶解于10 mL去离子水中加热约10 min.加热前先用玻璃笔做记号,加热后再加水至记号处。取0.4%秋水仙碱母液10 mL与上述溶液充分混合,水密保存(保证溶液基本不变)。
1.3 诱变
1)判断顶芽萌动。2)整苗,每个营养钵中保留1株~3株健康苗木。3)将琼脂秋水仙碱凝胶水浴加热至38℃变成溶胶,手掌保温。4)用竹签挑取1滴溶胶,涂抹于顶芽(不得有气泡)及子叶基部下方。5)涂后用透明塑料杯盖上,防止漏气,置于温室。6)处理时间顺序延迟上述方法。7)处理结束后去掉塑料杯,晒干琼脂凝胶,再用镊子将琼脂凝胶撕掉,精确控制处理时间。
1.4 观察生物学性状
处理结束,在幼苗恢复正常生长后,通过观察可以看到植株生长受阻、植株畸形、叶色浓绿、叶片皱缩等明显变化,以此为标准计算诱变成功率。
2 结果与分析
2.1 诱变率列表
以秋水仙碱涂抹法处理臭椿幼苗,幼苗变异情况见表1.

表1 秋水仙碱处理幼苗的变异情况
由表1可以看出,用秋水仙碱处理植株72 h的诱变率是46.88%,48 h的诱变率是62.07%,24 h的诱变率是61.90%.
2.2 臭椿株高分析
不同处理时间下的臭椿高度见表2.

表2 在不同处理时间下的臭椿高度cm
对上述数据进行方差分析,见表3.
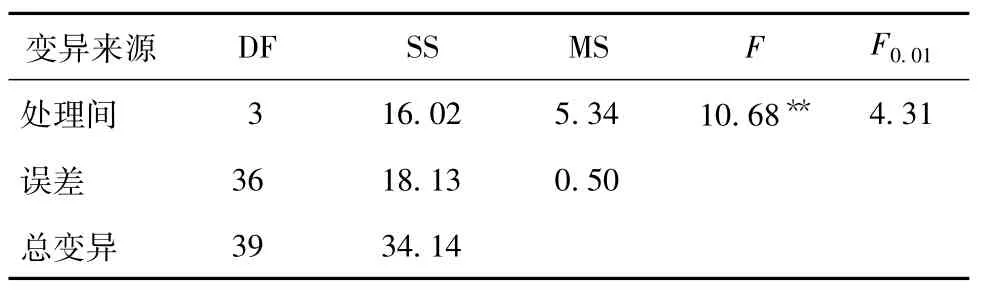
表3 不同处理臭椿幼苗高度的方差分析
由表3得知,F=10.68>F0.01=4.31,表明秋水仙碱的不同处理间臭椿幼苗高度有显著差异。
采用Tukey法对不同处理平均株高进行多重比较,见表4.

表4 不同处理平均株高的多重比较
由表4可知,对照与处理间存在显著差异,但各处理间差异不明显。
2.3 臭椿叶形指数分析
不同处理的臭椿叶形指数见表5.对表5数据进行方差分析,见表6.

表5 臭椿在不同处理的叶形指数
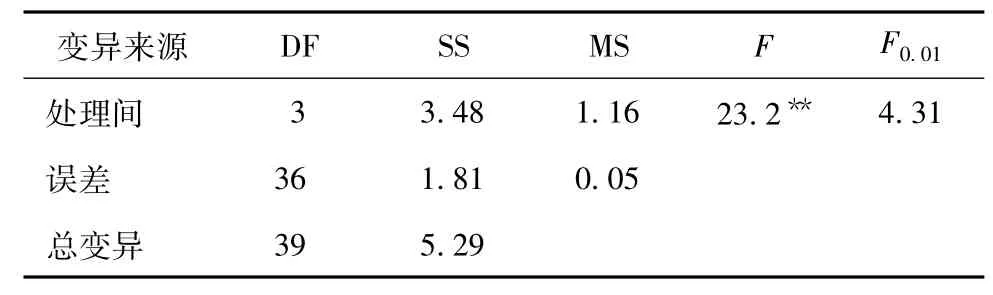
表6 不同处理臭椿幼苗叶形指数的方差分析
由表6知,F=23.2>F0.01=4.31,表明秋水仙碱的不同处理间臭椿幼苗叶形指数有显著差异。
利用Tukey法对不同处理的平均叶形指数进行多重比较,见第39页表7.
由表7可知,对照与处理间存在显著差异,且各处理间差异明显。

表7 不同处理时间下平均叶形指数的多重比较
2.4 臭椿形态分析
将臭椿处理24 h后,植株比处理48 h的高,叶色比对照浓绿,叶畸形不明显。将臭椿处理48 h后,植株明显矮小,叶色浓绿,节间缩短,叶畸形。臭椿处理72 h后,植株矮化明显,叶畸形明显,叶色浓绿,节间明显缩短。
3 讨论
3.1 诱变植株的判定
3.1.1 生长受阻
因为秋水仙碱具有较大的毒害作用,所以无论是分裂期细胞还是间期细胞都会有很长时间停止生长,细胞必须将其分解才能继续生长。
3.1.2 叶色浓绿
虽然秋水仙碱造成核基因染色体加倍,但并不直接影响细胞质基因。由于核基因数目增加的剂量效应,会间接影响细胞质基因的表达,使细胞质中叶绿体的数量增加,或者使叶绿素含量增加,从而产生多倍体,致使叶色浓绿。
3.1.3 叶片皱缩
由于有丝分裂中期细胞在整个分生组织中所占比值很小,且成孤岛状分散存在,而秋水仙碱只对中期细胞起作用。因此,加倍后的多倍体细胞将以孤岛状存在于二倍体细胞的分隔包围中。多倍体细胞虽然体积较大,但分成双倍的染色体需要耗费更多的能量和时间,其生长速率远远低于二倍体细胞。所以,二倍体细胞分裂后代的体积在或长或短的时间后必将大于多倍体细胞团,会从叶面中鼓起,造成多倍体细胞嵌合体叶片的皱缩。
3.1.4 植物畸形
由于秋水仙碱破坏了中期细胞的纺锤丝,使分离分裂细胞的植物极(N)、动物极(S)这种方向性的立体感被破坏,造成生物个体紊乱。这个基质非常复杂,这种紊乱将会造成植株畸形。作用机理:抑制中期细胞纺锤丝的形成,由于纺锤丝不能拉向两极,从而造成染色体加倍,这就说明在细胞分裂的其它时间非但不能引起染色体加倍,反而有毒害作用。但是,在细胞有丝分裂平均长达9.5 h的时间内,中期分裂只需20 min左右。因此,在特定时间内,细胞镜片视野内中期细胞分裂只占极少数。
3.2 试验的特点与不足
由于笔者未查阅到关于臭椿多倍体诱变的报道,因此,本试验具有开拓性;由于多倍体可能提高药用植物有效成分的含量,因此对臭椿多倍体诱变的研究具有极其重要的意义。多倍体植物由于基因的剂量效应,使其不但有许多优良的特征,还蕴育着丰富的遗传变异潜力。但就生产来讲,我们要同时考虑药用部分的产量和活性成分的含量,以取得最佳效益。
笔者只对臭椿的苗期形态特征进行了初步判定(采用的种子是非纯合体),而细胞学鉴定和染色体组核型分析还有待于进一步的研究观察。
[1]张天真.作物育种学总论[M].北京:中国农业出版社,2003.
[2]薛建平.药用植物生物技术[M].合肥:中国科学技术出版社,2005.
[3]胡芳名,龙光生.经济林育种学[M].北京:中国林业出社,1995.
[4]张汉明,许铁锋,郭美丽,等.药用植物的多倍体育种[J].中草药,2002,33(7):1-3.
[5]武振华,牛炳韬,王新宇.药用植物染色体加倍的研究进展[J].西北植物学报,2005(12):2 569-2 574.
[6]吴玉香,高建平,赵晓明.黄芪多倍体的诱导与鉴定[J].中药材,2003,26(5):315-316.
[7]南京中医药大学编著.中药大辞典[M].上海:上海科学技术出版社,1989.

