不同有机溶剂对雨生红球藻中虾青素提取成分的影响
李 婷, 韩丽君 袁 毅
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100049)
不同有机溶剂对雨生红球藻中虾青素提取成分的影响
李 婷1,2, 韩丽君1, 袁 毅1
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100049)
研究了有机溶剂提取雨生红球藻中虾青素过程中, 不同液料比对提取效率的影响, 并以分光光度法及高效液相色谱法(HPLC), 检测了不同有机溶剂对提取组分及主要组分(叶绿素和虾青素)含量的影响。结果显示, 提取率随着液料比的增加而上升, 当液料比大于20:1时, 其升高变缓, 趋于平衡; 不同有机溶剂提取物的化学组分无明显差异, 但各组分含量的比例差异较大, 如二氯甲烷提取物在 480 nm下吸光度为30.64±0.54, 高于丙酮、乙酸乙酯及甲醇(分别为27.68±5.54、25.32±8.43及24.31±0.79), 而645和663 nm下吸光度为2.54±0.46和5.33±0.19, 较丙酮、三氯甲烷、无水乙醇及甲醇(分别为5.70±0.71、12.87±0.14、7.60±0.23及6.44±0.28)低, 说明该种溶剂对于虾青素有较高的提取效率, 但其挥发性强且毒性大, 而无水乙醇的提取率略低于二氯甲烷, 具有安全、低毒的优势, 因此无水乙醇是较为合适的虾青素提取溶剂。
虾青素; 雨生红球藻(Haematococcus pluvialis); 溶剂类型; 分光光度法; HPLC
虾青素(astaxanthin, 3, 3' -二羟基-4, 4 -二酮基-β,β' -胡萝卜素), 是水产动物体内最主要的类胡萝卜素之一。据报道, 虾青素的抗氧化性比 β-胡萝卜素高10倍以上, 比维生素E高500倍以上, 被称为“超级维生素E”[1]。虾青素还可作为着色剂应用于贵重水产品及禽类养殖以增加其附加商品值, 此外, 人体也可选择性积累虾青素, 增加机体免疫力等, 因此近年来受到广泛关注。
目前, 虾青素主要来源于化学合成及虾蟹下脚料、红法夫酵母(Phaffia rhodozyma)和雨生红球藻(Haematococcus pluvialis)。其中化学合成困难且安全性未被证实[2]; 虾蟹下脚料多采用碱提, 对环境污染较为严重; 红法夫酵母含量低需要进行高产菌株选育。
雨生红球藻是一种广泛分布于自然界的淡水绿藻, 它有两种细胞形态, 即绿色的营养细胞和红色的厚壁孢子, 只有厚壁孢子能够积累类胡萝卜素,其中80%以上为虾青素[1]。在雨生红球藻中, 70%的虾青素以单酯的形式存在, 25%以二酯存在, 而只有约5%为游离虾青素[3]。虽然雨生红球藻的应用和研究虽然受到了微藻研究界的重视, 但目前雨生红球藻培养还处于实验室阶段, 大规模生产尚存在许多问题。
另外, 红球藻的色素提取比较困难, 常用方法包括有机溶剂提取、植物油提取[4]及超临界二氧化碳提取[5-7]等。其中植物油提取虽然安全性较高, 但植物油沸点高, 后期处理不易; 超临界二氧化碳提取是现在较为流行的方法, 但其成本较高。目前工业上的分离提取常用有机溶剂法, 因为有机溶剂容易分离且可以重复利用, 具有成本低效率高的优点。因此本文采用超声波辅助有机溶剂提取的方法, 比较了不同溶剂提取的雨生红球藻虾青素提取物的效率及成分差异, 目的在于寻找提取雨生红球藻中虾青素安全、有效的有机溶剂。
1 材料与方法
1.1 实验材料及试剂
雨生红球藻, 云南爱尔发生物技术有限公司提供, 冷冻干燥并低温破碎;
甲醇、丙酮、二氯甲烷、三氯甲烷、无水乙醇、乙酸乙酯均为分析纯试剂。
1.2 实验仪器
Unico UV-2000分光光度计: 尤尼科(上海)仪器有限公司; 离心机: SC-3610低速离心机, 安徽中科中佳科学仪器有限公司; 高效液相色谱仪: 岛津CBM-20A 系统控制器; LC-6AD/7A 高压泵;SPD-20A检测器。
1.3 实验方法
1.3.1 虾青素含量的测定
称取冷冻干燥并破碎后的藻粉约0.5 g, 加入20 mL丙酮, 研磨10 min后抽滤, 收集上清, 重复该步骤至藻渣呈灰白色, 合并上清, 棕色容量瓶(20℃,100 mL)定容, 稀释10倍后测定其480、645 及663 nm下的吸光值, 每个样品读数3次。测定3个平行。整个实验在避光条件下进行。
1.3.2 提取液料比的确定
称取6份红球藻粉置离心管中, 分别加入5、10、15、20、30、50倍体积的丙酮, 超声提取 3 min后3500 r/min离心 10 min, 收集上清液至棕色容量瓶(20℃, 100 mL)定容, 分光光度计测定其480、645及663 nm下吸光度, 每个样品读数3次。重复3次, 取平均值。
1.3.3 不同溶剂对虾青素提取的影响
用丙酮、三氯甲烷、二氯甲烷、乙酸乙酯、无水乙醇、甲醇等实验室常用溶剂以2.3.2方法进行红球藻中虾青素的提取实验, 每个样品读数3次, 每种溶剂重复 3次, 取平均值, 并将各溶剂提取物进行HPLC分析。
色谱条件[8]: 色谱柱为岛津C18反相柱(4.6 mm×25 cm), 流动为丙酮(A)和甲醇/水(9:1), 洗脱程序为B相80%~20% 洗脱25 min, 然后20%保持10min,最后20%~80%洗脱5 min, 流速1.25 mL/min, 检测波长 476 nm, 柱温 25℃, 进样量 10 μL。
2 实验结果
2.1 红球藻中虾青素含量
根据下列公式[9]计算虾青素含量, 结果见表1。

表1 雨生红球藻中虾青素含量计算结果Tab. 1 Content of astaxanthin in the Haematococcus pluvialis
C(mg/kg) = 4.6×(OD480- 0.638×OD645+ 0.114×OD663)×稀释倍数
其中C为红球藻中虾青素的质量浓度(mg/kg);OD480、OD645、OD663分别为提取液在 480、645及663 nm处的吸光度值; 稀释倍数为提取液终体积(mL)与称取藻粉质量m(g)之比。
2.2 虾青素提取液料比的确定
以 5、10、15、20、30、50倍体积的丙酮提取雨生红球藻中的虾青素, 其结果见图 1。由图 1可知 20倍体积以下时, 提取效率随溶剂的增加而迅速上升,而后增加不明显, 因此, 液料比为20时为最佳比例。
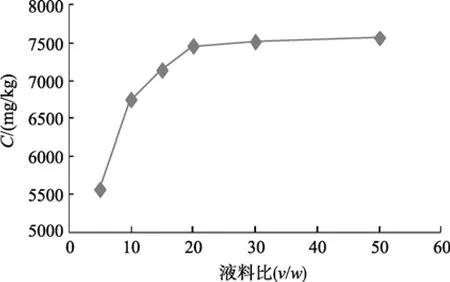
图1 不同液料比的虾青素提取效率Fig. 1 Extraction rate of astaxanthin with different solvent volume/algal weight ratio
2.3 溶剂对虾青素提取的影响
不同溶剂以 20倍体积提取虾青素并定容后,Unico UV-2000测定其各吸光度值, 计算得到其与称取藻粉质量之比(表2)。不同溶剂提取物35℃旋转蒸发干燥后, 溶于色谱纯丙酮, 溶液以0.22 μm滤膜过滤后进行HPLC分析, 结果显示, 主要洗脱峰差异不大(图2)。图2-A中标示了虾青素酯的洗脱峰, 由于其结合的脂肪酸不同, 导致保留时间有所差异, 所以虾青素酯峰分布较广, 而叶绿素的峰与虾青素酯峰混在一起, 保留时间在20~25 min之间。另外, 游离虾青素在甲醇和乙醇中溶解度较小, 综合考虑液料比可以提高其提取效率。
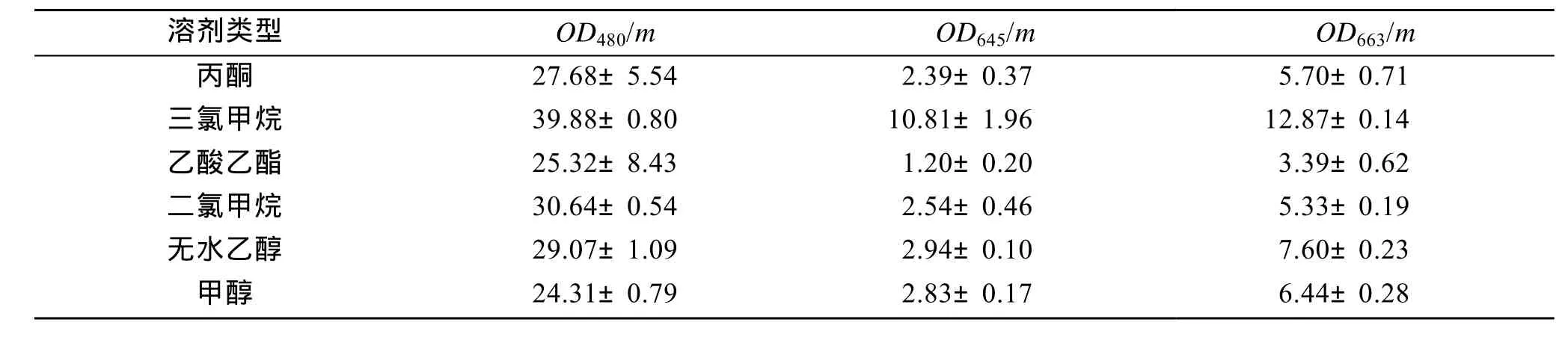
表2 不同溶剂虾青素提取液的吸光度值与藻粉质量之比(mean±S.D.)Tab. 2 Absorbance value/algal weight ratio extracted with different solvents (mean±S.D.)

图2 不同溶剂提取物的HPLC图谱Fig. 2 HPLC chromatography of different extractsA. 丙酮; B. 三氯甲烷; C. 乙酸乙酯; D. 二氯甲烷; E. 无水乙醇; F. 甲醇A.acetone; B. chloroform; C.ethyl acetate; D.dichloromethane; E. absolute ethanol; F.methanol
3 讨论
本实验所采用的雨生红球藻粉虾青素质量分数为 0.9%, , 该雨生红球藻质量分数比报道的虾青素质量分数(1.5%~3%)低[1], 其原因可能是虾青素在有氧环境中易发生氧化, 在保存或提取过程中有所损失。以 5倍体积丙酮提取虾青素时, 提取率仅为61.9%, 而在液料比为20:1时, 一次提取率即可达到82.9%, 随后提取率随液料比增加不明显, 可以看出,液料比为20:1时较为合适。
有机溶剂浸提红球藻时, 提取液中不但含有类胡萝卜素(其中 80%以上为虾青素), 还有叶绿素, 而叶绿素除了在645 nm和663 nm有最大吸收外, 在480 nm也有较大吸收, 对虾青素含量的测定有一定的影响, 因此, 本实验除了测定提取液在480 nm处的吸收值, 同时测定了其在645、663 nm的吸收值,以校正叶绿素对虾青素含量测定的影响。从结果可以看出, 乙酸乙酯提取物中叶绿素含量最低, 但同时其虾青素提取量也较低; 虽然三氯甲烷 OD480/m值最大, 但其他两个值均最高, 即叶绿素和虾青素的含量都较高, 因此不能判定三氯甲烷虾青素提取率最高; 而二氯甲烷提取物同时具备了 OD480/m值较大, 后两个值较小的优点, 即提取物中虾青素含量高, 而叶绿素含量低。但是二氯甲烷挥发性强、毒性较大, 虽然无水乙醇提取效率稍次于二氯甲烷,但由于具安全性高的优点, 使无水乙醇成为最适宜的溶剂。
[1] Lorenz R T, Cysewski G R.Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J]. Tibtech Appil, 2000, 18: 160-167.
[2] Dominguez-Bocanegra A R, Ponce-Noyola T, Torres-Munoz J A. Astaxanthin production by Phaffia rhodozyma and Haematococcus pluvialis: a comparative study[J]. Applied Microbiology and Biotechnology,2007, 75(4): 783-791.
[3] Miao F P, Lu D Y, Li Y G., et al. Characterization of astaxanthin esters in Haematococcus pluvialis by liquid chromatography-atmospheric pressure chemical ionization mass spectrometry[J]. Analytical Biochemistry,2006, 352(2): 176-181.
[4] Kang C D, Sim S J.Direct extraction of astaxanthin from Haematococcus culture using vegetable oils[J].Biotechnology Letters, 2008, 30(3): 441-444.
[5] Krichnavaruk S, Shotipruk A, Goto M, et al. Supercritical carbon dioxide extraction of astaxanthin from Haematococcus pluvialis with vegetable oils as co-solvent[J]. Bioresource Technology, 2008, 99(13): 5556-5560.
[6] Machmudah S, Shotipruk A, Goto M, et al. Extraction of astaxanthin from Haematococcus pluvialis using supercritical CO2and ethanol as entrainer[J]. Industrial& Engineering Chemistry Research, 2006, 45(10):3652-3657.
[7] Nobre B, Marcelo F, Passos R, et al., Supercritical carbon dioxide extraction of astaxanthin and other carotenoids from the microalga Haematococcus pluvialis[J]. European Food Research and Technology,2006, 223(6): 787-790.
[8] Sarada R, Vidhyavathi R, Usha D, et al. An efficient method for extraction of astaxanthin from green alga Haematococcus pluvialis[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7585-7588.
[9] 韩春梅, 刘建国, 张勇.不同激素配伍对雨生红球藻(Haematococcus pluvialis)细胞生长和虾青素积累的调节作用、藻株差异及应用[J]. 海洋与湖沼, 2009,40(4): 430-436.
Effect of Solvents on extract of astaxanthin from green algae Haematococcus pluvialis
LI Ting1,2, HAN Li-Jun1, YUAN Yi1
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Graduate University of Chinese Academy of Sciences, Beijing 100049, China)
Mar.,14,2011
Astaxanthin; Haematococcus pluvialis; Slovent types; Spectrophotography; HPLC
In this paper, the effects of different solvent-algae ratios and solvent types on the extract of astaxanthin from H. pluvialis were investigated using methods of spectrophotography and high performance liquid chromatography (HPLC). The results showed that extract capacity is positively correlated to the solvent-algae ratio. The extract capacity was rapidly increased with the increase of solvent-algae ratio, and the tendency slowed down when the ratio reached 20:1 (v/w). The solvent type did not affect the components of extracts, but it influenced the component content. Extract using dichloromethane obtained high proportion of astaxanthin (the OD480is 30.64±0.54,which is higher than most of other solvents), and low content of chlorophyll (the OD645is 2.54±0.46, and OD663is 5.33±0.19, which are lower than most of other solvents). However, dichloromethane possesses strong volatility and toxicity. The extract capacity of absolute ethyl alcohol is slightly lower than dichloromethane, but it is much less toxic and more safe than dichloromethane. Hence, absolute ethyl alcohol is the best solvent than others for astaxanthin extract.
P745
A
1000-3096(2012)07-0034-05
2011-03-14;
2011-04-25
国家高技术研究发展计划项目(863计划)(2007AA091604)
李婷(1985-), 女, 山西运城人, 硕士研究生, 从事海洋生物活性物质的研究, 电话: 0532-82898702, E-mail: l.double.t@163.com;韩丽君, 通信作者, 电话: 0532-82898702, E-mail: ljhan@qdio.ac.cn
(本文编辑:康亦兼)

