MDCK细胞库的建立及其生物学特性研究
王家敏 ,平 玲 ,沈武玲 ,徐水林 ,魏园园 ,马忠仁 ,乔自林
(1.甘肃省动物细胞工程技术研究中心,甘肃兰州730030;2.西北民族大学生命科学与工程学院,甘肃兰州730030;3.兰州民海生物工程有限公司,甘肃兰州730010)
MDCK细胞系(Madin-Darby canine kidney cells)是从犬肾组织中分离培养获得的上皮样贴壁细胞,该细胞系可连续传代[1]。MDCK细胞系可以用于多种病毒的繁殖和纯化,如禽流感病毒(Avian influenza virus,AIV)、呼肠孤病毒(Reovius)、腺病毒(Adenovirus)、犬细小病毒(Canine parvovirus,CPV)、猫粒细胞缺乏症病毒(Feline panleukopenia virus,FPLV)等。近年来,大量研究表明,MDCK细胞系可以替代鸡胚用于流感及禽流感病毒的监测、研究及其疫苗生产[2-5]。
本研究从ATCC,CCTCC,北京协和细胞资源中心及某企业引进4株MDCK细胞系,建立相应的细胞库,并对引进细胞系的基本生物学特性进行了研究,旨在为开展MDCK细胞及流感细胞基质疫苗的研究提供基础理论依据和细胞资源。
1 材料和方法
1.1 材料
供试仪器:CKX41型荧光倒置相差显微镜(Olympus),CX21型普通显微镜(Olympus),液氮罐,超净工作台,CKX40-32PH型倒置相差显微镜(Olympus),3110 型 CO2培养箱(Thermo)。
试验材料:胎牛血清(兰州民海),DMEM(Gibco),胰蛋白酶(Gibco),DMSO(Thermofisher),TSB(DIFCO),THIO(DIFCO),秋水仙素(Sirius进口分装),脂质体(LipofectamineTM2000,invitrogen),红色荧光蛋白质粒(pDsRedMonomer-N1,Clontech),Hoechst33258(Sigma)等。
1.2 方法
1.2.1 细胞引进及细胞库的建立 分别从ATCC(购买)、CCTCC(购买)、北京协和细胞资源中心(购买)及某企业(赠送)引进4株MDCK细胞系,扩增培养后冻存,分别建立种子细胞库和工作细胞库。
1.2.2 生物学特性研究
1.2.2.1 复苏细胞 从液氮罐中取出冻存管,按照常规方法复苏细胞,2 h后换加等量的新鲜完全培养基,降低DMSO对细胞的损伤[6]。
1.2.2.2 活力检测 完成细胞复苏后,取少量细胞悬液,运用台盼蓝染色法进行细胞活力测定[7]。
1.2.2.3 形态观察 培养过程中用生物倒置显微镜观察细胞的生长形态,并拍照。
1.2.2.4 生长曲线 将复苏后传代1次的细胞,调整细胞密度为1.0×104个/mL,按每孔1 mL接种到24孔培养板上,置于37℃的CO2培养箱中培养,每隔24 h消化3孔计数细胞量,直至细胞密度降低为止,绘制生长曲线并求得最大增殖密度和倍增时间(PDT)[8]。
1.2.2.5 微生物污染检测
1.2.2.5.1 细菌、真菌检测 传代细胞均用无抗生素的培养基。在培养过程中肉眼观察培养基是否出现浑浊现象,并在显微镜下观察有无活动的黑色颗粒;从培养瓶中取2 mL细胞培养基分别加入THIO和TSB培养基中,培养14d观察结果。
1.2.2.5.2 病毒检测 利用直接观察法、细胞培养法及红细胞吸附法检测4个来源的细胞[9]。
1.2.2.5.3 支原体检测 运用培养法及DNA荧光染色法[9]对4个来源的细胞进行检测。
1.2.2.6 染色体分析 按常规方法进行染色体制片,Gimesa染色后油镜下观察并拍照,对50个铺展完好的中期相的染色体数目进行统计[10]。
1.2.2.7 荧光蛋白质粒转染表达 采用红色荧光蛋白质粒进行转染表达[11]。
2 结果与分析
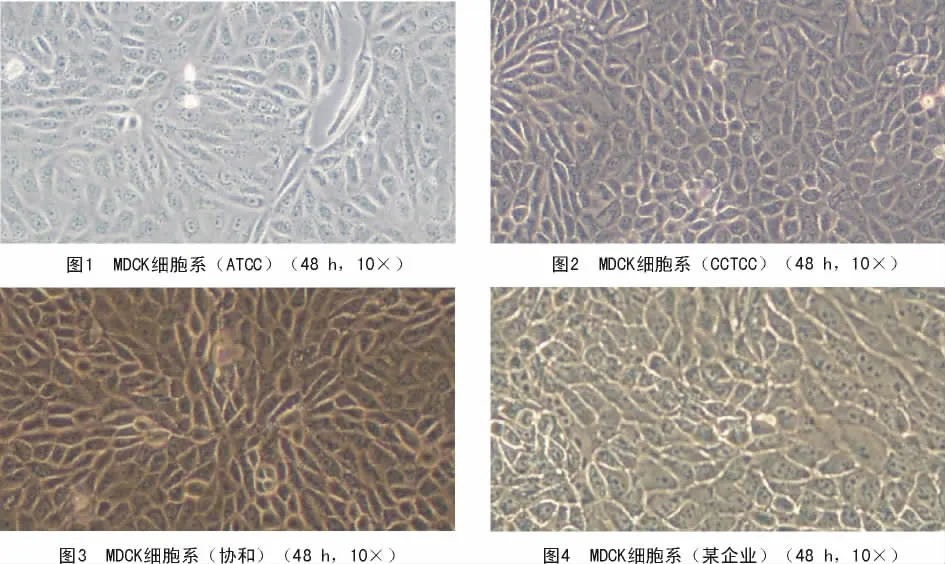
2.1 MDCK细胞系形态学观察
分别复苏4株MDCK细胞系,培养至48 h,显微观察发现,细胞形态较为规则,均呈扁平状,贴壁后呈三角形及不规则的多角形,中央有扁圆形细胞核,细胞之间相互衔接或呈镶嵌状紧密排列,细胞增殖较快,生长旺盛。复苏后细胞生长状态良好(图 1~4)。
2.2 MDCK细胞系复苏细胞活率
MDCK(ATCC)细胞系复苏细胞活率最少达到 91.5%,平均为 95.2%;MDCK(CCTCC)细胞系复苏细胞活率最少达到92.8%,平均为96.6%;MDCK(协和)细胞系复苏细胞活率最少达到93.7%,平均为95.1%;MDCK(某企业)细胞系复苏细胞活率最少达到91.3%,平均为97.2%。
2.3 复苏MDCK细胞系生长曲线
4株MDCK细胞系生长曲线均呈S型(图5),其中,MDCK(ATCC)细胞系最大增殖密度6.62×105个 /mL,平均倍增时间 23.51h;MDCK(CCTCC)细胞系最大增殖密度为6.58×105个/mL,平均倍增时间为24.12 h;MDCK(协和)细胞系最大增殖密度为6.29×105个/mL,平均倍增时间为24.73 h;MDCK(某企业)细胞系最大增殖密度为6.86×105个 /mL,平均倍增时间为 23.48 h(表 1)。

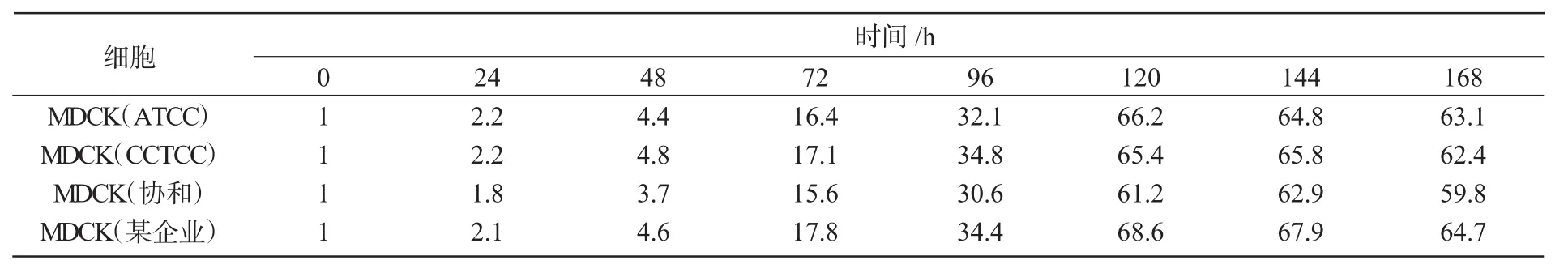
表1 MDCK细胞系不同时间下细胞密度(×104个/mL)
2.4 微生物污染检测
2.4.1 细菌、真菌检测 4株细胞系在培养过程中均未发现培养液浑浊及活动的黑色颗粒;THIO和TSB培养基检测均为阴性,并且阴性、阳性对照成立。
2.4.2 病毒检测 在培养过程中,利用倒置相差显微镜观察未见病毒引起的细胞病变现象;将4株细胞系分别接种至猴源细胞、人源二倍体细胞和同种不同批次的细胞,亦未见病毒引起的细胞损伤及病变现象;红细胞吸附试验为阴性。
2.4.3 支原体检测
2.4.3.1 培养法 细胞培养液分别接入支原体琼脂培养基中培养14 d,4株细胞系均没有出现任何菌落。
2.4.3.2 DNA荧光染色法 待检细胞用荧光染料(Hoechst33258)染色后,只有细胞核出现蓝色荧光,细胞核与细胞表面之间看不到荧光(图6)。

2.5 MDCK细胞核型分析结果
分别对4株MDCK细胞系的50个铺展完好的中期相的染色体数目进行统计,结果显示,4株MDCK细胞系的染色体均为2n=78,染色体中期分裂相如图7~10。
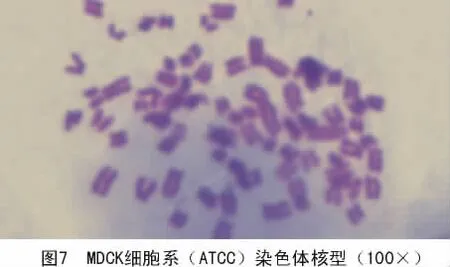

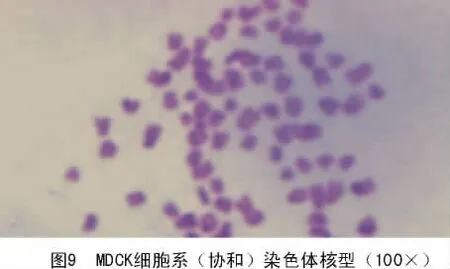

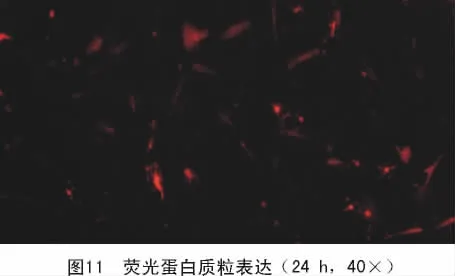
2.6 荧光蛋白质粒转染表达
4株MDCK细胞系经脂质体介导红色荧光蛋白质粒(pDsRed-Monomer-N1)转染后,12 h均可见发红色荧光的细胞,分布均匀,但强度较弱。转染24 h后阳性细胞明显增多,强度增强(图11),表明4株MDCK细胞系均能有效地转染外源基因。
3 讨论
最初的MDCK细胞系在1958年由Madin等[12]从美国的1头Cocker Spaniel母曲架犬的肾脏组织分离培育而建立,该细胞系在方瓶中培养时会集合成紧密连接蛋白并分泌到表面球状顶部,形成单细胞层。
传统的流感疫苗都是采用鸡胚生产的,此种方法受到很多因素的限制,如可靠鸡胚的来源、较长的培养周期、繁琐的操作步骤以及很容易受污染等[13-14]。MDCK由于其具有培养容易、增殖快、流感病毒感染效率高等特点,被作为流感病毒疫苗生产的重要细胞系之一。
本研究从ATCC,CCTCC,北京协和细胞资源中心及某企业分别引进4株MDCK细胞系,传代扩增后建立相应的细胞库,其中,种子细胞库各30支,工作细胞库40支。复苏细胞培养到第3天进入指数生长期,第5天进入平稳生长期,倍增时间在23.48~24.73 h之间,最大增殖密度在6.29×105~6.86×105个/mL,表明此4株细胞系均生长比较快,且细胞体积较小。外源质粒(pDsRed-Monomer-N1)均能在4株MDCK细胞系内进行有效复制、转录、翻译和翻译后修饰,能用于瞬时转染及永久表达系的建立,这为以后对MDCK的结构基因组、功能基因组以及转基因研究等工作提供了依据。通过本项研究已成功建立MDCK细胞库,为流感细胞基质疫苗的研究及开发提供了基础理论依据和细胞资源。
[1]黄锭,赵亮,谭文松.犬肾细胞MDCK无血清贴壁及单细胞悬浮培养 [J].生物工程学报,2011,27(4):645-652.
[2]R.van Wielink,Kant-Eenbergen H C M,Harmsen MM.Adaptation of a Madin-Darby canine kidney cell line to suspension growth in serum-free media and comparison of its ability to produce avian influenza virus to Vero and BHK21 cell lines[J].Journal ofVirological Methods,2011,171:53-60.
[3]Halperin S A,Smith B,Mabrouk T,et al.Safety and immunogenicity of a trivalent,inactivated,mammalian cell culture-derived influenza vaccine in healthy adults,seniors,and children[J].Vaccine,2002,20:1240-1247.
[4]David Onions,William Egan,Ruth Jarrett.Validation of the safety of MDCK cells as a substrate for the production of a cell-derived influenza vaccine[J].Biologicals,2010,38:544-551.
[5]Ralf D Hess,Friedemann Weber,Keith Watsond.Regulatory,biosafety and safety challenges for novel cells as substrates for human vaccines[J].Vaccine,2012,30:2715-2727.
[6]程宝鸾.动物细胞培养技术 [M].广州:中山大学出版社,2006:28-29.
[7]令世鑫,关伟军,冯玉萍,等.河曲马睾丸组织成纤维细胞系的建立及生物学特性研究 [J].西北农业学报,2012,21(7):10-14.
[8]严泉剑,郭金龙,刘恩靖,等.绘制细胞生长曲线及细胞群体倍增时间的简化计算 [J].前卫医药杂志,2000,17(4):228-229.
[9]国家药典委员会.中华人民共和国药典:2010年版 [M].北京:中国医药科技出版社,2010.
[10]冯若飞,马忠仁,关伟军,等.天祝白牦牛肾组织成纤维细胞系的建立与生物学特性研究[J].畜牧兽医学报,2008,39(6):726-732.
[11]良宋平.生物化学与分子生物学实验教程[M].北京:高等教育出版社,2003:35-41.
[12]Madin S H,Darby J N B.Established kidney cell lines of normal adult bovine and ovine origin[J].Proceedings of the Society for Experimental Biologyand Medicine,1958,98(3):574-576.
[13]王家敏,乔自林,令世鑫,等.禽流感疫苗研究进展[J].山西农业科学,2012,40(2):181-185.
[14]Stohr K,Esveld.Will vaccines be available for the next influenza pandemic[J].Science,2004,306:2195-2196.

