丙烯醛/氨反应制备3-甲基吡啶的研究进展
张 弦,晁自胜,黄登高,罗才武,刘 伟,王开明,潘金钢
(1湖南大学化学化工学院化学生物传感与计量学国家重点实验室,湖南 长沙 410012;2青岛科技大学化学与分子工程学院,山东 青岛 266042;3北京华地博源生化科技有限公司,北京 100120)
进展与述评
丙烯醛/氨反应制备3-甲基吡啶的研究进展
张 弦1,晁自胜1,黄登高1,罗才武1,刘 伟1,王开明2,潘金钢3
(1湖南大学化学化工学院化学生物传感与计量学国家重点实验室,湖南 长沙 410012;2青岛科技大学化学与分子工程学院,山东 青岛 266042;3北京华地博源生化科技有限公司,北京 100120)
综述了丙烯醛/氨反应制备3-甲基吡啶的方法,主要包括液相釜式反应法、气相固定床反应法和气相流化床反应法3种。介绍了这些方法的工艺特点,评述了其优缺点及所涉及的催化剂。对丙烯醛/氨反应制备3-甲基吡啶过程所需要着重解决的问题进行了归纳总结。并简介了3-甲基吡啶的合成机理。同时,对于丙烯醛/氨反应制备 3-甲基吡啶技术的发展前景也进行了展望,认为介孔材料和固体酸催化剂应用于该反应及合成机理的深入研究是未来的发展方向之一。
3-甲基吡啶;丙烯醛;液相法;气相法
3-甲基吡啶是制备B族维生素、烟酸和烟酰胺的主要原料,还可以用来合成新型农药、香料及医药中间体[1-3]。目前在我国主要由少数几家外资或合资企业采用垄断技术进行生产,其3-甲基吡啶产品主要用于内部下游生产和出口,无法提供给国内其它企业,而我国每年需要大量进口3-甲基吡啶。随着3-甲基吡啶应用途径的不断拓展,产品缺口将不断加大。另外,目前工业上主要采用甲醛/乙醛法[4]来生产3-甲基吡啶,此方法的产物中 4-甲基吡啶的含量较高(3-甲基吡啶/4-甲基吡啶为0.9~2.8)。由于3-甲基吡啶与4-甲基吡啶的物理化学性质极为接近(沸点相差0.5 ℃),采用常规方法难以将二者分离,从而导致分离成本增加、产品纯度低[5]。而采用丙烯醛为原料制备 3-甲基吡啶时产物不含4-甲基吡啶,可以满足各种使用要求,大大降低了分离费用。此外,目前在工业上丙烯醛是通过丙烯部分氧化进行大规模生产的[6],并且通过丙烷选择性氧化[7]及甘油选择性脱水[8-9]合成丙烯醛的技术也正在不断完善。原料丙烯醛来源广泛而稳定,且价格较低,因而深入了解丙烯醛制备3-甲基吡啶的工艺及技术具有重要工业及市场价值。同时,相关研究也能给其它杂环化合物的制备带来借鉴作用。
1 3-甲基吡啶的合成概况
3-甲基吡啶合成方法很多。最早是由煤焦油和焦炉气中分离而得来的,由于产物复杂,产量有限,无法满足生产要求[10]。Akhmerov等[11]采用乙烯/甲醇/氨(摩尔比)=1/1/1、在420 ℃反应得到14.5%的3-甲基吡啶。由于乙烯转化率不高,产物收率低,难以工业化应用。二甲基戊二腈(或胺)[12-14]是直接合成3-甲基吡啶的另一途径。Lanini等[14]考察了2-甲基戊二腈制备3-甲基吡啶的催化剂、选择性以及操作条件对反应的影响。通过六碳有机物的脱氢(或加氢)、成环可以得到 70%左右的3-甲基吡啶收率,主要缺点在于原料难以得到,催化剂需要用到贵金属,价格昂贵。此外,Sreekumar等[15]利用吡啶和甲醇制备3-甲基吡啶,选择性达到 95%以上,主要存在转化率不高、原料成本较高的问题。
工业上3-甲基吡啶是在乙醛和氨合成2-甲基吡啶和4-甲基吡啶工艺的基础上加入甲醛合成的。采用HZSM-5(90)为催化剂,乙醛/甲醛/氨=1/1/4(摩尔比)为原料,在375 ℃进行反应,吡啶收率57%,3-甲基吡啶收率为 27.0%[16]。改变原料的组成,可调节产物的组成比例,因而可以根据市场需求随时调整产物。该工艺反应温度高,存在碳损失导致大量吡啶生成,同时会减少催化剂寿命,需采用流化床来实现连续生产。另外,3-甲基吡啶中会存在较多的4-甲基吡啶,在分离过程中会损失部分3-甲基吡啶,限制了3-甲基吡啶的生产。由于吡啶碱工业的发展,工业上对3-甲基吡啶质量要求越来越高,解决甲醛/乙醛法产物含4-甲基吡啶而难以分离的问题在目前显得极为迫切。
文献报道丙烯醛是甲醛/乙醛法制备3-甲基吡啶的中间体[17],同时,甲醛和乙醛经过缩合可直接用来制备丙烯醛[18]。因而可以直接用丙烯醛来合成3-甲基吡啶,避免部分乙醛和氨反应直接缩合形成2-甲基吡啶和4-甲基吡啶[19],也就不需再分离3-甲基吡啶和4-甲基吡啶。该法可以用来合成高质量3-甲基吡啶,且原料价廉易得。
2 丙烯醛制备3-甲基吡啶方法
目前采用丙烯醛为原料制备3-甲基吡啶主要有液相釜式法、气相固定床法和气相流化床法。
2.1 液相釜式法
欧洲专利1240928[20]报道采用丙烯醛和乙酸铵为原料,在酸性条件下形成3-甲基吡啶。在250 m L丙酸溶剂中加入0.38 mol乙酸铵后,缓慢滴加0.1 mol丙烯醛,130 ℃反应得到0.0165 mol的3-甲基吡啶,其收率达到 33%。采用加入乙醛或三聚乙醛为原料和加入乙酸铜为催化剂的方法收率也无法提高。该法反应简单、操作容易、反应温度低、吡啶碱产物单一。但是,总吡啶碱收率不高,由于丙酸和3-甲基吡啶沸点相近,使得分离量大、分离困难。
美国专利4421921[21]报道,将2.05 mol丙烯醛原料加入到1.14 L含3.4 mol磷酸氢二铵的水溶液中,在230 ℃、3.2~3.3 MPa压力和搅拌条件下,保温反应10 m in。通过二氯甲烷3次萃取提取吡啶碱,得到61.9%的吡啶碱,其中3-甲基吡啶52.4%。采用部分丙烯醛用甲醛和三聚乙醛取代,加入丙烯醛1.12 mol,丙烯醛/三聚乙醛/甲醛(摩尔比)=1/1.5/1。反应得到89.8%收率的吡啶碱,其中3-甲基吡啶收率56.7%。此方法所得总吡啶碱收率高,原料利用率高,主要产物为3-甲基吡啶和3-乙基吡啶,但是反应压力高、产物复杂、反应操作和分离提纯困难。
本文作者课题组在欧洲专利1240928[20]方法的基础上采用乙酸为溶剂,乙酸铵为氨源,以固体超强酸为催化剂在125 ℃左右反应可以得到60%左右的3-甲基吡啶,但是乙酸分离量大,难以工业化。以己酸为溶剂和磷酸铵为氨源、固体超强酸为催化剂、质量分数为8%左右的丙烯醛为原料,采用釜式反应器在170 ℃反应得到55%左右的3-甲基吡啶[22],有效提高了3-甲基吡啶反应收率,且分离简单,不存在乙酰胺副产物,为液相法工业化提供了重要依据,但是需要解决生产能力小的问题。
总之,采用液相釜式法制备3-甲基吡啶具有反应温度低,操作简单和产物不含4-甲基吡啶的优点。但是也存在着分离量大和生产能力小等问题。选择合适的溶剂和氨源,并提高3-甲基吡啶的选择性是液相法制备3-甲基吡啶的关键。
2.2 气相固定床法
以气相固定床反应制备3-甲基吡啶主要有两种方式:第一种是直接以纯丙烯醛为原料反应制备3-甲基吡啶;另一种是采用丙烯醛和其它有机物为原料和氨反应制备3-甲基吡啶。
2.2.1 纯丙烯醛制备3-甲基吡啶
欧洲专利 1222971[23]和 1208291[24]报道采用丙烯醛、氨气、空气和氮气的混合气体,丙烯醛体积分数一般维持在2%~5%,氨为7%~20%,在反应温度为400 ℃左右、接触时间2~5 s的条件下,分别采用HF或(和)Zr改性SiO2-A l2O3和硼酸改性SiO2为催化剂,总吡啶碱的收率最高可达68%左右。由于氧的存在,主要产物为吡啶,3-甲基吡啶收率只有25%左右。氧会导致部分丙烯醛氧化而损失,同时吡啶碱收率降低。由于氧化剂和水的存在,能及时将催化剂上积炭氧化,保持催化剂较长时间的活性,因而,反应可以维持较长时间。
日本专利 5626546[25]、欧洲专利 1422601[26]以及美国专利3898177[27]、3917542[28]、3960766[29]报道以丙烯醛和氨气反应,采用 SiO2-A l2O3和MFx/Al2O3等,在380~450 ℃条件下反应可以得到70%左右的吡啶碱收率,其中3-甲基吡啶收率可高达45%左右。反应采用高比表面积的Al2O3为催化剂,通过氧化硅、HF或者B、P、Mg、Ca等改性,可以进一步提高催化剂性能,提高吡啶碱收率。且反应必须注意让丙烯醛和氨分别预热至 200 ℃以上,并在反应床内混合,否则,在没有催化剂而有氨的条件下丙烯醛可聚合,堵塞进料管道,导致反应无法进行。美国专利3898177[27]报道,采用1 L Mg和F改性的A l2O3为催化剂,5.04 mol丙烯醛和13.8 mol氮气预热至220 ℃后与10 mol预热至220 ℃的氨气在反应管内混合反应。用水洗反应气体,并用苯(或二氯甲烷[28])萃取产物,得到总吡啶碱收率为71%,其中吡啶为26.6%,3-甲基吡啶为44%。反应24 h后催化剂活性下降,通入空气1 h于500℃再生,催化剂活性恢复。由于催化剂积炭严重、寿命短,因而反应一段时间后,需要将催化剂再生。否则,催化剂失活后,丙烯醛转化率和3-甲基吡啶选择性降低,未反应丙烯醛在氨和水作用下聚合堵塞管道。为了保证丙烯醛转化率,需丙烯醛过量,因此氨醛比一般为1~3,氨不宜太过量,否则容易导致丙烯醛聚合,降低3-甲基吡啶选择性。丙烯醛的空速一般为0.8~2.5 s。空速过快,会降低丙烯醛转化率,而未反应丙烯醛又会聚合导致管道堵塞;空速过慢,容易使丙烯醛过度脱羰,催化剂积炭严重。为了减少丙烯醛的聚合,一般通入惰性气体(或溶剂)如氮气、水蒸气或苯等稀释,然后与丙烯醛混合一起预热,之后再与预热后的氨在催化床层接触反应。
高温气相反应容易导致丙烯醛脱羰积炭,因此固定床反应催化剂需要寿命长、再生性能好。欧洲专利1422601[26]使用直径2 mm、长度4~6mm、比表面积300 m2/g的氧化铝为载体,采用浸渍法加入Mg、Zr和Ba盐等及氟化物为活性组分,干燥后于700 ℃空气氛中焙烧 4 h。催化剂原子比A l/Mg/Ti/F=1000/25/25/100,丙烯醛/氨/氮(摩尔比)=10/19.5/20.4,可以得到313 g/ h每升催化剂的产率,总吡啶碱收率为 71%,其中 3-甲基吡啶为46.4%,吡啶为24.6%。美国专利3917542[28]和美国专利3960766[29]同样报道采用F改性氧化铝为催化剂,并加入B、P、Mg、Zr和Ti等作为辅助成分改性,同样得到70%左右的吡啶碱,3-甲基吡啶收率在 30%~40%。文献[30]报道采用二氧化钛为催化剂,证实丙烯醛和氨反应合成3-甲基吡啶反应过程3-甲基吡啶选择性的提高主要是由于催化剂 Lew is酸中心催化引起的。
该法由于积炭严重,导致吡啶收率较高,从而降低3-甲基吡啶收率,且催化剂反应一段时间需要再生,导致操作复杂,从而要求催化剂寿命长、再生性能好。
2.2.2 丙烯醛和其它有机物制备3-甲基吡啶
为了解决采用纯烯醛为原料时存在催化剂失活快的问题,特别是裂解反应导致吡啶生成、3-甲基吡啶减少的问题,考虑添加其它有机物为原料,减少丙烯醛损失,减缓催化剂失活,提高3-甲基吡啶收率。所加有机物主要是醛、酮、醇和环氧丙烷。
欧洲专利963887[31]、887688[32]采用丙烯醛和饱和醛与氨气 350~450 ℃反应制备吡啶碱。当采用丙烯醛和乙醛[31]时,得到产物吡啶碱收率最高可达65%左右,其中3-甲基吡啶只有26.5%,吡啶为28%,产物2-甲基吡啶和4-甲基吡啶分别为8.5%,对产物分离带来较大困难,也影响到了产品质量,同时催化剂寿命不能得到较大的提高。提高丙烯醛和乙醛的比例,可以适当提高产物3-甲基吡啶和吡啶的比例,但比例过大,会导致总吡啶碱收率降低。向混合气体中加入氧气和水蒸气,能够提高催化剂寿命、减少结焦,但是导致3-甲基吡啶减少,吡啶增多,并降低总的吡啶碱收率。而采用丙烯醛和丙醛[32]反应,丙醛/丙烯醛(摩尔比)=(1/1)~(1.2/1),氨/醛(摩尔比)=(0.5/1)~(5/1),反应温度为375~475 ℃,采用 SiO2-Al2O3为催化剂得到 50%左右的 3-甲基吡啶转化率(基于总醛),产物吡啶碱不含4-甲基吡啶。3-甲基吡啶收率明显提高,可见,丙醛可以参与3-甲基吡啶的形成。可能源于丙醛脱氢与丙烯醛反应得到的反应中间体,在有氨条件下形成3-甲基吡啶。
欧洲专利 896049[33]报道采用丙烯醛/丙醇(摩尔比)=14.8/1,氨/碳(摩尔比)=1.1/1为碳源,原料经气化后在400 ℃反应,3-甲基吡啶选择性只有31.4%(基于丙烯醛或丙醇),明显低于丙烯醛和丙醛反应所得。可见丙醇反应活性不如丙醛,考虑丙醇参与合成3-甲基吡啶的反应过程需要脱去两分子氢,反应更困难,可能需要加强催化剂氧化性能或通入一定量氧参与反应。另外,将原来丙烯醛和丙醇一起蒸发时,二者容易发生缩合形成缩醛,导致3-甲基吡啶收率降低,应将二者分别预热后在反应器内再混合反应为宜。欧洲专利920526[34]采用丙烯醛和酮为原料,在400 ℃反应,得到最高18%左右的 3-甲基吡啶转化率(基于丙烯醛),产物随所添加酮的不同而有较大的变化。当加入丙酮和丙烯醛与氨反应时,产物主要为2-甲基吡啶和3-甲基吡啶,其中3-甲基吡啶转化率只有25%(基于丙烯醛),大大降低了3-甲基吡啶收率,且另外生成了2-甲基吡啶和3-甲基吡啶,使产物复杂,增加分离成本。欧洲专利1192255[35]采用丙烯醛/环氧丙烷/氨气(摩尔比)=5/1/9,接触时间为3 s,反应温度400~450 ℃,得到48.6%的3-甲基吡啶和12.6%的吡啶收率。国内山东化学研究所[36-37]采用氟改性的 A l2O3催化剂,以丙烯醛和环氧丙烷反应得到14%的吡啶和57%的3-甲基吡啶收率,总吡啶碱收率进一步提高,达到72%左右;并提出HO-A lF1~4为该催化剂的活性中心,且催化活性一定范围内随表面酸度增加而增加,但是反应时间不长,经过一段时间后,催化剂活性下降,容易出现聚合物堵塞反应管道。
在固定床中进行反应,丙烯醛和氨在接触催化剂之前应该分别预热到 200~240 ℃左右,而且最好直接在反应管内混合[28]。丙烯醛可以用氮气或苯蒸气稀释,产物3-甲基吡啶也要用溶剂萃取回收。由于反应催化剂容易积炭,寿命较短,因此应及时检测反应收率变化情形,及时将催化剂再生,否则,催化剂失活后未反应丙烯醛容易聚合,堵塞反应管道。同时,为了延长催化剂寿命,必要时需要稍微改性降低催化剂活性,以减少催化剂再生次数,因此,选用氧化铝比表面积一般在200~350 m2/g。反应产物也应用水或其它溶剂吸收,并用苯或二氯甲烷等有机溶剂萃取分离,并及时蒸发分离。在所添加有机物中,加入醇、酮反应所得3-甲基吡啶收率不是很高。环氧丙烷和丙醛效果最好,产物主要为3-甲基吡啶,且收率可以达到60%左右。环氧丙烷和丙醛形成3-甲基吡啶的过程中,可以通过高温脱氢,直接参与形成3-甲基吡啶,提高3-甲基吡啶收率。且脱氢在一定程度上还可以还原催化剂,减少脱碳反应的进行,减缓积炭程度,延长催化剂寿命。
2.3 气相流化床法
采用流化床可以使失活的催化剂迅速离开反应区,避免因催化剂失活带来的丙烯醛转化率降低,丙烯醛和氨气聚合堵塞反应器出口的问题。同时,为了适当减少丙烯醛自聚,考虑加入适量醛或酮,特别是丙醛,在提高3-甲基吡啶收率,避免4-甲基吡啶生成的同时,其它吡啶也很少,具有产物单一、分离成本低等优点。
欧洲专利 1020857[38]报道采用丙烯醛/水蒸气/氨气(摩尔比)=1/1/5,反应温度350 ℃,使用B、P改性的比表面积为600 m2/g的SiO2-A l2O3为催化剂,接触时间5 s。在流化床上吡啶选择性为25%,3-甲基吡啶为35%。经过17 h反应后催化剂积炭达到18%,催化剂活性下降。美国专利4171445[39]报道,在反应器-再生器双塔装置上由丙烯醛和氨气合成吡啶碱,可以得到24.2%吡啶和48.5%的3-甲基吡啶。丙烯醛气化后与氮气混合在反应器底部作为一路进料,氨气和氮气在催化剂下,反应器下部侧线作为一路进料。尾气经过催化剂床后,用水洗回收吡啶碱产物,未反应的氮气和氨气循环作原料使用。在反应器内设计有一定的自由空间,供催化剂移动至再生器,在再生器内经过空气氧化再生后回到反应器内,因此,可以保持催化剂的高活性,提高3-甲基吡啶收率,并保证反应连续运行。
欧洲专利 1069368[40]报道采用体积分数为5.1%的丙烯醛、5%的乙醛、34.8%的氮气、8.7%的氧和18.4%的水蒸气为原料,用Pb和F改性的SiO2-A l2O3为催化剂,在温度400 ℃、接触时间为5.5 s条件下使用流化床反应器反应7 h,得到吡啶收率为 46%、3-甲基吡啶和 4-甲基吡啶混合物为 4%左右、2-甲基吡啶为 1%。可见由于氧的存在导致主要产物为吡啶,且由于乙醛含量较高,导致 2-甲基吡啶和 4-甲基吡啶出现。加拿大专利1063121[41]采用丙烯醛和丙酮,反应温度为400~450 ℃,催化剂为高比表面的硅酸铝,在流化床上得到 30%左右的 3-甲基吡啶和 25%左右的 2-甲基吡啶。美国专利4147874[42]、4163854[43]报道采用丙烯醛分别和乙醛、丙醛作为原料反应,以高比表面积SiO2-A l2O3为催化剂,在 400~460 ℃之间反应。采用丙烯醛/乙醛=2/1的原料,得到46%左右的3-甲基吡啶收率和 27%左右的吡啶收率。采用丙烯醛/丙醛=2/1的原料时,得到 60.6%的 3-甲基吡啶和6.2%的吡啶收率。改变丙烯醛/丙醛摩尔比在3/2~4/1之间,吡啶和3-甲基吡啶收率变化不大,吡啶收率维持在 6%~10%,3-甲基吡啶收率维持在60%左右。可见采用丙烯醛和丙醛为原料,3-甲基吡啶收率较高,可达60%,总吡啶碱收率接近 70%,且产物不含 4-甲基吡啶,达到较好的反应结果。
综上所述,丙烯醛和氨反应可以制备高纯度3-甲基吡啶,总结各种合成方法,其优缺点如表 1所示。采用流化床可以使反应连续进行,且3-甲基吡啶收率可达60%,总的吡啶碱可以达70%左右。主要存在投资成本高、风险大、操作复杂等问题。
3 关键技术及存在问题
3.1 丙烯醛的聚合
丙烯醛的化学性质极为活泼,在光、热、酸和碱的作用下都可以发生聚合反应。通常将对苯二酚加入丙烯醛作为阻聚剂,并用乙酸调节pH=5~6,配制乙酸/对苯二酚/无水碳酸钠=84/8/8(质量比)的缓冲溶液抑制丙烯醛自聚[44]。
文献[45]报道在光引发作用下气态丙烯醛可以聚合形成固体颗粒。Ohgomori等[46]报道丙烯醛通过尾-尾聚合形成2-烯基己二醛。同时由于丙烯醛的两个不饱和键共轭,两键可以围绕 C—C键旋转,因而存在顺式和反式两种结构,使得丙烯醛的聚合更加复杂化。Toma等[47]报道丙烯醛通过Diels-A lder反应二聚形成两种不同结构的二聚丙烯醛。
丙烯醛由于同时含有C=C键和C=O键,不仅存在自聚,还可以和其它不饱和物质发生缩聚或共聚。文献[48]报道了丙烯醛、苯乙烯和二乙烯苯的共聚。Yamashita等[49-50]报道了丙烯醛在不同溶剂条件下的聚合,并认为丙烯醛主要通过阴离子引发聚合。

表1 丙烯醛制备3-甲基吡啶方法比较
丙烯醛容易自聚,在加热状态下,不需催化剂就可以生成二聚丙烯醛,因此需加入阻聚剂和 pH值缓冲剂,可采用在反应之前预热或通入氮气稀释丙烯醛以减少自聚。而氨气高温下活性增强,极易引发丙烯醛的聚合,因此,不能让丙烯醛和氨气混合后再加热,只能分别预热后在催化剂床上直接接触反应,且预热温度不得低于200 ℃[51]。但是即便如此,只是减少了聚合反应时间,减少聚合程度,无法完全避免高聚物产生。在反应物料中加入添加剂也能起到一定的阻聚作用,如水蒸气、醛、酮等[34-37]。由于丙烯醛聚合能力较强,因此反应过程必须保证转化率达 100%,否则,未反应的丙烯醛在氨水的作用下聚合成酯,堵塞反应管道。为了防止丙烯醛自聚,在反应之前加入大量的稀释气或添加剂,又会阻碍丙烯醛的反应转化率。目前的主要办法是加入吸收剂和萃取剂处理反应产物。美国专利 3898177[27]采用水吸收反应产物,并加入苯萃取蒸馏反应产物,得到71%左右的吡啶碱收率。美国专利 3917542[28]报道采用水洗和二氯甲烷萃取蒸馏的办法同样得到70%左右的吡啶碱收率。美国专利4237299[52]报道采用两个清洗塔-热交换装置来回收以丙烯醛和乙醛为原料反应得到吡啶碱产物。第一个填充柱清洗塔装置将产物清洗并降温至 40~80 ℃,第二个塔装置将余下产物进一步降温至 10~40 ℃。降温后液体产物经苯萃取后,精馏得到吡啶和3-甲基吡啶,回收率分别达到98.4%和99.5%。该装置回收效果明显,避免了反应管道的堵塞问题。
总之,通过预热、隔离、稀释和吸收的办法,可以大大降低丙烯醛的聚合,关键在于维持丙烯醛的高转化率。同时采取高效的吸收装置处理反应产物,避免堵塞现象。
3.2 丙烯醛的裂解
在高温下,该反应容易脱碳形成吡啶产物,其中吡啶/3-甲基吡啶达到1/2左右,造成催化剂寿命的降低和丙烯醛损失加大。目前报道的主要方法有通入水蒸气[23]、通氧[24]、采用高效催化剂[27-29]和流化床反应器[39]等办法。通氧和水蒸气可以有效地使沉积炭减少、延长催化剂使用寿命。但通氧会使部分原料氧化,使产物总吡啶碱收率降低,吡啶增加的同时而3-甲基吡啶大大减少。水蒸气的加入可以使吡啶和3-甲基吡啶收率同时提高,且总吡啶碱收率达到62%左右,但水的加入降低了反应平衡同时使分离成本增加。添加其它有机物可以有效提高总收率,其中以丙醛[43]、丙酮[34,41]和环氧丙烷[35-37]效果较佳,在不产生4-甲基吡啶的基础上提高了3-甲基吡啶收率,同时产生高沸点的其它烷基吡啶碱,但并不能避免催化剂寿命的降低。通过提高催化剂载体比表面积[27-29]、酸处理[21]和载体强度[27]等办法都可以延长催化剂的使用寿命,提高总收率。但总的催化剂寿命有限,必须通过不断再生使催化剂重复使用才可实现工业化目的。流化床反应器装配有两段反应器[39],其中一个反应器反应,另一反应器再生,催化剂在两个反应器内不断循环往复使用,解决了催化剂积炭严重、寿命较短的问题。但需要催化剂强度高、重复性好,同时反应装置和操作费用会增加。
通过加入有机物的方法可以在丙烯醛裂解的基础上大幅提高3-甲基吡啶收率,但催化剂寿命问题主要通过再生的办法来解决。因此合适的反应类型应是低温液相反应或流化床反应,流化床反应则需要强度更高、再生性能更好的催化剂。
3.3 催化剂
丙烯醛和氨反应制备3-甲基吡啶从反应平衡来讲,不涉及氧化及还原,因而,不宜用氧化性或还原性催化剂。主要的反应类型有加成、缩合、脱水(氨)、成环和氢转移等,因而酸性或碱性催化剂较为适宜。
液相反应[20]中酸性溶剂就起到一定的催化作用,然而酸性又不宜太强,否则,引起丙烯醛聚合,无法得到3-甲基吡啶;且酸性太强,难以释放氨,导致反应无法进行,同时酸会腐蚀设备、污染环境等。因而液相反应采用有机酸为溶剂或采用缓冲溶液,调节并稳定 pH值,使反应体系为弱酸性。开发新型固体酸催化剂取代液体酸或盐催化剂,既能避免腐蚀问题,又能提高反应收率,具有重要意义。
气相反应主要使用的催化剂有 SiO2[24]、TiO2[30]、A l2O3[26-29,36-37]、Al2O3-SiO2[22-23,53]和分子筛[54]等,这类催化剂的主要特征是催化剂具有一定的酸碱性,且比表面积高(300~800 m2/g),有利于缩合、脱水反应的进行。为了进一步提高3-甲基吡啶的选择性,可以加入Mg、Ca、Ba等增强催化剂活性[28-29]。另外,通过含F、B、P元素的化合物处理催化剂可以进一步调节并改善催化剂的酸碱性质[23-24,36-37]。在流化床反应中,为了提高催化剂的耐磨性和稳定性,可以适当加入一定量的Zr或Ti组分[26-27]。Zenkovets等[30]认为Lew is酸中心为主要的催化剂活性中心。
丙烯醛合成3-甲基吡啶对催化剂的要求根据反应工艺的不同会有所不同,根据工艺选择合适的催化剂至关重要。同时,随着新的固体酸碱催化剂的不断涌现以及新的催化剂改进技术的应用,特别是介孔材料催化剂有望在此反应中发挥重要作用。同时,催化剂相关催化机理还需进一步深入探索。
4 丙烯醛合成3-甲基吡啶机理
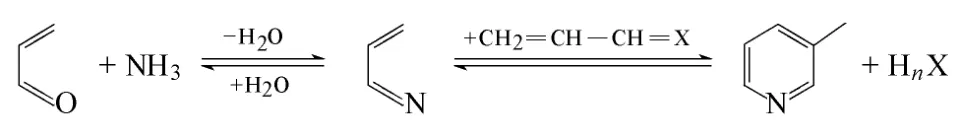
图1 丙烯醛制备3-甲基吡啶形成机理
目前,尚无丙烯醛/氨反应制备3-甲基吡啶的机理报道,不过在甲醛/乙醛法合成 3-甲基吡啶过程中,丙烯醛被认为是反应中间体。根据醛/氨反应合成吡啶碱相关机理报道[55],丙烯醛和氨的反应一般认为是先形成丙烯亚胺(CH2=CH—CH=NH)中间体,然后,一分子丙烯亚胺与一分子丙烯醛或者丙烯亚胺缩聚形成3-甲基吡啶,如图1所示。
然而,丙烯醛在低温和高温下反应均可形成3-甲基吡啶,不同温度下反应机理是否相同还有待进一步研究。由丙烯亚胺形成3-甲基吡啶不涉及脱氢反应,只存在脱水缩合的过程,但会涉及加成、脱水(脱氨)、氢转移和成环等步骤,各步骤之间如何协调转化,且丙烯醛法和甲醛/乙醛法在合成3-甲基吡啶机理过程是否一致还需详细论证。
5 结 语
丙烯醛法制备3-甲基吡啶是一种合成高质量3-甲基吡啶的有效方法,该反应原料来源稳定,产品质量较高。目前主要存在的问题是原料容易聚合、催化剂寿命短、价格较甲醛/乙醛法高等。随着丙烯醛来源的不断拓展,其价格有望降低,该法将更具竞争力。但是目前,此法的相关专利技术掌握在国外公司手中,随着我国对3-甲基吡啶需求的加大,加快该技术领域的研究,形成自己的独立知识产权具有重要战略意义。
致谢 感谢北京华地博源生化科技有限公司和中国海洋科技大学李国强教授对本课题的支持!
[1] 吕金魁,魏荣宝,梁娅,等. 新型烟用香料3-乙基吡啶的合成[J].天津理工学院学报,1995,11(2):71-75.
[2] Martin A,Janke C,Kalevaru V N. Ammoxidation of 3-picoline to nicotinonitrile over VPO catalysts[J].Applied Catalysis A:General, 2010,376(1–2):13-18.
[3] 温占兴,霍竹林,焦素霞. 3-甲基吡啶法生产2-氯-5-三氟甲基吡啶[J]. 河北化工,2000(1):10-13.
[4] Jin Fang,Cui Yugang,Rui Zebao,et al. Effect of sequential desilication and dealum ination on catalytic performance of ZSM-5 catalyst for pyridine and 3-picoline synthesis[J].Journal of Materials Research,2010,25(2):271-282.
[5] 赵欢,肖国民. 3-甲基吡啶和4-甲基吡啶的分离技术进展[J]. 化工科技,2004,12(4):52-56.
[6] 王乐夫,耿建铭,徐建昌,等. 丙烯选择性氧化制丙烯醛得催化剂研究[J]. 高校化学工程学报,1999,13(4):377-381.
[7] 王鉴,李安莲,邴国强,等. MoVTeNbO催化剂用于丙烷选择氧化与氨氧化研究进展[J]. 化工进展,2010,29(12):2298-2303.
[8] Hanan Atia,Udo Armbrusterb,Andreas Martin. Dehydration of glycerol in gas phase using heteropolyacid catalysts as active compounds[J].Journal of Catalysis,2008,258:71-82.
[9] 张跃,丁海亮,刘建武,等. H3PW12O40/Al2O3催化剂在甘油脱水制备丙烯醛反应中的性能评价[J]. 化工进展,2010,29(2):261-265.
[10] 常景泉. 鲁奇气化煤焦油中重吡啶碱类的提取与精制[J]. 煤化工,2004,32(6):39-41.
[11] Akhmerov K M,Yusupov D,Abdurakhmanov A,et al. Catalytic synthesis of pyridine and methylpyridine from acetylene and ammonia[J].Khimiya Geterotsiklicheskikh Soedinenii,1975(2):221-224.
[12] Lanini S,Prins R. Synthesis of 3-picoline from 2-methylglutaronitrile over supported noble metal catalysts I. Catalyst activity and selectivity[J].Applied Catalysis A:General,1996,137:287-306.
[13] Prins R. Synthesis of picolines and other aza-aromatics from arylam ines by isomerization-rearrangement and from dinitriles by hydrogenation-cyclization reactions[J].Catalysis Today,1997,37:103-120.
[14] Lanini S,Prins R. Synthesis of 3-picoline from 2-methylglutaronitrile over supported noble metal catalysts II. Influence of operation parameters[J].Applied Catalysis A:General,1996,137:307-326.
[15] Sreekumar K,Mathew Thomas,Devassy Biju M,et al. Vapor-phase methylation of pyridine w ith methanol to 3-picoline over Zn1-xCoxFe2O4(x=0,0.2,0.5,0.8 and 1.0)-type ternary spinels preparedviaa low temperature method[J].Applied Catalysis A:General,2001,205:11-18.
[16] Kuppi Reddy Suresh Kumar Reddy,Inkollu Sreedhar,Kondapuram Vijaya Raghavan. Interrelationship of process parameters in vapor phase pyridine synthesis[J].Applied Catalysis A:General,2008,339(1):15-20.
[17] Sato Hiroshi,Shimizu Shinkichi,Abe Nobuyuki,et al. Synthesis of pyridine bases over ion-exchange pentasil zeolite[J].Chemisty Letters,1994,23(1):59-62.
[18] Dum itriu E,Bilba N,Lupascu M,et al. Vapor-phase condensation of formaldehyde and acetaldehyde into acrolein over zeolites[J].Journal of Catalysis,1994,147(1):133-139.
[19] 杨风玉,史玉龙,丁春年,等. 2-甲基吡啶和4-甲基吡啶合成工艺研究[J]. 化工时刊,2004,18(11):41-43.
[20] Asrian Nicolson. Manufacture of pyridine bases:GB,1240928[P]. 1971-07-28.
[21] James I Grayson,Rolf Dinkel. Process for the production of 3-picoline:US,4421921[P]. 1983-12-20.
[22] 张弦,晁自胜,李国强,等. 一种利用丙烯醛制备 3-甲基吡啶的新方法:中国,102249989[P]. 2011-11-23.
[23] Graham Sw ift,Ian Stuart M ccoll. Catalytic process for the manufacture of pyridine or methylpyridines:GB,1222971[P]. 1971-02-17.
[24] Palph Hubert Benson,Peter Arthur Edward Whincup. Catalytic process for the manufacture of pyridine and methylpyridines:GB,1208291[P]. 1970-10-14.
[25] Kiyoshi Yasuda,Kazuyuki Matsuoka. Catalyst for manufacturing pyridine bases:JP,5626546[P]. 1981-03-14.
[26] Hans Schaefeer,Helmut Bescke,Gerd Schreyer,et al. Catalyst the production of pyridine and 3-methylpyridine:GB,1422601[P]. 1976-01-28.
[27] Helmut Beschke,Hans Schaefer,Gerd Schreyer. Catalysts for the production of pyridine and 3-methylpyridine:US,3898177[P]. 1975-08-05.
[28] Helmut Beschke,Axel Kleemann,Gerd Schreyer. Catalysis for the production of pyridine and 3-methylpyridine:US,3917542[P]. 1975-11-04.
[29] Helmut Beschke,Franz-ludw ing Dahm,Friedrich,et al. Catalyst for the production of pyridine and 3-methylpyridine:US,3960766[P]. 1976-06-01.
[30] Zenkovets G A,Volodin A M,Bedilo A F,et al. Influence of the preparation procedure on the acidity of titanium dioxide and its catalytic properties in the reaction of synthesis ofβ-picoline by condensation of acrolein w ith ammonia[J].Kinetics and Catalysis,1997,38(5):669-672.
[31] Kenneth Raymond Hargrave. Production of pyridine andβ-picoline:GB,963887[P]. 1964-07-15.
[32] Kenneth Raymond Hargreave. Production ofβ-picoline:GB,887688[P]. 1962-01-24.
[33] Kenneth Raymond Hargreave. Production ofβ-picoline:GB,896049[P]. 1962-05-09.
[34] Kenneth Raymond Hargreave. Production of pyridine bases:GB,920526[P]. 1963-03-06.
[35] Yoshiaki Numa,Akio Nakamachi,Yasukazu Murakam i. Process for producing pyridine andβ-picoline:GB,1192255[P]. 1970-05-20.
[36] 王彩彬,李玉润. 由丙烯醛合成β-甲基吡啶的研究[J]. 中国医药工业杂志,1984(6):1-5.
[37] 王彩彬,李玉润. 经氟处理的氧化铝在合成β-甲基吡啶中的催化作用及活性中心结构[J]. 催化学报,1982,3(3):187-191.
[38] Ian Campbell,John Anthony Corran. Manufacture of pyridine and 3-mehylpyridine:GB,1020857[P]. 1966-02-23.
[39] Helmut Beschke,Heinz Friedrich,Gerd Schreyer,et al. Process for the production of pyridine and 3-methyl pyridine:US,4171445[P]. 1979-10-16.
[40] Antony Harold Patrick Hall. Production of pyridine and picolines:GB,1069368[P]. 1967-05-17.
[41] Helmut Beschke. Process for the production of 2-methylpyridine and 3-methyl pyridine:CA,1063121[P]. 1979-09-25.
[42] Helmut Beschke,Heinz Friedrich. Process for the production of pyridine and 3-methyl pyridine:US,4147874[P]. 1979-04-03.
[43] Helmut Beschke,Heinz Friedrich. Process for the production of 3-methyl pyridine:US,4163854[P]. 1979-08-07.
[44] 张旭之,陶志华,王松汉,等. 丙烯衍生物工学[M]. 北京:化学工业出版社,1995:391-398.
[45] Morita Hiroshi,Semba Katsuhiko,Umezawa Takeshi,et al. Photochem ical fine particle formation in the gas phase from acrolein by a two-photon process[J].Colloids and Surfaces A:Physiochemical and Engineering Aspects,1999,153:203-207.
[46] Ohgomori Yuji,Ichikawa Shuji,Sumitani Naoko. Tail-to-tail dimerization reaction of acrolein[J].Organometallics,1994,13:3758-3760.
[47] Toma Lucio,Quadrelli Paolo,Caramella Pierluigi. Classical and non-classical secondary orbital interactions and coulombic attraction in the regiospecific dimerization of acrolein[J].Tetrahedron Letters Pergamon,2001,42:731-733.
[48] Zânio G Scampini,A lcino P De Aguiar,Mônica R M P Aguiar,et al. Oxime groups introduction in copolymer networks based on acrolein[J].Materials Letters,2004,58:3933-3938.
[49] Yamashita Natsuki,Yoshihara Masakuni,Maeshima Toshihisa. Polymerization of acrolein in the presence of acrolein induced by pyridine and water system[J].Polymer Letters,1972,10:643-646.
[50] Yamashita Natsuki, Inoue Hiroshi, Maeshima Toshihisa. Polymerization of acrolein and methyl vinyl ketone induced by am ine-water and pyridine-phenol systems[J].Journal of Polymer Science:Polymer Chemistry Edition,1979,17:2739-2747.
[51] Graham Sw ift. Catalytic process for the manufacture of pyridine and methylpyridine:GB,1158365[P]. 1969-07-16.
[52] Helmut Beschke,Franz-ludw ing Dahm,Friedrich,et al. Process for the recovery of pyridine and 3-methylpyridine: US,4237299[P].1980-12-02.
[53] Ivanova A S,Al’kaeva E M,Mastikhin V M,et al. Physicochem ical and catalytic properties of silica-alum ina catalysts in the reaction of acrolein condensation w ith ammonia[J].Kinetics and Catalysis,1996,37(3):425-430.
[54] Parks-Sm ith David G. Manufacture of pyridine and 3-methylpyridine:CA,895885[P]. 1972-03-21.
[55] Calvin J R,Davis R D, M cAteer C H. Mechanistic investigation of the catalyzed vapor-phase formation of pyridine and quinoline bases using13CH2O,13CH3OH,and deuterium-labeled aldehydes[J].Applied Catalysis A:General,2005,285:1-23.
Advances in the synthesis of 3-picolineviaacrolein/ammonia reaction
ZHANG Xian1,CHAO Zisheng1,HUANG Denggao1,LUO Caiwu1,LIU Wei1,WANG Kaiming2,PAN Jingang3
(1State Key Laboratory of Chemo/Biosensing and Chemometrics,College of Chemisty and Chemical Engineering,Hunan University,Changsha 410012,Hunan,China;2College of Chem istry and Molecular Engineering,Qingdao University of Science and Technology,Qingdao 266042,Shandong,China;3Beijing Huadi Boyuan Biochem ical Technology Lim ited Company,Beijing 100120,China)
Abatract:This paper reviewed the synthesis of 3-picolineviathe reaction between acrolein and ammonia. It was reported up to now that there are mainly three approaches for the synthesis of 3-picoline from the reaction of acrolein w ith ammonia,i.e.,the liquid-phase reaction in stirring tank reactor,the gas-phase reaction in fixed-bed reactor and the gas-phase reaction in fluidized-bed reactor. The paper described the general features of these reaction processes,w ith comments on their advantages and disadvantages and the related catalysts. It addressed particularly the key issues in the reaction process of acrolein/ammonia to 3-picoline. The foreground of the mesoporous material and solid acid catalysts applied to the reaction and the mechanism researches of 3-picoline prepared from acrolein were also prospected,the mesoporous material and solid acid catalysts applied to the reaction and the mechanism researches were thought to one of the development direction.
3-picoline;acrolein;liquid-phase method;vapor-phase method
TQ 253.21
A
1000–6613(2012)05–1113–08
2011-11-12;修改稿日期:2012-02-05。
湖南省芙蓉学者奖励计划。
张弦(1983—),男,博士研究生。联系人:晁自胜,教授,博士生导师。E-mail zschao@hnu.edu. cn。

