亚低温配合常规治疗对高血压脑出血患者早期炎症反应的影响
覃宗华 成庆辉 潘国斌 彭建民
广东省清远连州市人民医院外三科,广东清远 513400
高血压脑出血是我国常见病,致死、致残率较高,该病在我国死亡原因的顺位统计中占第二位[1]。长期以来,高血压脑出血的基础研究比较薄弱,没有有效的治疗方法。近年来,随着外科手术技术的进步,通过手术、微创引流等技术可以清除高血压脑出血的血肿,但是仍有部分患者预后较差,主要因素是脑出血后、血肿灶周围的脑组织损害。有研究表明,高血压脑出血后炎症反应在周围脑组织损伤中起重要作用,尤其是过度的炎症反应。目前关于高血压脑出血机制的基础研究已经证实脑出血后炎症反应的存在[2]。其中C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)是参与脑组织损害过程的最重要因素。研究显示,亚低温对出血后脑组织继发损伤具有良好的治疗效果,作者选择本科室脑出血患者,采用常规手术、引流等处理后给予亚低温治疗,观察亚低温对患者炎症反应的影响。
1 资料与方法
1.1 入组标准
①影像检查显示颅脑部出血灶,脑出血符合临床诊断标准;②患者有常年高血压史,发病到入院时间短于24 h,年龄小于70岁,意识状况Ⅱ~Ⅲ级;③出血量相对较多,有手术去血肿的指证;④排除脑血管肿瘤、脑血管畸形者、颅脑外伤者、发生脑疝者、精神异常者。
1.2 一般资料
本院2009年10月~2011年8月共53例患者入选,其中,男32例,女21例;年龄39~70岁。根据临床处理方法的不同分为观察组28例,常规组25例,两组一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
1.3 方法
两组患者入院后均给予开颅血肿清除术,去骨瓣减压,术后抗感染、控制血压、脱水、利尿,营养神经治疗等,密切监测患者呼吸、心率、血氧饱和度等生命体征。在此基础上,常规组患者给予常规物理降温,观察组患者给予亚低温治疗,采用亚低温治疗仪,设置体温为34~35度,水温为4~10度,降温开始前30 min,给予冬眠疗法,生理盐水500 mL+异丙嗪50 mg+氯丙嗪50 mg+盐酸哌替啶100 mg,根据患者生命体征调节输液速度,患者体温降至34~35度时,低温治疗仪的温度上升为10~15度。亚低温治疗5 d后停用冬眠合剂,停机后待患者体温自然恢复。
表1 两组一般资料比较(±s)

表1 两组一般资料比较(±s)
组别 例数 性别(男/女) 年龄(岁) GCS评分(分) 发病时间(h)观察组常规组28 25 20/8 18/7 55.7±9.3 57.2±8.4 8.2±2.4 7.9±2.9 7.8±2.6 7.6±3.1
1.4 观察指标
①出血量的测量,所有患者入院后、治疗后均行CT检查,血肿大小根据田氏公式计算:出血量=π/6×长(cm)×宽(cm)×层厚(cm),出血量少于 25 mL 为少量,25~40 mL 为大量。②CRP测量,全部患者,治疗前,治疗3 d、1周、2周采静脉血3 mL,3 000 r/min分离血浆,取血清,采用免疫比浊法测定血浆CRP含量。③TNF-α测量,全部患者分别由治疗前、治疗1周、2周采集周静脉血4 mL,在试管中室温下留置1 h,1 500 r/min离心10 min后,冰箱储存,采用放射免疫法检测血浆TNF-α含量。
1.5 统计学方法
本组数据处理使用SPSS 13.0统计学软件,计量资料采用均数±标准差(±s)表示,组间比较采用t检验,计数资料采用百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 炎症因子与病情的相关性
本文全部患者大量出血43例,少量出血13例,大量出血患者 CRP[(39.13±4.79)mg/L]、TNF-α[(4.37±0.86)ng/mL]均明显高于少量出血患者[CRP(10.06±2.12)mg/L、TNF-α(3.52±0.64)ng/mL],差异有统计学意义(t=7.614、5.421,P < 0.01、P <0.05)。由此说明术后炎症因子的水平与患者出血量的多少即病情的轻重有重要关系。
2.2 两组 CRP、TNF-α比较
观察组患者治疗后3、7、14 d血CRP均较治疗前降低,且观察组CRP水平低于常规组,差异有统计学意义(P<0.05),观察组治疗后7、14 d,TNF-α低于常规组,差异有统计学意义(P < 0.05)。 见表 2。
3 讨论
高血压在世界范围内的发病率均较高,尤其是我国随着人口老龄化的进展,高血压脑出血患者逐渐增多,治疗不及时预后较差,致残率较高。有研究表明,脑出血早期的炎症反应与脑损伤有密切关系,并且CRP与TNF-α参与了脑出血早期炎症反应[3]。
CRP是在感染和组织损伤时血浆浓度快速,急剧升高的主要的急性期蛋白,CRP可以激活补体和加强吞噬细胞的吞噬而起调理作用,从而清除入侵机体的病原微生物和损伤、坏死、凋亡的组织细胞,在机体的天然免疫过程中发挥重要的保护作用[4]。以往的临床研究已经显示,CRP可以作为脑梗死患者预后的重要参考指标[5],但是脑出血患者由于脑损伤,各种细胞因子大量分泌也可刺激CRP增多,并且CRP与多糖、阳离子、磷脂等结合,激活补体,进一步导致脑损伤[6]。TNF-α主要由单核-巨噬细胞分泌,同时他也是一种炎性因子,可促进白细胞趋化作用,引起出血灶外周组织细胞的浸润[7];促进黏附分子产生加剧炎症反应,促进一氧化氮及其它自由基的产生导致氧化损伤等。此外TNF-α除了配合白细胞介素加剧炎症反应外,也是CRP的诱导剂,本文TNF-α与CRP成正相关,也从侧面证实了这一点。高血压脑出血患者预后较差,致残率较高,即使血肿清除,术后继发性水肿、炎症反应等仍明显影响患者预后。
表2 两组治疗前后CRP、TNF-α 比较(±s)
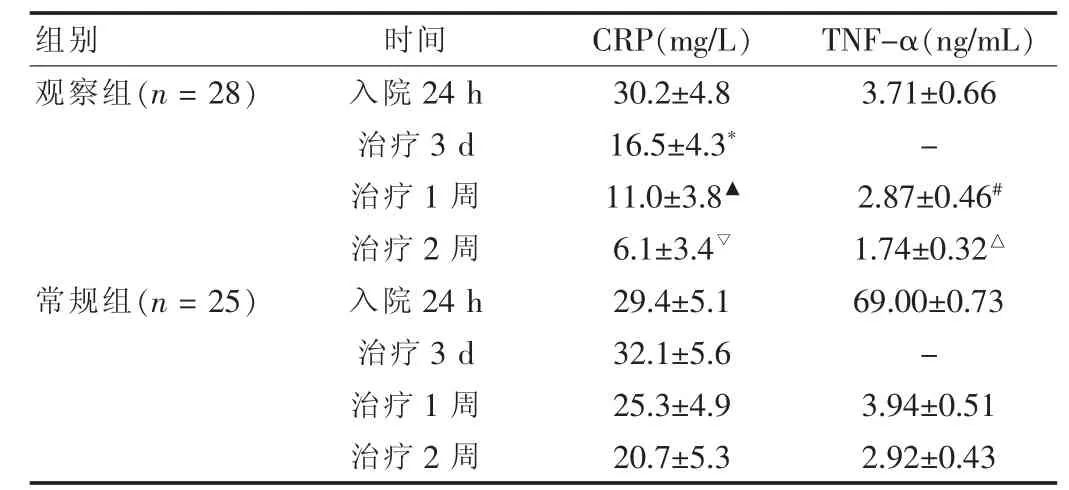
表2 两组治疗前后CRP、TNF-α 比较(±s)
注:与常规组比较,t=7.619,*P < 0.05;t=7.137,▲P < 0.05;t=10.483,▽P < 0.05;t=4.367,#P < 0.05;t=5.279,△P < 0.05;“-”表示未检测
组别 时间 CRP(mg/L) TNF-α(ng/mL)观察组(n=28)常规组(n=25)入院24 h治疗3 d治疗1周治疗2周入院24 h治疗3 d治疗1周治疗2周30.2±4.8 16.5±4.3*11.0±3.8▲6.1±3.4▽29.4±5.1 32.1±5.6 25.3±4.9 20.7±5.3 3.71±0.66-2.87±0.46#1.74±0.32△69.00±0.73-3.94±0.51 2.92±0.43
Kammersgaard等[8]研究报道高血压脑出血后亚低温治疗效果显著,可明显减轻继发性炎症反应、脑水肿等。亚低温对脑出血后脑组织的保护作用主要通过以下几个方面:低温可降低脑代谢水平,减少乳酸堆积;抑制内源性毒素的产生;保护血脑屏障,防止脑水肿。但是如果温度过低会导致患者出现心律失常等并发症,本文笔者采用34~35度亚低温治疗,既可达到低温治疗的效果,又没有出现心律失常、寒颤等并发症。其中亚低温治疗3 d及1、2周后观察组患者血CRP明显下降,其中CRP治疗2 d后即明显下降,TNF-α治疗1周后即明显下降,并且观察组血CRP、TNF-α均显著低于对照组。由此说明,亚低温治疗减轻脑出血后炎症反应确实具有较好的效果,并且方法简便,可以在基层医院推广。
[1]秦家振,李运军,罗永春,等.高血压脑出血术后再出血原因分析及对策[J].中华神经外科疾病研究杂志,2008,7(2):178-179.
[2]汤瑜.高血压脑出血患者血清超敏C反应蛋白的动态观察及其意义[J].咸宁学院学报:医学版,2010,24(4):348-349.
[3]曹姣妃,刘宁,梁德胜,等.急性脑血管病患者血清hs-CRP,TNF-α和IL-6的动态变化及临床意义[J].第四军医大学学报,2004,25(2):173-175.
[4]郭杰,蔺志清,张作洪,等.C-反应蛋白检测与高血压脑出血患者预后的相关性分析[J].浙江临床医学,2009,11(3):300-301.
[5]Di Napoli M,Di Gianfilippo G,Sollecito A,et al.C-reactive protein and outcome after firste-ever ischemic stroke[J].Stroke,2000,31:238-239.
[6]Rallidis LS,Paschos G,liakos GK,et al.Dietary alpha-linolenic acid decreases C-reactive protein serum amyloid A and interleukin-6 in dyslipidaemic patients[J].Atherosclerosis,2003,167(2):237-242.
[7]张明伟,彭俊,刘阳,等.高血压脑出血患者血清和颅内血肿液中IL-1β、IL-6、TNF-α 的含量研究[J].中华神经外科疾病研究杂志,2010,10(2):138-141.
[8]Kammeragaard IP,Rsaalussen BH,Jorgen HS,et al.Feasibility and safety of inducing modest hypothermia in awake patients with acute stroke throughsurfacecooling:acase-controlstudy[J].JStroke,2000,31(9):2251.

